El uso de las cuatro pruebas multigénicas MammaPrint, Oncotype DX, EndoPredict y Prosigna puede ser útil a la hora de decidir sobre la quimioterapia adyuvante. ¿En qué pacientes en concreto deben utilizarse?
Afortunadamente, la tasa de mortalidad por carcinoma de mama ha descendido en las últimas décadas. Las razones de ello son el diagnóstico más precoz de los carcinomas de mama, las nuevas sustancias y también el uso frecuente de quimioterapia adyuvante. Ahora se plantea la cuestión de si la terapia podría desescalarse en algunos pacientes [1].
Decisión basada en factores de riesgo clínicos y patológicos
La decisión sobre qué paciente debía recibir quimioterapia adyuvante y cuál no se tomaba previamente en función de factores de riesgo clínicos y patológicos como el tamaño del tumor, el estado de los ganglios linfáticos, el grado tumoral, el índice de proliferación, la expresión de receptores hormonales y el estado de Her2.
Para los carcinomas triplenegativos (“tipo basal”) y para los tumores Her2 positivos, es indiscutible que debe administrarse quimioterapia adyuvante. Suelen tener un alto índice de proliferación y tienden a crecer de forma más agresiva. Ambos grupos suelen responder bien a la quimioterapia.
La decisión es algo más difícil en el caso de los tumores luminales A positivos para el receptor de estrógenos (RE) bien diferenciados y los tumores luminales B positivos para el RE poco diferenciados, que son más difíciles de distinguir entre sí. Hasta ahora, el índice de proliferación, que se determinaba con la ayuda de una inmunotinción KI-67 no siempre fiable, se ha utilizado para diferenciar.
Pruebas de expresión multigénica
Para poder determinar con mayor certeza qué paciente debe recibir quimioterapia además de terapia antihormonal en el amplio grupo de carcinomas de mama con receptores hormonales positivos, es necesario poder predecir mejor y de forma más individualizada el riesgo.
Por ejemplo, el desarrollo de las micromatrices de ADNc comenzó hace unos 20 años para investigar con más detalle la expresión génica de los tumores. Con estos arrays se pudo determinar simultáneamente la expresión de unos 500 genes. Se descubrió que los tipos de carcinoma de mama biológicamente diferentes también pueden distinguirse entre sí en función del patrón de expresión génica.
Basándose en estos estudios, se han desarrollado pruebas de expresión multigénica para uso clínico rutinario, que se limitan a los genes más importantes que son necesarios para distinguir entre tipos tumorales pronósticamente diferentes y permiten tomar decisiones terapéuticas individuales.
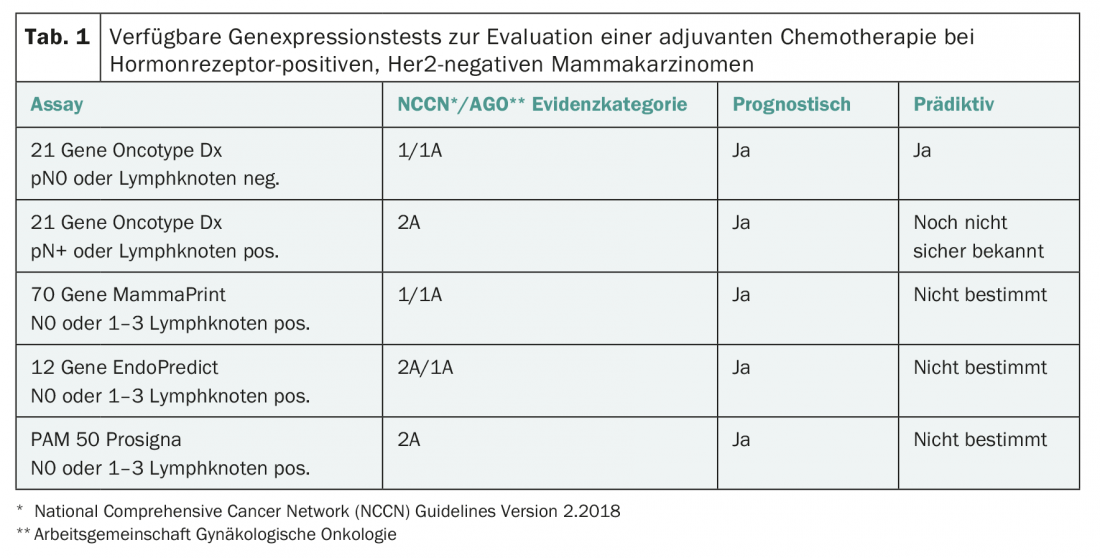
En la actualidad existen en Suiza cuatro pruebas de expresión multigénica de este tipo (Tab. 1) [2–4]:
- MammaPrint: La prueba se realiza de forma centralizada en material tumoral congelado o fijado con formol y examina la expresión génica de 70 genes. MammaPrint distingue el riesgo pronóstico bajo del alto.
- Oncotype DX: La prueba se realiza de forma centralizada en EE.UU. sobre material incluido en parafina y examina la expresión de 21 genes. Es pronóstico del riesgo de recaída en los primeros cinco años y da un valor numérico entre 0 y 100 (“puntuación de recurrencia”) como medida del riesgo de recaída. Basándose en el Oncotype DX, también es posible hacer afirmaciones sobre la eficacia de las quimioterapias [2,3].
- EndoPredict: La prueba se realiza de forma descentralizada, también en Suiza, en tejido fijado en formol o embebido en parafina, evalúa la expresión de ARNm de 12 genes e incluye parámetros clinicopatológicos (tamaño del tumor, número de ganglios linfáticos axilares afectados). Por tanto, no se trata de una prueba genética pura. Se ha validado la importancia pronóstica para la predicción de metástasis tempranas y tardías.
- Prosigna: La prueba examina la expresión de 50 genes y también puede realizarse localmente con el equipo de laboratorio adecuado. Se desarrolló para determinar el subtipo biológico, pero también puede utilizarse con fines pronósticos estimando el riesgo individual de recaída del paciente.
La importancia pronóstica de las cuatro pruebas se demostró en estudios retrospectivos. Ahora también existen datos prospectivos para Oncotype DX y MammaPrint (TAILORx, Mindact [5,6]). Las cuatro pruebas están recomendadas por las directrices internacionales (ASCO, directrices de la ESMO, AGO, Consenso de St. Gallen [1]) como pruebas de pronóstico y actualmente son reembolsadas por las compañías de seguros médicos. Sin embargo, no se da el caso de que los resultados de las diferentes pruebas se correlacionen al 100%. Por ejemplo, una comparación de EndoPredict y Oncotype DX halló una concordancia significativa pero bastante moderada de los resultados del 76% [7].
¿Cuándo es útil la quimioterapia?
Ahora se plantea la cuestión de para qué grupo de riesgo definido por una prueba de expresión genética de este tipo tiene sentido la quimioterapia adyuvante. Esta cuestión se está investigando en los estudios TAILORx y Mindact, actualmente publicados.
El estudio TAILORx [5] es un estudio prospectivo realizado con el ensayo de 21 genes, Oncotype DX. Se incluyeron 10 273 mujeres con carcinoma de mama con receptor hormonal positivo y Her2 negativo sin afectación de los ganglios linfáticos. El resultado de la prueba proporciona una “puntuación de recurrencia” (RS) entre 1 y 100, en la que un valor entre 1 y 11 predice un riesgo bajo de recurrencia para el que no está indicada la quimioterapia, y un valor >25 indica un riesgo alto para el que parece aconsejable la quimioterapia. Hubo ambigüedad entre las mujeres con un riesgo medio entre 11 y 25, que afectó a la mayoría de las pacientes (69%). Este grupo de 9719 mujeres fue aleatorizado en dos brazos de estudio con y sin quimioterapia. Todas las pacientes recibieron terapia antihormonal adyuvante. El periodo medio de observación fue de nueve años. Tras este periodo, ambos grupos de tratamiento presentaron tasas similares de supervivencia libre de enfermedad, a saber, un 83,3% en el grupo tratado exclusivamente con antihormonas y un 84,3% en el grupo que también había recibido quimioterapia. No hubo diferencias en la supervivencia global (93,9% frente a 93,8%), especialmente en las mujeres mayores de 50 años. En pacientes mayores de 50 años y con un RS de 0-25, puede asumirse por tanto que la quimioterapia no aporta ningún beneficio adicional. Entre los pacientes más jóvenes, especialmente los que tenían un RS de 21-25, alrededor del 6,5% se beneficiaron de la quimioterapia.
El estudio Mindact [6] se realizó con la firma de 70 genes MammaPrint. Esta prueba distingue los tumores con bajo riesgo genético de los tumores con alto riesgo genético de aparición de metástasis a distancia al cabo de cinco y diez años. Mindact es un ensayo de fase III que investiga la utilidad de una micromatriz (MammaPrint) como información adicional a los factores de riesgo clínicos en la decisión individual sobre el uso de quimioterapia adyuvante. En 6693 mujeres se determinó el riesgo genético con MammaPrint y el riesgo clínico con la ayuda de “Adjuvant Online”, teniendo en cuenta los factores de riesgo clásicos. Cuando el riesgo clínico y genético coincidían, el tratamiento era claro: los pacientes con bajo riesgo genético y bajo riesgo clínico no recibían quimioterapia y los pacientes con alto riesgo genético y alto riesgo clínico recibían quimioterapia. Las pacientes con riesgo discordante, es decir, alto riesgo genético y bajo riesgo clínico o viceversa, fueron distribuidas aleatoriamente en dos grupos de tratamiento con y sin quimioterapia además de terapia antihormonal. Resultó que la administración de quimioterapia no supuso una diferencia significativa en la supervivencia libre de enfermedad en los grupos discordantes. Observando el grupo de 1550 pacientes con alto riesgo clínico y bajo riesgo genético, sólo existe una diferencia del 1,5% en la supervivencia libre de recidiva a distancia (SLRD) al cabo de cinco años a favor de la quimioterapia. Los pacientes con bajo riesgo clínico y alto riesgo genético no se beneficiaron de la quimioterapia en términos de SLR. Así pues, de este estudio se puede extraer la conclusión de que sólo se deben ofrecer pruebas genéticas a los pacientes con un riesgo clínico elevado y entonces se puede ahorrar la quimioterapia a los pacientes con un riesgo genético bajo, a menos que los pacientes insistan en la quimioterapia para minimizar el riesgo de recaída en otro 1,5%. Sin embargo, estos pacientes no necesitan una prueba genética.
Reunión de Consenso de San Gall 2017
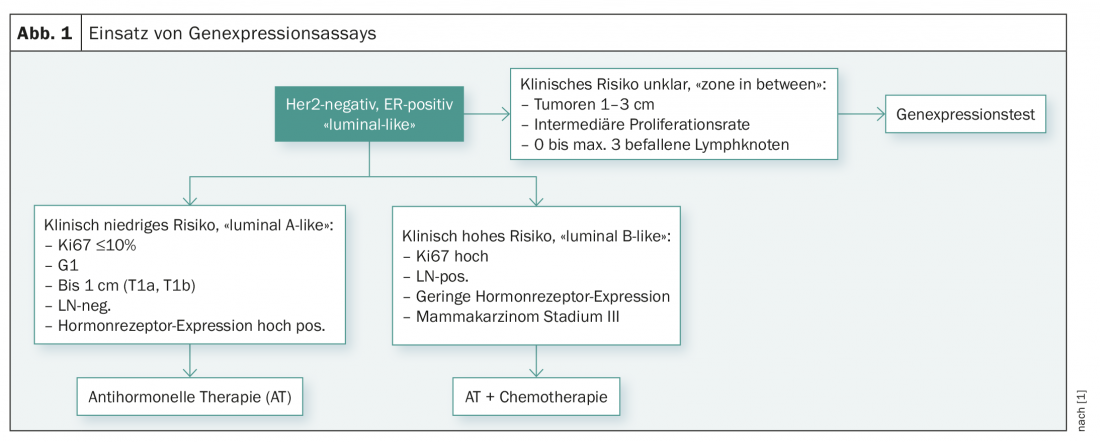
En la Reunión de Consenso de San Gall de 2017, celebrada en Viena, también se debatieron estos estudios y el uso de pruebas multigénicas [1]. Actualmente, los expertos sólo veían la indicación de las pruebas genéticas para responder a la pregunta de si una paciente necesita quimioterapia adyuvante o no. Según la recomendación de consenso actual, las pruebas genéticas no deben realizarse en casos de bajo riesgo clínico (pT1a/b, G1, RE alto, N0, bajo índice de proliferación) y en casos de riesgo clínico claramente alto (baja expresión de receptores hormonales, G3, alto índice de proliferación, afectación de muchos ganglios linfáticos o estadio III). El panel de expertos consideró que las pruebas genéticas sólo eran útiles en pacientes con un perfil de riesgo clínico no del todo claro (tamaño del tumor 1-3 cm, afectación de 0-3 ganglios linfáticos axilares e índice de proliferación intermedio) (Fig. 1).
Literatura:
- Curigliano G, et al: Desescalada y escalada de los tratamientos para el cáncer de mama en estadio precoz: la Conferencia Internacional de Consenso de Expertos de St. Gallen sobre la terapia primaria del cáncer de mama precoz 2017 Anales de Oncología 2017; 28: 1700-1712.
- Paik S, et al: A Multigene Assay to Predict Recurrence of Tamoxifen-Treated, Node-Negative Breast Cancer. N Engl J Med 2004; 351(27): 2817-2826.
- Paik S, et al: Expresión génica y beneficio de la quimioterapia en mujeres con cáncer de mama con receptores de estrógeno positivos y ganglios negativos. J Clin Oncol 2006; 24: 3726-3734.
- Markopoulos C, et al: Pruebas clínicas que respaldan las pruebas genómicas en el cáncer de mama precoz: ¿proporcionan todas las pruebas genómicas la misma información? EJSO 2017; 43: 909-920.
- Sparano JA, et al: Quimioterapia adyuvante guiada por un ensayo de expresión de 21 genes en el cáncer de mama. N Engl J Med 2018; 379: 111-121.
- Cardoso F, et al: Firma de 70 genes como ayuda para la toma de decisiones de tratamiento en el cáncer de mama en estadio precoz. N Engl J Med 2016; 375(8): 717-729.
- Varga Z, et al: Comparación de los resultados de las pruebas EndoPredict y Oncotype DX en el cáncer de mama invasivo con receptores hormonales positivos. PLOS ONE 2013; 8(3): e58483.
- Lux MP, et al.: Análisis del impacto presupuestario de las pruebas de expresión génica para ayudar a tomar decisiones terapéuticas en pacientes con cáncer de mama en Alemania. La mama 2018; 37: 89-98.
Para saber más:
- Sørlie T, et al.: Los patrones de expresión génica de los carcinomas de mama distinguen subclases tumorales con implicaciones clínicas. PNAS 2001; 98(19): 10869-10874.
InFo ONcOLOGíA & HEMATOLOGíA 2018; 6(6): 26-29.