Un nivel de glucosa en sangre mal ajustado puede provocar trastornos del sistema nervioso somático y/o autónomo, ¡y más rápidamente de lo que se cree!
Los trastornos del sistema nervioso somático y/o autónomo son una consecuencia frecuente del control inadecuado de los niveles de glucosa en sangre. Se pudo demostrar una correlación directa entre el nivel de glucosa en sangre, la duración de la hiperglucemia y el desarrollo de neuropatía. Por lo tanto, también puede darse en todas las formas de diabetes mellitus. Debido a la alteración del metabolismo en la célula nerviosa, los productos metabólicos glicosilados se almacenan en el tejido nervioso. Los cambios microvasculares en los capilares nerviosos con el cierre del lumen y el engrosamiento de las paredes de los vasos conllevan una falta de oxígeno, por lo que se produce una pérdida gradual de la función. Cuando se diagnostica la diabetes tipo 2, ya pueden detectarse daños en los nervios periféricos en el 12% de los enfermos. La incidencia aumenta linealmente con el tiempo y alcanza una media del 30%.
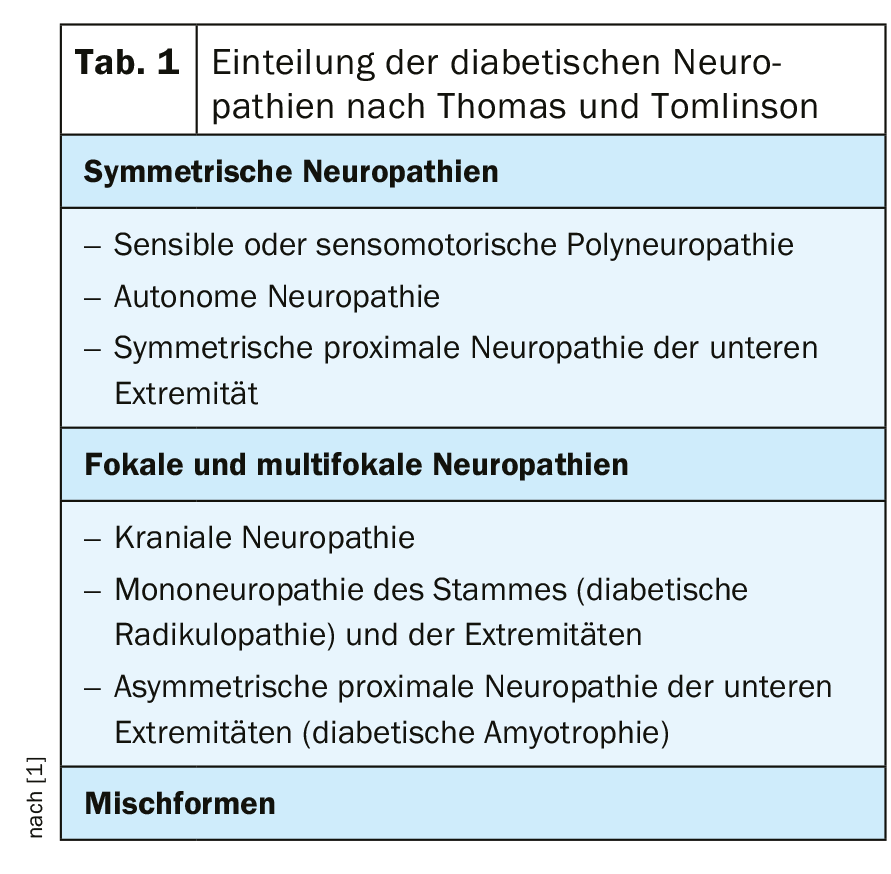
Las neuropatías diabéticas pueden dividirse en neuropatías diabéticas sensoriomotoras y autónomas. Su manifestación se clasifica según criterios clínicos (Tab. 1) [1].
La neuropatía diabética más común es la polineuropatía simétrica distal crónica (PNDS), que representa alrededor del 30% [1]. Se define como la presencia de síntomas y/o signos de disfunción nerviosa periférica en personas con diabetes después de haber excluido otras causas. El riesgo aumenta con el incremento de otros factores de riesgo, indicadores y comorbilidades (recuadro). Sin embargo, hasta la mitad de las enfermedades pueden ser asintomáticas, por lo que a menudo no se reconocen y aumentan el riesgo de úlceras, por ejemplo. Sin embargo, la calidad de vida también puede verse gravemente afectada por el dolor neuropático. Este es el caso de hasta el 25% de todos los afectados. Se distinguen cuatro manifestaciones clínicas:
- Neuropatía subclínica (asintomática): sin quejas ni hallazgos clínicos, las pruebas neurofisiológicas cuantitativas (vibratometría, termestesia cuantitativa, electroneurografía) son patológicas.
- Neuropatía dolorosa crónica (frecuente): Síntomas dolorosos en reposo (simétricos y que aumentan por la noche): Dolor ardiente, punzante o punzante, parestesia, disestesia, entumecimiento, hormigueo desagradable, trastornos del sueño; pérdida de sensibilidad de calidad variable, reducción de los reflejos musculares en ambos lados.
- Neuropatía dolorosa aguda (poco frecuente): El dolor simétrico en las extremidades inferiores y posiblemente también en la zona del tronco están en primer plano; posiblemente hiperestesia adicional; alteraciones sensoriales en las extremidades inferiores o hallazgos normales en la exploración neurológica; puede estar asociado con el inicio o la intensificación de la terapia con insulina (“neuritis insulínica”).
- Neuropatía indolora (frecuente): Ausencia de síntomas o entumecimiento y/o parestesia; sensibilidad reducida o ausente, reflejos musculares ausentes (especialmente el reflejo del tendón de Aquiles), inestabilidad al andar, lesiones o úlceras inadvertidas.

Diagnóstico precoz de la polineuropatía
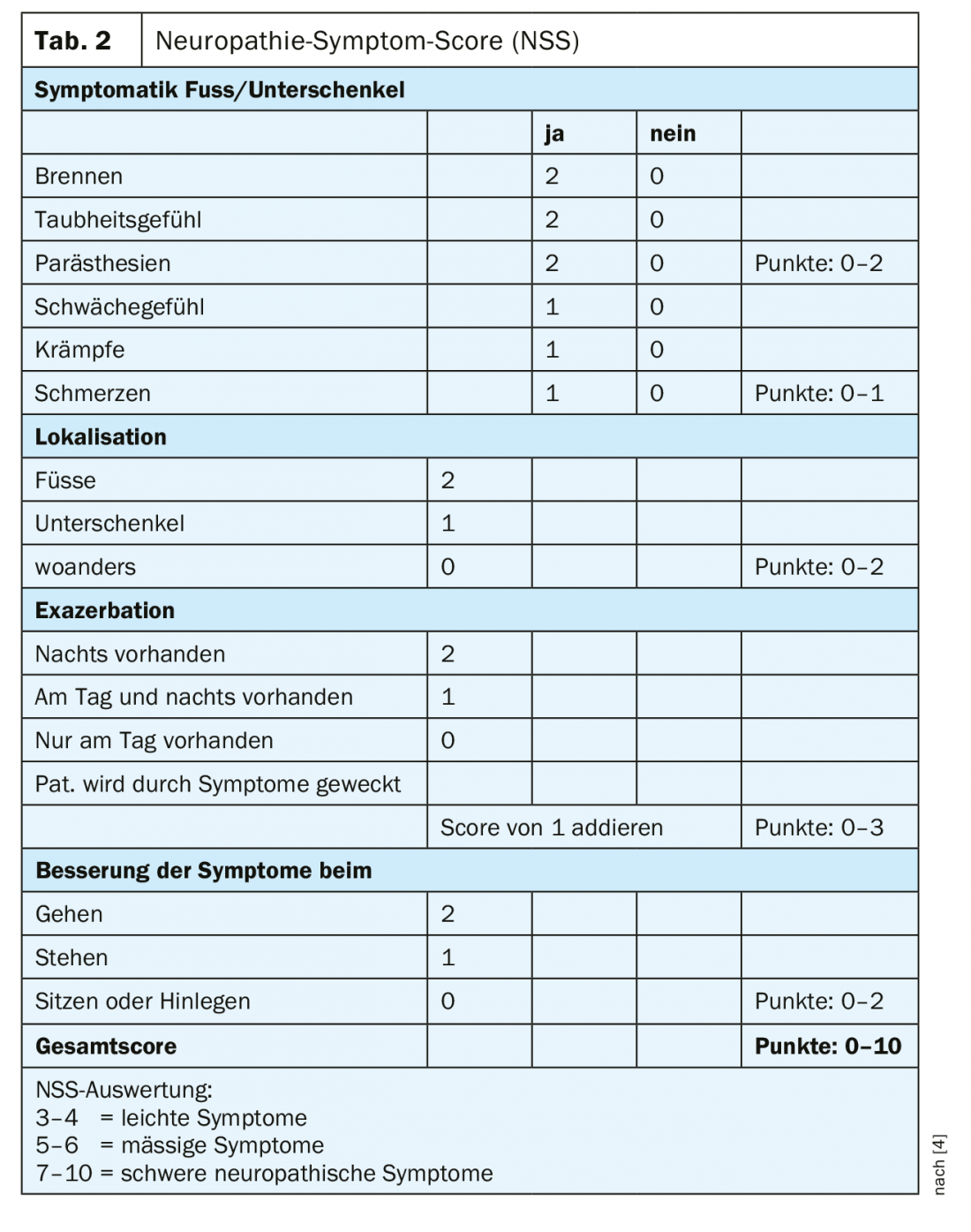
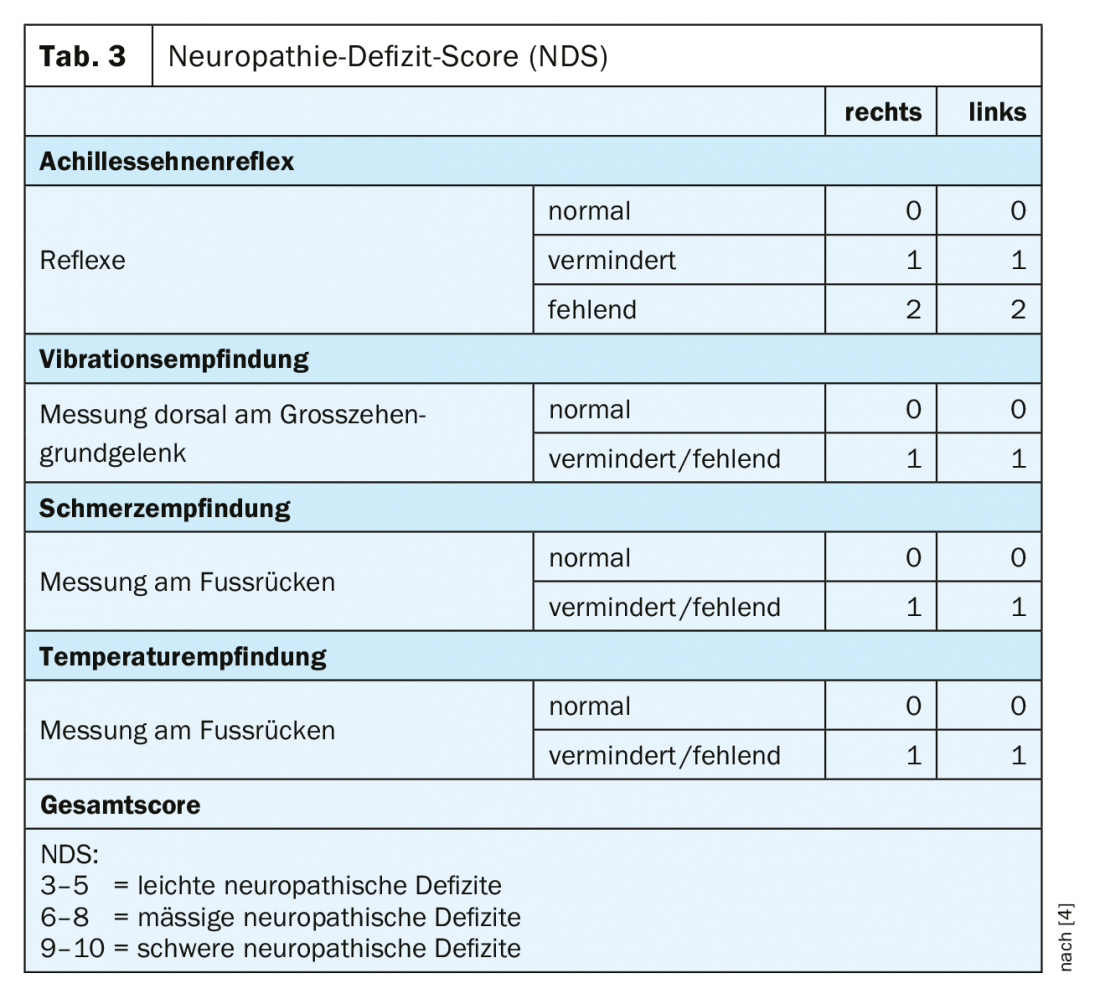
En la práctica, la polineuropatía diabética se reconoce demasiado tarde. Incluso en las formas dolorosas, casi el 60% de los afectados asume que no padece un trastorno del sistema nervioso [3]. Esto hace que el diagnóstico precoz sea aún más importante. El cribado de la polineuropatía diabética sensoriomotora debe incluir un historial con datos personales básicos, información específica sobre la diabetes y el registro de los factores de riesgo, así como los síntomas neuropáticos más y menos. Además, debe realizarse una inspección y un examen clínico, un cribado para detectar complicaciones en los pies y enfermedad arterial periférica, y exámenes neurológicos sencillos. La puntuación de los síntomas de neuropatía (NSS) puede utilizarse para el diagnóstico clínico básico (tabla 2) [4]. Para evaluar la gravedad de la neuropatía, puede utilizarse la puntuación del déficit de neuropatía (NDS) (Tabla 3) [4]. Debe realizarse un examen con respecto a una posible neuropatía en pacientes con diabetes de tipo 2 en el momento del diagnóstico y repetirse anualmente a partir de entonces, en pacientes con diabetes de tipo 1 a más tardar cinco años después del diagnóstico.
Un estudio de las fibras nerviosas intraepidérmicas en pacientes con diabetes de tipo 2 ha demostrado que la polineuropatía no es en absoluto sólo una enfermedad concomitante de las últimas fases de la enfermedad [5,6]. Se pudo demostrar que -a pesar de un buen control de la glucemia con un valor medio de Hba1c de 6,5- ya se produjo muy pronto una disminución de las fibras nerviosas intraepidérmicas de aproximadamente un 20%. Un desarrollo similar puede observarse en las fibras nerviosas de la córnea. Ya en el primer año, disminuyen tanto la longitud como la densidad de las fibras nerviosas [7]. La microscopía corneal confocal (MCC) puede utilizarse para detectar fácilmente estos desarrollos.
Sin embargo, no todas las polineuropatías asociadas a la diabetes mellitus tienen por qué ser polineuropatías diabéticas. Por lo tanto, se recomienda un programa mínimo de medicina interna con los parámetros de laboratorio hemograma, creatinina, VSG, TSH, vitamina B12, ácido fólico, alanina aminotransferasa (ALAT), gamma-GT e inmunoelectroforesis (paraproteinemia) para el diagnóstico diferencial. Si no hay indicios de valores patológicos, debe consultarse a un neurólogo para que lo aclare.
Siempre debe consultarse a un neurólogo si se dan uno o varios de los hallazgos [1]:
- Predominio de los déficits motores sobre los sensoriales,
- rápido desarrollo y progresión de los síntomas,
- Asimetría grave de los déficits neurológicos, mononeuropatía y trastorno de los nervios craneales,
- Progresión de los síntomas a pesar de la optimización de la situación metabólica,
- Inicio de los síntomas en las extremidades superiores,
- Evidencia de otros síntomas neurológicos más allá del síndrome polineuropático diabético,
- Antecedentes familiares de neuropatía.
Régimen de tratamiento de tres columnas
La terapia de la neuropatía diabética se basa esencialmente en tres pilares. La atención se centra en el control óptimo de la diabetes, que incluye el ajuste del estilo de vida y la intervención multifactorial. La terapia patogénica es más eficaz en las NPSD asintomáticas o no dolorosas. El tratamiento sintomático del dolor puede mejorar significativamente la calidad de vida de las personas con DSPN dolorosa. La terapia combinada de duloxetina y pregabalina es útil en este caso (fig. 1).
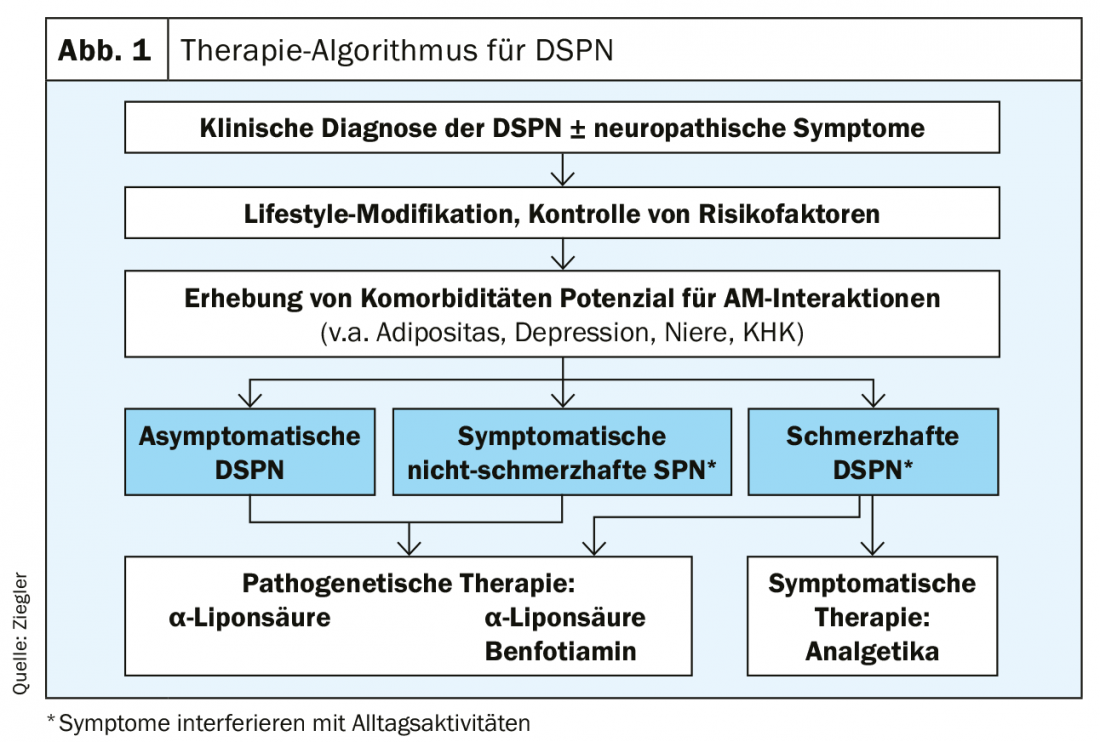
Si la glucemia se reduce demasiado rápido y de forma demasiado significativa al principio en los diabéticos recién diagnosticados, puede producirse una neuropatía inducida por la terapia (TIND) [8]. Especialmente si el nivel de HbA1c se reduce por encima del 7%, puede aparecer una neuropatía dolorosa aguda al cabo de semanas o meses. Esto remite al cabo de un año, pero requiere un tratamiento intensivo con analgésicos. El riesgo puede reducirse significativamente bajando el nivel de HbA1c una media de dos a tres puntos en tres meses.
Para intervenir específicamente en las vías metabólicas del daño microvascular inducido por la hiperglucemia, pueden utilizarse el ácido α-lipoico, la benfotiamina y el actovegin. En el caso del ácido α-lipoico, la dosis debe ser de 600 mg para lograr un buen efecto [9]. Esto puede demostrarse en un periodo de cuatro años [10]. La benfotiamina 600 mg también tuvo un efecto beneficioso sobre los síntomas de la neuropatía [11]. Después de seis semanas, la NSS mejoró significativamente.
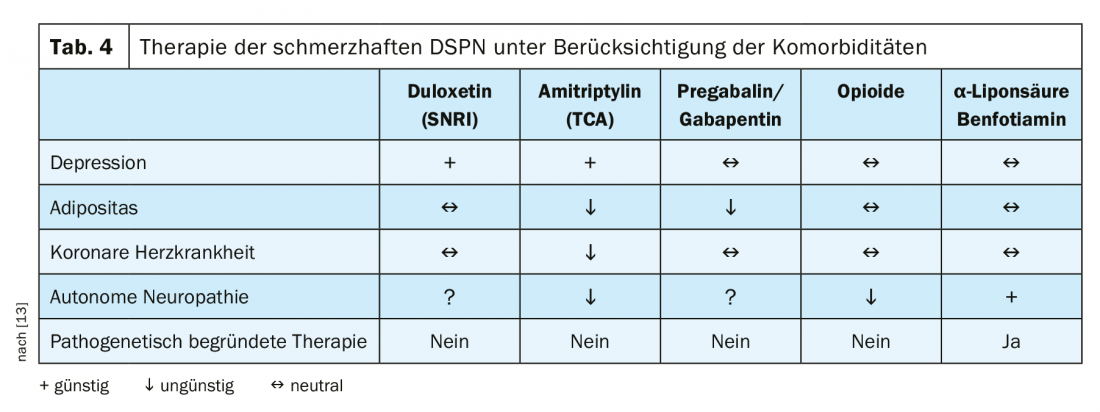
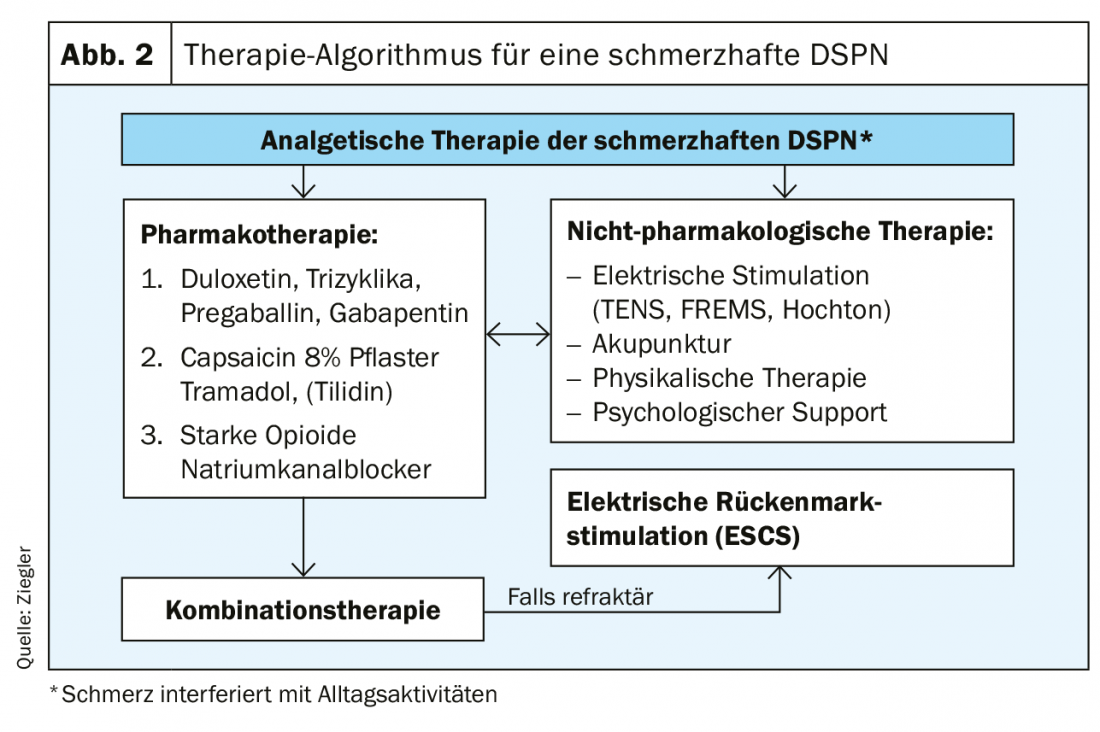
De lo contrario, la terapia puede desarrollarse principalmente de forma sintomática. Estos incluyen el registro del dolor, el estado de ánimo, la funcionalidad y el sueño. Como el dolor es subjetivo, debe utilizarse una Escala Numérica de Calificación del Dolor (NRS) para su evaluación. En cuanto a las pruebas para las terapias del dolor, se encontró una fuerza de pruebas moderada para los IRSN. Los anticonvulsivos, los antidepresivos tricíclicos, los opiáceos atípicos, el ácido alfa lipoico y la estimulación eléctrica de la médula espinal muestran una evidencia baja [12]. Además, la terapia también debe tener en cuenta las comorbilidades. Así pues, un corazón previamente dañado es una contraindicación para los inhibidores no selectivos de la recaptación de monoaminas (Tab. 4) [13]. El algoritmo terapéutico que se muestra en la figura 2 ilustra una vez más con claridad todos los pasos de una terapia analgésica para la DSPN dolorosa.
Mensajes para llevarse a casa
- La neuropatía diabética suele producirse como consecuencia de la diabetes. Contrariamente a la creencia popular de que sólo se manifiesta como una consecuencia tardía a lo largo de un periodo de tiempo más prolongado, ya se podía observar una disminución de las fibras nerviosas en el primer año tras el diagnóstico.
- La polineuropatía simétrica distal crónica es la forma más común de neuropatía diabética (NPSD) y puede dividirse en NPSD sintomática no dolorosa, NPSD dolorosa y NPSD asintomática.
- La terapia depende de la gravedad y de las posibles comorbilidades. Es obligatorio un buen tratamiento de la enfermedad subyacente. Además, existe un tratamiento patogenético y sintomático.
- Además de los IRSN, se dispone de anticonvulsivos, antidepresivos tricíclicos, parches de capsaicina y opiáceos para la terapia farmacológica del dolor en la NPDP.
Literatura:
- Neuropatía NVL en la diabetes de la edad adulta. www.awmf.org/uploads/tx_szleitlinien/nvl-001e_k_S3_Diabetes_Neuropathie_2016-08.pdf (último acceso el 12.06.2019)
- Pop-Busui R, et al: Neuropatía diabética: Declaración de posición de la Asociación Americana de Diabetes. Diabetes Care 2017; 40: 136-154.
- Ziegler D, et al: Las neuropatías dolorosas e indoloras son entidades distintas y en gran medida no diagnosticadas en sujetos participantes en una iniciativa educativa (estudio PROTECT). Diabetes Res Clin Pract 2018; 139: 147-154.
- Ziegler D et al: Neuropatía diabética. Diabetología, 2018; 13: 230-243.
- Strom A, et al: Reducción pronunciada de la densidad cutánea de células de Langerhans en diabéticos de tipo 2 diagnosticados recientemente. Diabetes 2014; 63: 1148 1153.
- Ziegler D, et al.: Sobreexpresión de la superóxido dismutasa mitocondrial cutánea en la diabetes tipo 2 de inicio reciente. Diabetologia 2015; 58: 1621-1625.
- Ziegler D, et al.: Detección precoz de la pérdida de fibras nerviosas mediante microscopía confocal corneal y biopsia cutánea en diabéticos de tipo 2 diagnosticados recientemente. Diabetes 2014; 63: 2454-2463.
- Gibbons CH, Freeman R: Neuropatía de la diabetes inducida por el tratamiento: una complicación aguda e iatrogénica de la diabetes. Cerebro 2015; 138: 43-52.
- Amato Nesbit S, et al: Tratamientos no farmacológicos para los síntomas de la neuropatía diabética periférica: una revisión sistemática. Curr Med Res Opin 2018; 17: 1-11.
- Ziegler D, et al.: Eficacia y seguridad del tratamiento antioxidante con ácido α-lipoico durante 4 años en la polineuropatía diabética: el ensayo NATHAN 1. Diabetes Care 2011; 34: 2054-2060.
- Stracke H, et al: Benfotiamina en la polineuropatía diabética (BENDIP): resultados de un estudio clínico aleatorizado, doble ciego y controlado con placebo. Exp Clin Endocrinol Diabetes 2008; 116: 600-605.
- AHRO: Prevención de las complicaciones y tratamiento de los síntomas de la neuropatía diabética periférica. Comparative Effectiveness Review, número 187, 2017.
- Ziegler D: Polineuropatía diabética dolorosa. Neurología 2012; 31: 140-146.
PRÁCTICA GP 2019; 14(7): 8-11
CARDIOVASC 2019; 18(5): 16-19