La neutropenia es un invitado frecuente en la consulta como cuadro clínico independiente, pero también como síntoma concomitante de muchas enfermedades y como reacción adversa a fármacos. La susceptibilidad asociada a la infección puede ser un reto en muchos casos. Una buena gestión evita consecuencias peligrosas.
La neutropenia es un huésped frecuente en la práctica hematológica y oncológica como cuadro clínico independiente, pero también como síntoma concomitante de muchas enfermedades y como reacción adversa a fármacos. La susceptibilidad asociada a la infección puede ser un reto en muchos casos. Esto se debe, entre otras cosas, a la amplitud del espectro clínico. Desde la situación de emergencia de la neutropenia febril hasta la forma crónica, a menudo inofensiva, todo está representado. En consecuencia, para una gestión óptima, es importante conocer la causa de la neutropenia.
Gravedad de la neutropenia
El enfoque terapéutico también difiere en función de la gravedad y, por tanto, del riesgo de infección. Se entiende por forma leve un recuento absoluto de neutrófilos (CNA) de entre 1000 y 1500 células por microlitro. La neutropenia moderada se presenta con CNA entre 500 y 1000 células por microlitro y la neutropenia/agranulocitosis grave tiene CNA inferiores a 500 células por microlitro (Tabla 1) .
Aunque las formas leves no suelen requerir tratamiento, el uso inmediato y empírico de antibióticos de amplio espectro y, si es necesario, el factor estimulante de colonias de granulocitos (G-CSF) está indicado en casos de fiebre y agranulocitosis [1–3].

No todas las neutropenias son iguales
Para la caracterización de la neutropenia, no sólo es importante su gravedad, sino también su curso. En principio, se distingue entre formas agudas y crónicas. La dinámica temporal, la medicación y las infecciones previas, así como los antecedentes familiares, pueden aportar información sobre el mecanismo subyacente. Existen formas primarias y secundarias de neutropenia (resumen 1) . La neutropenia primaria es mucho más rara que la neutropenia de causa extrínseca. Sin embargo, deben tenerse en cuenta especialmente en pacientes más jóvenes, cursos crónicos desde la infancia y una historia familiar positiva [2–4].

La neutropenia idiopática crónica es una de las neutropenias primarias más frecuentes. Las más afectadas son las mujeres. Con una duración de al menos tres meses, es un diagnóstico de exclusión. En consecuencia, no debe existir ninguna causa genética, infecciosa, inflamatoria, autoinmune, maligna o relacionada con medicamentos. Aunque existe una mayor susceptibilidad a las infecciones bacterianas, la enfermedad suele tener un curso benigno. El tratamiento con G-CSF no siempre es necesario y no se recomienda con valores de ANC superiores a 500 células/µl y sin presencia de infecciones recurrentes [5]. Debe sopesarse individualmente. Hasta ahora, no se ha encontrado ninguna causa para las grandes diferencias individuales en la susceptibilidad a la infección.
La neutropenia étnica benigna, que afecta principalmente a personas de origen africano y mediterráneo, no suele tener efectos clínicos o su curso es leve [6]. Esto también se aplica a la neutropenia familiar benigna, que está claramente determinada genéticamente pero es independiente del origen étnico [2]. Aunque se desconoce la base genética de la neutropenia familiar benigna, la neutropenia étnica benigna se asocia a variantes del receptor del antígeno Duffy [7,8].
Otro ejemplo de neutropenia congénita mayoritariamente leve es la neutropenia cíclica. Se trata de un trastorno hereditario autosómico dominante, a menudo con mutaciones en el gen ELANE [9]. Se caracteriza por fluctuaciones periódicas en el recuento de neutrófilos con un tiempo de oscilación de unos 21 días. Durante el nadir, algunos pacientes desarrollan aftas orales u otras infecciones, pero el curso general es mayoritariamente benigno [2].
Por otro lado, el síndrome de Kostmann, también conocido como neutropenia congénita grave (SCN), es una afección que conlleva una alta susceptibilidad a las infecciones ya en la infancia y aumenta el riesgo de desarrollar leucemia mieloide aguda [10]. La neutropenia persistente en niños, adolescentes o adultos jóvenes puede indicar una insuficiencia subyacente de la médula ósea. En estos casos, se recomienda una mayor aclaración por parte de expertos especializados.
Aunque la neutropenia congénita e idiopática no debe descuidarse en el esclarecimiento de las causas, la neutropenia aislada es adquirida en la mayoría de los casos. Diversos fármacos, enfermedades de la médula ósea, síntomas de deficiencia, infecciones y procesos inmunológicos pueden considerarse desencadenantes.
Un fenómeno común: la neutropenia inducida por fármacos
La mayor proporción de neutropenias se debe a la medicación [1,11–13]. La incidencia de la agranulocitosis iatrogénica es de aproximadamente 1-5 por millón de población al año, con una tasa de mortalidad de alrededor del 5% [1,14]. Normalmente, existe una asociación temporal con la terapia farmacológica. En principio, muchos fármacos pueden causar neutropenia por dos mecanismos diferentes, siendo más de la mitad de los casos desencadenados por unos pocos agentes (Visión general 2) [11–16,22]. Por un lado, los anticuerpos inducidos por fármacos pueden provocar una destrucción inmunomediada de los granulocitos neutrófilos. Por otro lado, existen agentes con efectos citotóxicos directos sobre los precursores mieloides, como las fenotiazinas, la clozapina, la dapsona y la procainamida [15].

A diferencia de la neutropenia inmunomediada, la toxicidad directa depende de la dosis. Mientras que aquí la cantidad hace el veneno, el daño a los granulocitos en el contexto de la formación de anticuerpos inducida por fármacos es independiente del tiempo y la dosis. Dado que es probable que la sensibilización dure toda la vida, basta una pequeña dosis de la sustancia desencadenante para provocar una y otra vez neutropenia o incluso agranulocitosis. Debido a los diferentes mecanismos de daño de los neutrófilos, los efectos de los distintos fármacos son difíciles de predecir y caracterizar. La figura 1 ofrece una visión general de algunos valores empíricos.
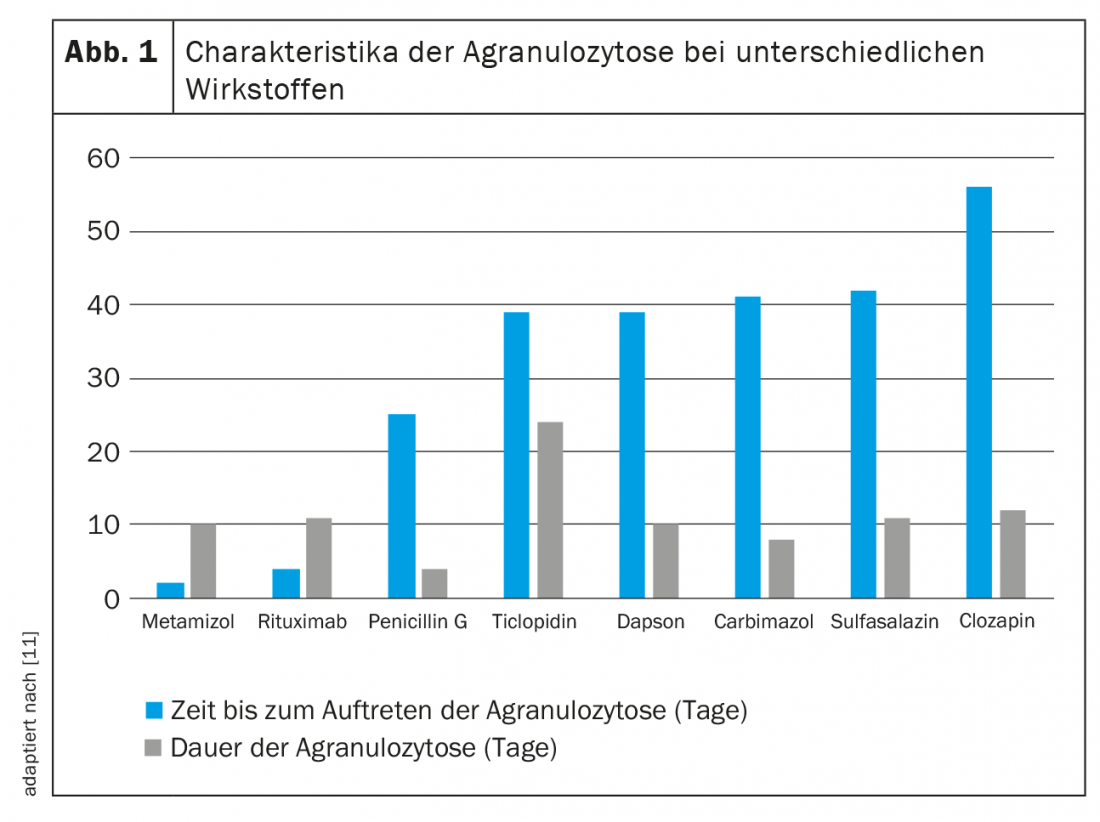
Probablemente el agente más notorio que plantea un riesgo de agranulocitosis es el metamizol (Novalgin®). Los datos correspondientes se publicaron ya en 1964 [16]. La neutropenia suele aparecer en los dos primeros meses de tratamiento y se normaliza en dos semanas [11]. Se estima que el riesgo de neutropenia inducida por metamizol se sitúa entre 1/116 y 1/466 000 exposiciones. El riesgo absoluto es bajo con una dosificación normal y un uso breve, con grandes diferencias geográficas [17,18]. Mientras que la incidencia es alta en Suecia, por ejemplo, parece ser menor en los Países Bajos o España. Esto podría deberse a los diferentes patrones de uso, ya que el riesgo aumenta con una administración más prolongada del fármaco y una medicación conjunta desfavorable. La suposición de que, por ejemplo, los británicos, irlandeses y escandinavos tienen un mayor riesgo de agranulocitosis relacionada con el metamizol debido a su origen étnico se investigó en un estudio epidemiológico [19]. Así se llegó a la conclusión de que ciertos alelos HLA también podrían tener relación con el desarrollo de neutropenia bajo tratamiento con metamizol.
La conclusión es que el metamizol -aunque crítico desde un punto de vista hematológico- es una elección defendible en algunos casos a pesar del riesgo de agranulocitosis, especialmente en comparación con analgésicos alternativos como los antiinflamatorios no esteroideos (AINE). Éstos suelen tener un perfil de efectos secundarios aún menos favorable, lo que no debe desdeñarse [20]. Sin embargo, el metamizol debe utilizarse con precaución y con el cuidado necesario. Aunque no se recomiendan controles de laboratorio regulares en pacientes asintomáticos, las personas afectadas deben ser educadas sobre el riesgo de agranulocitosis y sus síntomas [21].
En general, la edad avanzada, el mal estado funcional, la sepsis o el shock, la insuficiencia renal y los valores de ANC inferiores a 100 células/µl se consideran factores de pronóstico desfavorable en la neutropenia inducida por fármacos [1]. Por otro lado, la terapia con antibióticos intravenosos de amplio espectro y G-CSF mejora el pronóstico [1]. Gracias a la creciente experiencia en el tratamiento de los pacientes afectados, en los últimos años se han logrado grandes avances en este campo. Sin embargo, la administración de G-CSF en particular sigue siendo controvertida. Estadísticamente, la administración muestra hospitalizaciones más cortas y un menor uso de antibióticos, pero no existen directrices claras sobre el uso del G-CSF en la agranulocitosis no inducida por fármacos [13,22–24]. Si el recuento de neutrófilos es inferior a 100 células/µl, deben administrarse factores de crecimiento hematopoyético; de lo contrario, la decisión debe sopesarse individualmente.
Neutropenia e infecciones: La gallina y el huevo
Virus como el VIH, el VEB, el CMV , la hepatitis A y el Sars-CoV-2 pueden causar neutropenia. Además, puede producirse neutropenia en la fiebre tifoidea, la brucelosis, la tularemia, la shigelosis y la tuberculosis, y la deficiencia de neutrófilos favorece de nuevo la infección. Las rickettsias y diversos parásitos también pueden causar neutropenia. La gripe está más extendida en nuestras latitudes y afecta a Suiza todos los años. La mayoría de los casos de neutropenia son leves y transitorios, pero existe una clara asociación. El riesgo parece ser mayor para la gripe B que para la gripe A [25]. Otro riesgo que puede eliminarse con la vacunación antigripal.
Gestión en la vida clínica diaria
Aunque la fiebre en la neutropenia es siempre una indicación para una terapia antibiótica adecuada con o sin administración de G-CSF, la búsqueda posterior de la causa suele resultar un proceso largo (Fig. 2) [2,3]. Los cursos crónicos, especialmente leves, en la edad adulta son más indicativos de formas primarias de neutropenia como la neutropenia étnica benigna. Una aparición aguda, por otro lado, es un indicador de una génesis farmacológica o infecciosa del trastorno, especialmente si existe una exposición correspondiente en el historial. Si los recuentos de neutrófilos se normalizan en el curso de la enfermedad, no es necesario realizar más aclaraciones en este caso. Sin embargo, si la etiología sigue sin estar clara, debe realizarse un examen de la médula ósea.
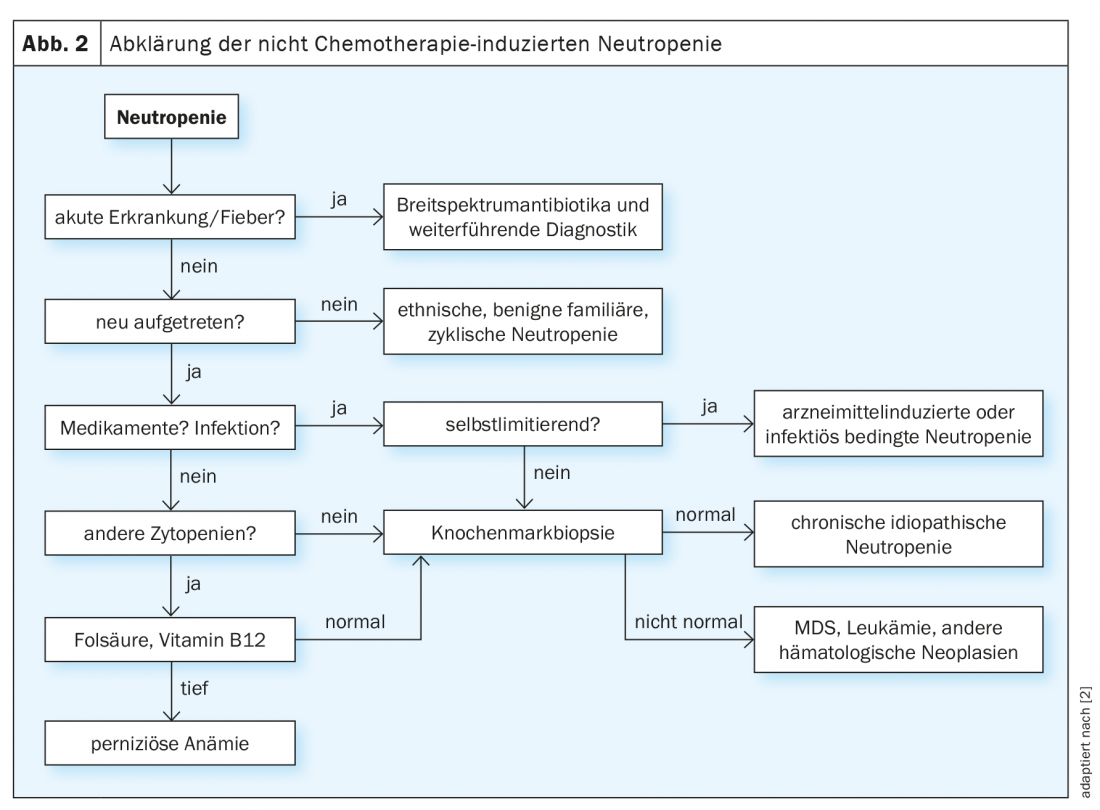
La terapia de la neutropenia no inducida por quimioterapia depende principalmente del riesgo individual de infección y de la causa, por lo que el espectro va desde la administración continua de G-CSF hasta un procedimiento de espera. Es importante que todos los pacientes conozcan su riesgo individual de infección, así como los signos de advertencia y las precauciones, y puedan actuar en consecuencia.
En caso de infecciones agudas, puede considerarse la administración de G-CSF [2,3,26]. Nunca debe basarse exclusivamente en el recuento de neutrófilos y, por tanto, sólo debe utilizarse en la neutropenia sintomática. Incluso un aumento del CNA por encima de 250 a 300 células/µl puede reducir drásticamente la tasa de infección en pacientes sintomáticos [2].
Por supuesto, la terapia causal de la neutropenia -si está disponible- es la primera prioridad. La sustitución por ácido fólico y vitamina B12 así como, por ejemplo, la terapia de la neutropenia autoinmune con metotrexato o ciclofosfamida son sólo algunos ejemplos que demuestran la importancia de un esclarecimiento adecuado de las causas [27].
Caso especial COVID-19
Existen pocos datos, aunque bastante preocupantes, sobre la administración de G-CSF en presencia de infección por Sars-CoV-2, especialmente en pacientes tumorales. Por ejemplo, en un estudio que incluyó a 55 pacientes, se observó un peor pronóstico de la enfermedad con el tratamiento con G-CSF [28]. Las 16 personas que recibieron G-CSF tuvieron una mayor demanda de oxígeno y mortalidad. En un estudio de tres casos, se postuló que el G-CSF promovía la inflamación y la activación de los macrófagos. En todos los pacientes, el deterioro clínico se produjo alrededor de 72 horas después de la administración del fármaco [29]. Se describieron observaciones comparables en otro informe de un caso de un paciente de 47 años con COVID-19 [30].
El riesgo del tratamiento con G-CSF en presencia de COVID-19 no puede evaluarse de forma concluyente sobre la base de los datos actuales. La necesidad de datos adicionales es grande y esto podría ser revolucionario para los años venideros.
Outlook
Actualmente se está llevando a cabo en el Inselspital Universitario de Berna un análisis retrospectivo de todos los casos con neutropenia aislada inferior a 500 células/µl entre 2015 y septiembre de 2020. No se incluyen los pacientes con quimioterapia o radioterapia ni aquellos con otras citopenias concomitantes. El objetivo principal es recopilar datos sobre la causa, la terapia, las tasas de infección y hospitalización, así como otros resultados. Esperamos descubrir correlaciones que puedan ser relevantes para la estratificación del riesgo y, por tanto, también terapéuticamente.
Mensajes para llevarse a casa
- La neutropenia/agranulocitosis debe recibir nuestra atención debido al mayor riesgo de infección con posibles cursos graves.
- La neutropenia inducida por fármacos es la forma más común de neutropenia aislada.
- Las formas benignas crónicas de neutropenia en adultos son diagnósticos de exclusión y suelen tener un curso benigno.
- El tratamiento con G-CSF debe sopesarse siempre individualmente y se recomienda en caso de infecciones recurrentes y recuentos de neutrófilos inferiores a 0,5 ×109/L. No se recomienda la administración profiláctica de antibióticos.
- Puede producirse neutropenia como resultado de la infección por COVID-19. El efecto del G-CSF en pacientes con COVID-19 aún no está claro. El uso de G-CSF, especialmente en pacientes tumorales, debe hacerse con precaución hasta que se disponga de más datos.
Literatura:
- Andres E, et al: Presentación clínica y tratamiento de la agranulocitosis inducida por fármacos. Revisión experta de hematología 2011; 4(2): 143-151.
- Gibson C, Berliner N: Cómo evaluamos y tratamos la neutropenia en adultos. Sangre 2014; 124(8): 1251-1258.
- Dale DC: Cómo diagnostico y trato la neutropenia. Opinión actual en hematología 2016; 23(1): 1-4.
- Palmblad J, et al: Cómo diagnosticamos y tratamos la neutropenia en adultos. Revisión experta de hematología 2016; 9(5): 479-487.
- Dale DC, Bolyard AA: Actualización sobre el diagnóstico y el tratamiento de la neutropenia idiopática crónica. Curr Opin Hematol 2017; 24(1): 46-53.
- Atallah-Yunes SA, Ready A, Newburger PE: Neutropenia étnica benigna. Revisiones de sangre 2019; 37: 100586.
- Rappoport N, et al: El receptor del antígeno Duffy para quimiocinas, ACKR1,- ‘Jeanne DARC’ de la neutropenia benigna. Revista británica de hematología 2019; 184(4): 497-507.
- Reich D, et al: La reducción del recuento de neutrófilos en personas de ascendencia africana se debe a una variante reguladora en el gen del receptor del antígeno Duffy para quimiocinas. PLoS Genet 2009; 5(1): e1000360.
- Dale DC: Neutropenia cíclica y crónica: actualización sobre diagnóstico y tratamiento. Avances clínicos en hematología y oncología 2011; 9(11): 868-869.
- Welte K, Zeidler C, Dale DC: Neutropenia congénita grave. Seminarios de hematología. 2006; 43(3): 189-195.
- Andersohn F, Konzen C, Garbe E: Revisión sistemática: agranulocitosis inducida por fármacos no quimioterápicos. Anales de medicina interna 2007; 146(9): 657-665.
- Garbe E: Agranulocitosis no inducida por fármacos quimioterápicos. Opinión experta sobre la seguridad de los medicamentos 2007; 6(3): 323-335.
- Andres E, et al: Tratamiento moderno de la agranulocitosis inducida por fármacos no quimioterápicos: un estudio de cohortes monocéntrico de 90 casos y revisión de la literatura. Revista europea de medicina interna 2002; 13(5): 324-328.
- Kaufman DW, et al: Incidencia relativa de la agranulocitosis y la anemia aplásica. Am J Hematol 2006; 81(1): 65-67.
- Tesfa D, Keisu M, Palmblad J: Agranulocitosis idiosincrásica inducida por fármacos: posibles mecanismos y tratamiento. Revista americana de hematología 2009; 84(7): 428-434.
- Huguley CM: Agranulocitosis inducida por la dipirona, un antipirético y analgésico peligroso. JAMA 1964; 189: 938-941.
- Ibáñez L, et al: Agranulocitosis asociada a dipirona (metamizol). Revista europea de farmacología clínica 2005; 60(11): 821-829.
- Hedenmalm K, Spigset O: Agranulocitosis y otras discrasias sanguíneas asociadas a la dipirona (metamizol). Revista europea de farmacología clínica 2002; 58(4): 265-274.
- Shah RR: Agranulocitosis inducida por metamizol (dipirona): ¿Varía el riesgo según la etnia? J Clin Pharm Ther 2019; 44(1): 129-133.
- Fauler J: Efectos no deseados de los AINE y los coxibs. MMW Avances en Medicina 2005; 147(31-32): 31-35.
- Stamer UM, et al.: Dipirona (metamizol): Consideraciones sobre la monitorización para la detección precoz de la agranulocitosis. Dolor 2017; 31(1): 5-13.
- Njue L, Baerlocher GM: Neutropenia/agranulocitosis inducida por fármacos. el médico informado 2018; 02/2018: 23-26.
- Beauchesne MF, Shalansky SJ: Agranulocitosis inducida por fármacos no quimioterápicos: revisión de 118 pacientes tratados con factores estimulantes de colonias. Farmacoterapia 1999; 19(3): 299-305.
- Sprikkelman A, de Wolf JT, Vellenga E: La aplicación de factores de crecimiento hematopoyético en la agranulocitosis inducida por fármacos: revisión de 70 casos. Leucemia 1994; 8(12): 2031-2036.
- Higgins P, et al: Tasas de neutropenia en adultos con gripe A o B: un análisis retrospectivo de pacientes hospitalizados en el sureste de Queensland durante 2015. Intern Med J 2016; 46(11): 1328-1332.
- Dale DC, et al: Ensayo de fase III controlado y aleatorizado del factor estimulante de colonias de granulocitos humanos recombinante (filgrastim) para el tratamiento de la neutropenia crónica grave. Sangre 1993; 81(10): 2496-2502.
- Starkebaum G: Neutropenia crónica asociada a enfermedad autoinmune. Seminarios de hematología 2002; 39(2): 121-127.
- Morjaria S, et al: Efecto de la neutropenia y el filgrastim (G-CSF) en pacientes con cáncer infectados por COVID-19. medRxiv 2020.
- Nawar T, et al.: Factor estimulante de colonias de granulocitos en COVID-19: ¿estimula algo más que la médula ósea? Am J Hematol 2020; 95(8): E210-E3.
- Taha M, Sharma A, Soubani A: Deterioro clínico durante la recuperación de la neutropenia tras la terapia con G-CSF en un paciente con COVID-19. Informes de casos de medicina respiratoria 2020; 31: 101231.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2021; 9(1): 5-9