El atezolizumab permite la supervivencia a largo plazo de algunos pacientes con cáncer de pulmón pretratados. El alectinib también ayuda a los pacientes a llevar una vida cotidiana más tolerable al reducir los síntomas de la enfermedad a largo plazo. Estos son los resultados de dos estudios del ELCC.
El ensayo de fase II denominado POPLAR aleatorizó a 287 pacientes de un total de 13 países. Todas padecían una forma avanzada de cáncer de pulmón no microcítico (CPNM) y ya habían recibido tratamiento para ello. Una parte se sometió a inmunoterapia con el anticuerpo anti-PD-L1 atezolizumab, la otra a quimioterapia con docetaxel.
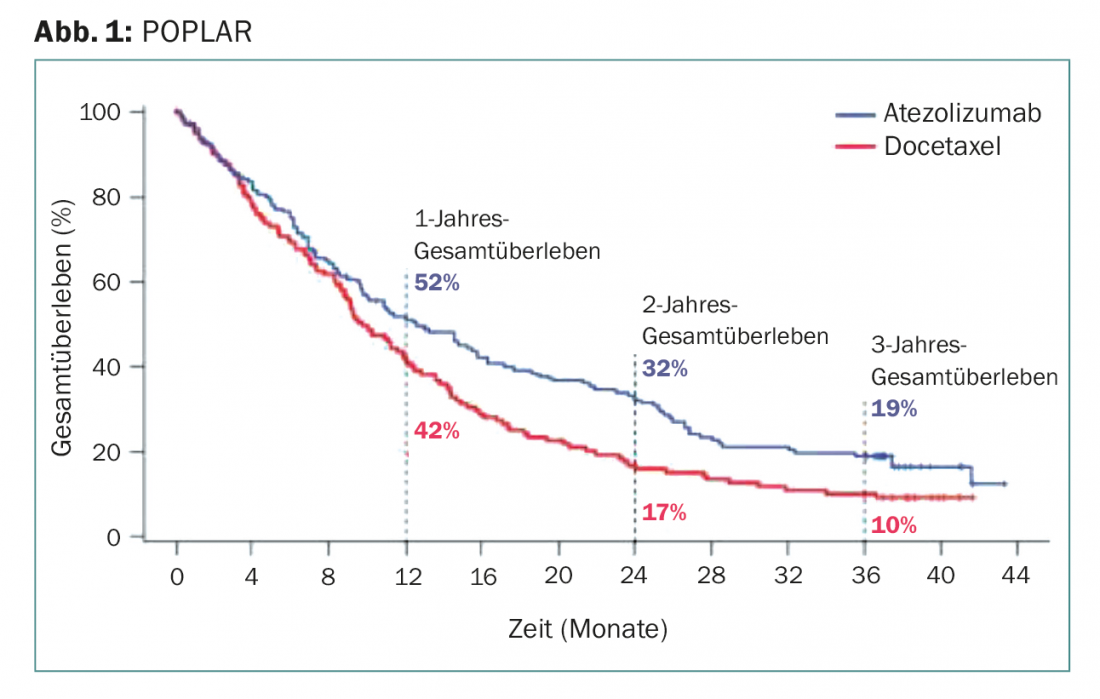
Después de dos y tres años -el seguimiento más largo de la inmunoterapia PD-L1 en este escenario hasta la fecha- el atezolizumab fue significativamente superior al docetaxel (Fig. 1):
- Aproximadamente un tercio del primer grupo seguía vivo después de dos años. En el grupo de docetaxel, la tasa de supervivencia fue la mitad de baja (16,6%).
- Incluso después de tres años, la inmunoterapia seguía multiplicando por dos la supervivencia, del 10% con docetaxel al 18,7% con atezolizumab.
- El beneficio fue independiente de la expresión de PD-L1 evaluada prospectivamente y de la histología (carcinoma de células escamosas o no). Incluso los pacientes con expresión de PD-L1 en menos del 1% de las células tumorales e inmunitarias siguieron beneficiándose.
Además, la duración de la respuesta se triplica (con la misma elevada tasa de respuesta global del 15%) y se producen menos acontecimientos adversos con la inmunoterapia. La sustancia de prueba fue bien tolerada (lo suficiente) para ser administrada durante varios años. Así, con la inmunoterapia, algunos pacientes se consideran ahora “supervivientes a largo plazo del cáncer de pulmón”, han vuelto al trabajo y tienen una calidad de vida más o menos buena.
Los datos de eficacia de POPLAR se confirmaron en el ensayo de fase III denominado OAK [1].
¿Qué conclusiones pueden extraerse de POPLAR?
Basándose en los análisis de subgrupos de POPLAR, el atezolizumab parece ser una opción para todos los pacientes con CPNM avanzado. Sin embargo, esto también dificulta la predicción de qué pacientes se beneficiarán del fármaco a largo plazo. No se sabe exactamente quiénes son esta quinta parte de pacientes que siguen vivos después de tres años, ni cómo se caracterizan. Así pues, la definición de biomarcadores predictivos sigue siendo un reto.
Al mismo tiempo, la cifra de aproximadamente una quinta parte de supervivientes a 3 años representa un resultado extremadamente bueno en este colectivo. El atezolizumab se eleva así a las filas de los agentes con las tasas de supervivencia más elevadas de la historia en pacientes con cáncer de pulmón previamente tratados. Antes de la inmunoterapia, prácticamente no había supervivientes a largo plazo con CPNM. Ahora, a la luz de los datos de un nuevo estudio, esto es posible por primera vez. Los resultados del POPLAR están flanqueados y respaldados por las tasas de supervivencia a 3 y 5 años comparables de los estudios con los anticuerpos anti-PD1 pembrolizumab y nivolumab [2]. Con esta última, alrededor del 15% de los pacientes seguían vivos después de cinco años (fase I), lo que normalmente ya se considera “curado” en cáncer. POPLAR tiene una relevancia crítica como gran ensayo aleatorizado que ahora confirma el beneficio de supervivencia a largo plazo para el enfoque PD-L1.
Si analizamos la situación general de los estudios, hoy en día hay mucho que decir a favor de que todos los pacientes con CPNM en formas avanzadas reciban inmunoterapia. Por último, la probabilidad de supervivencia a 5 años parece ser de aproximadamente 1:6. Desgraciadamente, como tantas veces en los últimos tiempos, las cuestiones financieras siguen abiertas. ¿Cómo podría nuestro sistema sanitario sostener una prescripción más amplia de inmunoterapia? Probablemente sólo si se pudiera identificar a los pacientes que sin duda no se beneficiarían de tal estrategia. Ahora, sin embargo, la expresión de PD-L1 en POPLAR ha demostrado una vez más ser un biomarcador inadecuado. Aunque los individuos con niveles de expresión extremadamente bajos sigan beneficiándose en términos de supervivencia, no puede utilizarse por sí solo para la exclusión. Actualmente, la investigación de biomarcadores está en pleno apogeo. En el futuro, es probable que se utilice cada vez más un “paquete” de biomarcadores, que posiblemente incluya la carga de mutaciones tumorales. Sin embargo, con respecto a la combinación de biomarcadores, se necesitan estudios realizados en poblaciones similares a las de los estudios con atezolizumab, pembrolizumab y nivolumab mencionados anteriormente. Por lo tanto, primero habría que definir con precisión a los supervivientes a largo plazo (demográficamente, historial de tabaquismo, carga de mutaciones tumorales, respuesta inmunitaria, nivel de expresión, etc.) y, en un siguiente paso, estudiar qué biomarcadores (en conjunto) son más predictivos.
El atezolizumab (Tecentriq®) está aprobado actualmente en Suiza para el tratamiento de pacientes con CPNM localmente avanzado o metastásico, tras quimioterapia previa. El tratamiento requiere la aprobación de los costes por parte de la aseguradora médica tras consultar previamente con el médico forense.
Noticias sobre ALEX
El ensayo ALEX [3] publicado en agosto del año pasado investigó el inhibidor selectivo de la cinasa ALK y RET alectinib en fase III. Se considera un inhibidor de la tirosina quinasa de “próxima generación”. En una muestra de 303 pacientes con CPNM con enfermedad avanzada no tratada previamente y mutación oncogénica impulsora (ALK), el agente en investigación demostró una eficacia y una seguridad/tolerabilidad superiores a las del anterior inhibidor de la tirosina cinasa estándar, el crizotinib. En general, alrededor del 4% de todos los pacientes con CPNM son ALK-positivos y, por tanto, más susceptibles de sufrir metástasis en el SNC. Entre otras cosas, el riesgo de progresión o muerte se redujo significativamente en más de un 50% en el estudio directo, y la progresión del SNC fue significativamente menos frecuente (12% frente a 45%, HR 0,16, p<0,001).
En el ELCC de Ginebra, la atención se centró ahora en los resultados del ALEX que podían ser evaluados por los propios pacientes, es decir, la carga de la enfermedad, la tolerabilidad de los síntomas y la calidad de vida relacionada con la salud. Para ello, se utilizó el cuestionario validado QLQ-C30 de la EORTC con el apéndice modular QLQ-LC13, desarrollado específicamente para pacientes con cáncer de pulmón. Los síntomas correspondientes de la enfermedad pueden recogerse en un cuestionario de 13 partes. Las características basales de los pacientes evaluables (aproximadamente dos tercios de cada uno de los grupos de alectinib y crizotinib) eran comparables. Los pacientes rellenaron los cuestionarios al inicio y mensualmente después, en el plazo de un mes tras la retirada del estudio (aunque rara vez se interrumpió el tratamiento debido al empeoramiento de los síntomas) y tras la progresión de la enfermedad.
Ambos agentes provocaron una mejora significativa de los síntomas de la enfermedad. Si nos fijamos en el complejo sintomático de tos, disnea y dolor torácico (que suele suponer una carga elevada para los pacientes con cáncer de pulmón avanzado), la mediana del tiempo transcurrido hasta el empeoramiento de los síntomas fue prácticamente la misma para ambos agentes. Sin embargo, por término medio, los pacientes comprobaron que sus síntomas iniciales mejoraron durante más tiempo cuando recibieron alectinib en lugar de crizotinib (lo que concuerda con los datos beneficiosos de la SLP con alectinib). La tos, por ejemplo, mejoró clínicamente de forma significativa durante una media de 96 semanas (frente a 84 semanas en el grupo de comparación), el dolor torácico durante 96 frente a 80 semanas, el dolor en otras partes o la fatiga durante 96 frente a 68 semanas en cada caso.
La calidad de vida mejoró de forma clínicamente significativa en ambos grupos, pero durante un periodo más largo con alectinib, 88 semanas frente a 68 semanas. Se produjo un empeoramiento significativo en términos de síntomas asociados al tratamiento como náuseas, vómitos, diarrea, pérdida de apetito, disfagia, neuropatía periférica, etc. en menos pacientes con alectinib que en pacientes con crizotinib. En general, los datos documentados por los propios pacientes fueron coherentes con los datos de seguridad publicados anteriormente y confirman la mejor tolerancia con alectinib. También son bien compatibles con los datos de eficacia: ambos brazos habían mostrado tasas de respuesta comparables, aunque con una mayor duración de la respuesta con alectinib. Del mismo modo, la calidad de vida y los síntomas del cáncer de pulmón mejoraron en ambos brazos, pero las mejoras duraron más con alectinib.
Los pacientes con CPNM ALK-positivo tienen un riesgo especialmente alto de desarrollar metástasis cerebrales múltiples, como ya se ha mencionado. Las opciones de radiación son limitadas para esta angustiosa sintomatología, y las funciones cognitivas también pueden verse afectadas. El alectinib se asocia a un alto nivel de protección contra las metástasis cerebrales, reduce la probabilidad de que una metástasis cerebral existente progrese. Actualmente se están investigando los mecanismos que lo explican [4]. Si en el subanálisis de los datos de los pacientes presentado en el ELCC sólo se tuvieron en cuenta los pacientes con metástasis en el SNC al inicio del estudio, el alectinib también fue superior: Las ventajas con respecto a la progresión resp. la fuerte actividad del SNC con la sustancia activa se reflejaron consecuentemente en la vida diaria de los pacientes. Por un lado, la calidad de vida disminuyó con menos frecuencia; por otro, aproximadamente la mitad de las personas afectadas declararon un deterioro cognitivo (17,9% frente a 34,6% en la semana 32).
Por tanto, hay mucho que decir a favor de un nuevo estándar de atención en el tratamiento de primera línea de los pacientes con CPNM ALK-positivo en estadios avanzados. Para este último grupo, Alecensa® también está aprobado actualmente en Suiza, pero según la Limitatio sólo después de la progresión con crizotinib o en caso de intolerancia al crizotinib y tras la aprobación de los costes por parte de la aseguradora sanitaria previa consulta con el médico responsable.
El hecho de que los datos de los pacientes se recojan y evalúen de forma sistemática en un gran ensayo de fase III es de vital importancia. La calidad de vida y la carga de la enfermedad son posiblemente incluso más importantes en la situación paliativa que la supervivencia prolongada per se (y “a cualquier precio”). Por lo tanto, las sustancias activas que no sólo prolongan el tiempo de vida restante, sino que también hacen que merezca más la pena vivir, son muy bienvenidas.
Fuente: ELCC 2018 (Congreso Europeo de Cáncer de Pulmón), 11-14 de abril de 2018, Ginebra
Literatura:
- Rittmeyer A, et al: Atezolizumab frente a docetaxel en pacientes con cáncer de pulmón no microcítico previamente tratado (OAK): ensayo controlado aleatorizado multicéntrico, abierto, de fase 3. Lancet 2017 Ene 21; 389(10066): 255-265.
- Vokes EE, et al: Nivolumab frente a docetaxel en cáncer de pulmón no microcítico avanzado previamente tratado (CheckMate 017 y CheckMate 057): actualización a 3 años y resultados en pacientes con metástasis hepáticas. Ann Oncol 2018 Feb 2. DOI: 10.1093/annonc/mdy041 [Epub ahead of print].
- Peters S, et al: Alectinib frente a crizotinib en el cáncer de pulmón no microcítico ALK-positivo no tratado. N Engl J Med 2017 Ago 31; 377(9): 829-838.
- Kodama T, et al: Actividad antitumoral del inhibidor selectivo de ALK alectinib en modelos de metástasis intracraneales. Cancer Chemother Pharmacol 2014 Nov; 74(5): 1023-1028.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2018; 6(3) – publicado el 8.6.18 (antes de impresión).