Los trastornos respiratorios del sueño son actualmente un factor de riesgo cardiaco reconocido. Puede desencadenar no sólo enfermedades circulatorias como la hipertensión y la insuficiencia cardiaca, sino también la fibrilación auricular. Como consecuencia, a menudo pasa desapercibida y pone en peligro insidiosamente el pronóstico de los pacientes.
En los últimos años se ha demostrado que la apnea obstructiva del sueño (AOS) es una afección frecuente en adultos. Se caracteriza por apneas repetidas e hipoxia causada por el colapso de las vías respiratorias superiores durante el sueño a pesar del esfuerzo respiratorio del diafragma. Cinco o más apneas por hora de sueño se consideran generalmente anormales, los pacientes gravemente afectados tienen varios cientos de apneas por noche. La mayoría de las apneas e hipopneas terminan con un despertar temporal del sueño seguido de una hiperventilación.
Hipertensión arterial y apnea del sueño
La presión arterial nocturna está elevada en los pacientes con AOS, y cada vez hay más pruebas de que el AOS es también un factor de riesgo independiente de hipertensión arterial durante el día. Aunque los mecanismos exactos aún no están claros, se cree que la elevación persistente del tono simpático causada por la hipoxia repetitiva crónica y la excitación son los mecanismos clave de las elevaciones de la presión arterial a corto y largo plazo en la AOS.
La presión positiva nasal continua en las vías respiratorias (nCPAP) se ha convertido en el tratamiento estándar para la AOS y se ha demostrado que reduce los síntomas y mejora la calidad de vida de los pacientes con AOS. Sin embargo, los ensayos controlados no mostraron ningún efecto o sólo una pequeña reducción de la presión arterial de 1,4 ó 2,5 mm Hg. En general, se ha cuestionado la eficacia de este tratamiento sobre las secuelas cardiovasculares en los pacientes con AOS, explica el Priv.-Doz. Dr. Jan Börgel, St. Barbara Clinic Heessen Medicina Interna Hamm, Alemania [1].
Efecto antihipertensivo de la terapia CPAP
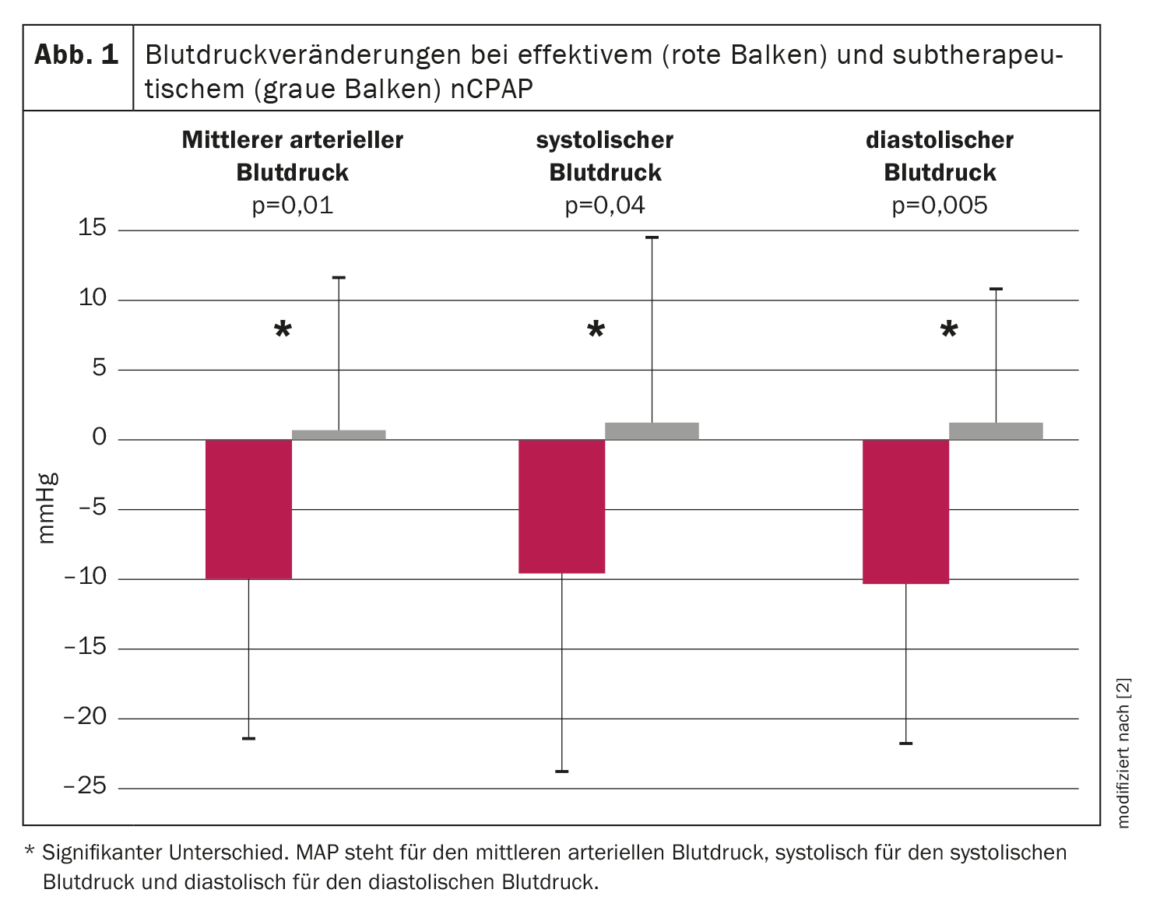
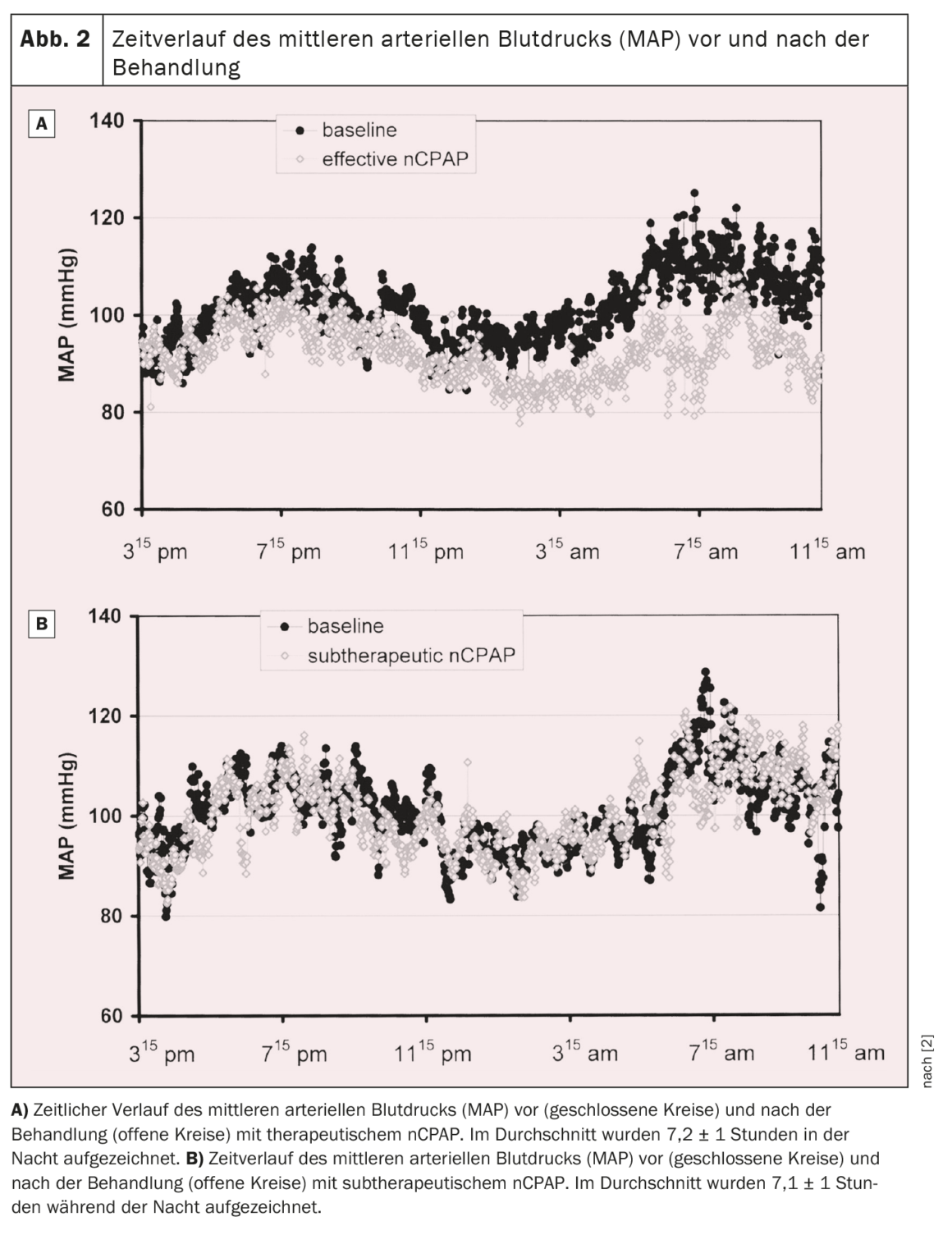
Por ello, se realizó un ensayo prospectivo aleatorizado para investigar el efecto de la nCPAP sobre la presión arterial en pacientes con SAOS. Un total de 60 pacientes consecutivos con SAOS de moderada a grave fueron asignados aleatoriamente a un tratamiento con nCPAP eficaz o subterapéutico durante una media de nueve semanas. Se realizaron polisomnografías nocturnas y registros no invasivos continuos de la presión arterial durante 19 horas antes y durante el tratamiento. Las apneas y las hipopneas se redujeron en ≈95% y 50% en los grupos terapéutico y subterapéutico, respectivamente. La presión arterial media disminuyó 9,9 ± 11,4 mm Hg en el grupo de nCPAP terapéutica y aumentó 0,6 ± 10,8 mm Hg en el grupo de nCPAP subterapéutica durante el periodo de registro de 19,1 ± 1,3 horas (p=0,01, interacción ANOVA tiempo por grupo). Tanto la presión arterial diastólica como la sistólica también disminuyeron significativamente bajo la nCPAP terapéutica en 10,3 ± 11,4 mmHg y 9,5 ± 15,0 mmHg, respectivamente (p<0,005 o p=0,04, interacción ANOVA tiempo por grupo) en comparación con la nCPAP subterapéutica (fig. 1) . La disminución de la presión arterial media bajo nCPAP eficaz se observó tanto durante el día (-10,0 ± 12,1 mmHg) como por la noche (-10,3 ± 15,3 mmHg). La evolución temporal de la presión arterial media antes y durante el tratamiento para ambos grupos se muestra en la figura 2 [2]. En el grupo con tratamiento eficaz, la presión arterial media disminuyó durante todo el periodo de registro, produciéndose el mayor descenso por la noche y por la mañana hasta alrededor del mediodía. Por la tarde y por la noche, el descenso de la tensión arterial seguía presente, pero menos pronunciado que por la noche y en la primera mitad del día [2].
Un metaanálisis de ensayos controlados aleatorios (ECA) siguió cuantificando el tamaño del efecto de la reducción de la presión arterial con la terapia CPAP en comparación con otros tratamientos pasivos (CPAP simulada, comprimidos de placebo, medidas conservadoras) o activos (deglución, medicación antihipertensiva). De 1.599 artículos, se incluyeron 31 ECA que comparaban la CPAP con el tratamiento pasivo o activo. En el análisis de efectos aleatorios comparado con el tratamiento pasivo (29 ECA, 1820 sujetos), se encontró una diferencia neta media ± SEM en la presión arterial sistólica de 2,6 ± 0,6 mmHg y en la presión arterial diastólica de 2,0 ± 0,4 mmHg, favoreciendo el tratamiento con CPAP (p<0,001). En los estudios con monitorización ambulatoria de la presión arterial durante 24 horas que presentaron datos sobre los periodos diurno y nocturno, la diferencia media en la presión arterial sistólica y diastólica fue de 2,2 ± 0,7 y 1,9 ± 0,6 mmHg, respectivamente, durante el día y de 3,8 ± 0,8 y 1,8 ± 0,6 mmHg, respectivamente, durante la noche. En el análisis de regresión, un mayor índice de apnea/hipopnea al inicio del estudio se asoció con un mayor descenso neto medio de la presión arterial sistólica (β ± SE, 0,08 ± 0,04). Los resultados mostraron que la terapia con CPAP reduce significativamente la presión arterial en pacientes con SAOS, pero con un tamaño del efecto pequeño. Los pacientes con episodios frecuentes de apnea pueden ser los que más se beneficien de la terapia [3].
Otro estudio analizó el efecto de la CPAP sobre la presión arterial (PA) en pacientes con SAOS e hipertensión resistente. Se incluyeron los ECA que investigaron el efecto de la CPAP sobre la presión arterial en pacientes con SAOS e hipertensión resistente y que estaban indexados en MEDLINE, Embase y la Cochrane Library desde su inicio hasta el 20 de marzo de 2015. Se identificaron un total de cinco ECA que cumplían los criterios de inclusión. Los cambios agrupados tras el tratamiento con CPAP para la presión arterial sistólica y diastólica (PAD) ambulatoria de 24 horas fueron de -4,78 mmHg (intervalo de confianza del 95% [CI], -7,95 a -1,61) y -2,95 mmHg (IC del 95%, -5,37 a -0,53) a favor del grupo de CPAP. La CPAP también se asoció a una reducción de la PAD nocturna (diferencia media, -1,53 mmHg; IC del 95%, -3,07-0). Estos resultados sugieren una reducción favorable de la presión arterial con el tratamiento con CPAP en pacientes con SAOS e hipertensión resistente [4].
El estrés hipóxico predice la mortalidad relacionada con la ECV
Hasta la fecha, sigue siendo controvertido el impacto de la AOS en los episodios mortales de ECV, ya que las asociaciones entre la exposición y el resultado han sido inconsistentes. Pruebas recientes sugieren que no existe asociación entre el tratamiento con presión positiva en las vías respiratorias y la prevención secundaria de la ECV.
Hasta la fecha, la medicina del sueño se ha basado en la cuantificación de la frecuencia de las apneas e hipopneas observadas durante el sueño (índice apnea-hipopnea, IAH) para diagnosticar el SAOS y determinar su gravedad. Basándose en estas métricas, se descubrió que la AOS predecía modestamente la mortalidad, pero los resultados se limitaron en gran medida a los hombres más jóvenes y de mediana edad. Se ha cuestionado si el IAH capta los aspectos más importantes de la AOS que afectan negativamente al sistema cardiovascular. La apnea obstructiva del sueño es una afección en la que la obstrucción repetida de las vías respiratorias dificulta la ventilación y provoca una alteración de los niveles de gases en sangre. Por lo tanto, el IAH, que es un simple recuento de episodios obstructivos por hora de sueño sin tener en cuenta la duración y la profundidad de la alteración ventilatoria ni los cambios en los gases sanguíneos, no es una descripción completa de las alteraciones fisiológicas. Varios estudios observacionales han demostrado que las medidas de la hipoxemia nocturna, como el porcentaje de tiempo durante el sueño con una saturación de oxígeno inferior al 90% (TST90), son mejores predictores de la ECV y de la mortalidad por todas las causas que el IAH. Sin embargo, la TST90 y otras medidas similares caracterizan no sólo la hipoxemia intermitente secundaria a eventos obstructivos, sino también la hipoxemia persistente, por ejemplo debida a la enfermedad pulmonar obstructiva crónica (EPOC) o a la hipoventilación en la obesidad, que no está relacionada con la obstrucción de las vías respiratorias superiores ni con la AOS.
Por ello, un estudio trató de desarrollar una medida de la gravedad de la AOS que cuantificara la hipoxemia relacionada con la AOS, cuya hipótesis era predecir de forma significativa la mortalidad relacionada con la ECV tras el ajuste por los índices de polisomnografía (PSG) medidos de forma rutinaria. En consecuencia, se desarrolló una medida para captar la frecuencia, duración y profundidad de la contribución de los eventos respiratorios a la hipoxemia arterial, concretamente el “área bajo la curva” de la desaturación de oxígeno asociada a las apneas e hipopneas individuales: la “carga hipóxica” específica de la AOS.
Las muestras procedían de dos estudios de cohortes: el Resultados de los trastornos del sueño en hombres mayores (MrOS), en la que participaron 2743 hombres de 76,3 ± 5,5 años, y la Estudio sobre la salud del corazón durante el sueño (SHHS), que incluyó a 5111 adultos de mediana edad y mayores (52,8% mujeres) de 63,7 ± 10,9 años. Los resultados incluyeron la mortalidad por todas las causas y la mortalidad relacionada con enfermedades cardiovasculares (ECV). El estrés por hipoxia se determinó midiendo el área bajo la curva de saturación final en comparación con la situación de referencia antes del evento. Se utilizaron modelos de Cox para calcular los cocientes de riesgo ajustados para el estrés hipóxico. A diferencia del IAH, el “estrés hipóxico” predijo fuertemente la mortalidad por ECV y la mortalidad por todas las causas (sólo MrOS). Los individuos del estudio MrOS con una exposición a la hipoxia en los dos quintiles más altos tenían unos cocientes de riesgo de 1,81 [intervalo de confianza (IC) del 95%: 1,25-2,62] y 2,73 (IC del 95%: 1,71-4,36), respectivamente. Del mismo modo, el grupo del SHHS con “estrés hipóxico” en el quintil más alto tenía un cociente de riesgos de 1,96 (IC 95%: 1,11-3,43). La “carga hipóxica”, una señal fácilmente derivable del estudio del sueño nocturno, predice así la mortalidad por ECV en diferentes grupos de población. Los resultados sugieren que no sólo la frecuencia, sino también la profundidad y la duración de la obstrucción de las vías respiratorias superiores relacionada con el sueño son importantes rasgos característicos de la enfermedad [5].
El fenotipo excesivamente somnoliento se identificó como predictor de eventos cardiovasculares de nueva aparición y recurrentes, aunque no de mortalidad cardiovascular. No obstante, incluso en los ensayos clínicos que se centraron en participantes con síntomas mínimos o sin somnolencia, se hallaron beneficios limitados del tratamiento de la AOS sobre la presión arterial y los resultados cardiovasculares [6].
Reducción de la presión sanguínea – Situación de la AOS/hipertensión no tratada
Un análisis post-hoc investigó el efecto de la CPAP sobre la presión arterial, teniendo en cuenta el patrón circadiano de presión arterial en pacientes hipertensos no tratados. Los sujetos se clasificaron según la proporción de inmersión (dipper/no dipper). Se incluyó en el análisis a un total de 272 pacientes hipertensos (113 dippers y 159 no dippers). Las variables clínicas y polisomnográficas basales fueron similares en ambos grupos. El tratamiento con CPAP de los pacientes no dipper se asoció a una reducción de las variables de presión arterial ambulatoria de 24 horas y de las mediciones de presión arterial ambulatoria nocturna. Sin embargo, se encontró un efecto no significativo en el grupo de los cazoletas. Los efectos diferenciales de la CPAP entre los grupos fueron de -2,99 mmHg (IC del 95%: -5,92 a -0,06 mmHg) para la presión arterial ambulatoria media de 24 horas y de -5,35 mmHg (IC del 95%: -9,01 a -1,69 mmHg) para la presión arterial ambulatoria nocturna media. Los resultados muestran un efecto diferencial del tratamiento con CPAP sobre la presión arterial en pacientes hipertensos en función del patrón circadiano. De acuerdo con esto, sólo los pacientes no dipper se beneficiaron del tratamiento con CPAP en términos de reducción de la presión arterial [7].
Fibrilación auricular y apnea del sueño
La AOS no sólo provoca hipoxemia, hipercapnia, disfunción autonómica, agitación y cambios negativos significativos de la presión intratorácica, explica el Prof. Dr. Dr. Anil-Martin Sinha, Clínica de Cardiología, Nefrología, Neumología y Medicina Intensiva Interna Sana Klinikum Hof GmbH, Hof, Alemania [8], la fisiopatología de la AOS también provoca inflamación, disfunción endotelial, coagulación desequilibrada, cambios hemodinámicos, remodelación eléctrica/estructural de las aurículas/ventrículos y desregulación autonómica. Estos factores están asociados al desarrollo y mantenimiento de la fibrilación auricular. Así pues, la fisiopatología de la AOS es multifactorial, y en el desarrollo de la FA intervienen muchos mecanismos complejos no resueltos, con implicaciones tanto agudas como a largo plazo para los sustratos arritmogénicos [9].
Expresión de GJA1 y remodelación de la aurícula izquierda
Los estudios han demostrado que los genes que controlan la inflamación, las uniones gap y la fibrosis auricular están relacionados con el mecanismo fisiopatológico de la fibrilación auricular. La proteína conexina-43 está codificada en el ser humano por el gen GJA1 del cromosoma 6 y se expresa en los cardiomiocitos auriculares y ventriculares, las células musculares lisas vasculares, las células endoteliales, los monocitos y los macrófagos. La continuidad eléctrica del miocardio se mantiene gracias a las conexinas situadas en las uniones gap que mantienen el acoplamiento intercelular de baja resistencia. Las diferencias en la expresión de la conexina-43 provocan una conducción discontinua incoherente y arritmias cardiacas. Los exosomas, vesículas unidas a la membrana de 40-100 nm de diámetro, son liberados por muchos tipos de células, como las sanguíneas, las endoteliales, las inmunitarias, las plaquetas y las musculares lisas, y están presentes en casi todos los fluidos biológicos. Los ARN de los exosomas pueden ser captados por células vecinas o distantes cuando los exosomas circulan y, posteriormente, modular las células receptoras. El descubrimiento de su función en el intercambio genético entre células ha hecho que los exosomas reciban cada vez más atención.
Se realizó un estudio para investigar los factores predictivos de la aparición de FA en pacientes con SAOS y los efectos de los exosomas de pacientes con SAOS con y sin FA en la expresión de GJA1 y otros genes inflamatorios y de fibrosis implicados en la fisiopatología de la FA en células HL-1 para aclarar su asociación con la aparición de FA. El estudio aportó varias conclusiones importantes. En primer lugar, los pacientes con SAOS y FA tenían más diabetes mellitus, menor eficiencia del sueño, menor FEVI y una aurícula izquierda (AI) más grande que los pacientes con SAOS sin FA. En segundo lugar, el tamaño de la aurícula izquierda fue el factor predictivo más significativo de la aparición de FA en los pacientes con SAOS, con un valor de corte de 38,5 mm. En tercer lugar, la expresión génica de ARNm de GJA1 fue menor y la de TNF-α mayor en las células HL-1 incubadas con exosomas de pacientes con SAOS con FA que en las incubadas con exosomas de pacientes con SAOS sin FA. Tras controlar la edad y el sexo, la expresión génica de GJA1 siguió siendo inferior en las células HL-1 incubadas con exosomas de pacientes con SAOS y AF. Por último, la expresión del gen GJA1 se correlacionó negativamente con el IAH y el índice de desaturación de oxígeno en pacientes con SAOS y FA, especialmente durante la fase no REM [10].
Prevalencia de la apnea del sueño no diagnosticada en la fibrilación auricular
El objetivo de otro estudio era determinar la proporción de pacientes con fibrilación auricular (FA) que también tenían apnea del sueño no diagnosticada e investigar el impacto de este diagnóstico en la adherencia al tratamiento de la apnea del sueño. El estudio prospectivo incluyó a 188 pacientes consecutivos con fibrilación auricular sin diagnóstico previo de apnea del sueño a los que se programó una ablación de fibrilación auricular. La prueba domiciliaria de apnea del sueño fue positiva en 155 de 188 pacientes (82,4%); de estos 155, 127 (82%) tenían un componente predominantemente obstructivo y 28 (18%) tenían apnea del sueño mixta con un componente central del 15,2 ± 7,4%. La gravedad de la apnea del sueño fue leve en el 43,8%, moderada en el 32,9% y grave en el 23,2%. La sensibilidad y especificidad del cuestionario STOP-BANG fueron del 81,2% y el 42,4% respectivamente. En un análisis multivariante, el STOP-BANG no fue predictivo de la apnea del sueño (odds ratio: 0,54; intervalo de confianza del 95%: 0,17-1,76; p=0,31). La terapia con ventilador de presión positiva continua en las vías respiratorias se inició en 73 de 85 pacientes (85,9%) con apnea del sueño moderada o grave, y 68 de los 73 pacientes (93,1%) permanecieron libres de síntomas tras un seguimiento medio de 21 ± 6,2 meses. En consecuencia, la apnea del sueño es extremadamente frecuente en los pacientes con FA remitidos para ablación, una gran proporción de los cuales no están diagnosticados porque el poder predictivo de los síntomas de la apnea del sueño en este grupo de pacientes con FA es limitado. El cribado de la apnea del sueño dio como resultado una alta tasa de pacientes adheridos a la presión positiva continua en las vías respiratorias a largo plazo [11].
Efectos de la CPAP en el sustrato de la fibrilación auricular
El estudio SLEEP-AF investigó cómo afecta el tratamiento del SAOS al sustrato auricular en la FA. Para ello, se reclutó a 24 pacientes consecutivos con AOS al menos moderada (IAH ≥15) remitidos para el tratamiento de la FA. Los participantes fueron aleatorizados 1:1 para recibir presión positiva continua en las vías respiratorias (CPAP) o ninguna terapia (n=12 con CPAP; n=12 sin CPAP). Todos los participantes se sometieron a un examen electrofisiológico invasivo (cartografía de alta densidad de la aurícula derecha) al inicio del estudio y al cabo de al menos seis meses. Las variables de resultado fueron el voltaje auricular (mV), la velocidad de conducción (m/s), el área auricular <0,5 mV (%), el porcentaje de puntos complejos (%) y el periodo refractario auricular efectivo (ms). Las características clínicas y los parámetros electrofisiológicos fueron similares en los dos grupos al inicio del estudio. La adherencia al tratamiento con CPAP fue alta (uso del dispositivo: 79% ± 19%; uso medio/día: 268 ± 91 min) y dio lugar a una reducción significativa del IAH (reducción media: 31 ± 23 eventos/h). No hubo diferencias entre los grupos en la presión arterial y el índice de masa corporal a lo largo del tiempo. En el seguimiento, el grupo de CPAP tenía una velocidad de conducción más alta (0,86 ± 0,16 m/s frente a 0,69 ± 0,12 m/s; p (tiempo × grupo) = 0,034), voltajes significativamente más altos (2,30 ± 0,57 mV frente a 1,94 ± 0,72 mV; p<0,05) y una menor proporción de puntos complejos (8,8% ± 3,61% frente a 11,93% ± 4,94%; p=0,011) en comparación con el grupo de control. La terapia CPAP también tendió a dar lugar a una menor proporción de superficie auricular <0,5 mV (1,04% ± 1,41% frente a 4,80% ± 5,12%; p=0,065). Los resultados muestran que la terapia con CPAP conduce a la reversión del remodelado auricular en la FA y proporciona pruebas mecanicistas a favor del tratamiento de la AOS en la FA [12].
Relación entre la apnea del sueño detectada por el DCI y la fibrilación auricular
El índice de alteración respiratoria (IDR) calculado por el algoritmo de un desfibrilador cardioversor implantable (DAI) permite detectar con precisión la apnea del sueño (SA) grave. Un estudio reciente ha probado ahora si el IDR puede predecir también la carga de fibrilación auricular. Se tuvo en cuenta el valor medio semanal de la IDR calculado durante todo el periodo de seguimiento y durante un periodo de una semana antes del estudio del sueño. Se diagnosticó fibrilación auricular grave (IDR ≥30 episodios/h) en 92 (56%) pacientes en el momento del estudio del sueño. Durante el seguimiento, se documentó una carga de FA ≥5 minutos/día en 70 (43%), ≥6 horas/día en 48 (29%) y ≥23 horas/día en 33 (20%) pacientes. El RDI ≥30 episodios/h registrado con el dispositivo en el momento de la poligrafía y el índice de apnea-hipopnea ≥30 episodios/h medido con la poligrafía no se asociaron con la aparición de los criterios de valoración mediante un modelo de regresión de Cox. Sin embargo, utilizando un modelo dependiente del tiempo, una IDR media semanal medida de forma continua ≥30 episodios/h se asoció de forma independiente con una exposición a la FA ≥5 min/día (hazard ratio [HR]: 2,13, intervalo de confianza del 95 [CI]: 1,24-3,65; p=0,006), ≥6 h/día (CRI: 2,75; IC 95%: 1,37-5,49; p=0,004) y ≥23 h/día (CRI: 2,26; IC 95%: 1,05-4,86; p=0,037). Los resultados muestran que los pacientes con insuficiencia cardiaca con FA grave diagnosticada mediante DAI tienen entre dos y tres veces más probabilidades de sufrir un episodio de FA, en función del umbral de carga diaria de FA [13].
Insuficiencia cardiaca y apnea del sueño
Los trastornos del sueño son frecuentes en pacientes con insuficiencia cardiaca con fracción de eyección reducida (IC-FEr), con una tasa de prevalencia comunicada del 50-75%. La AOS, en particular, es más frecuente en pacientes con insuficiencia cardiaca que en la población general. La apnea central del sueño, que puede manifestarse como respiración de Cheyne-Stokes, se encuentra en el 25-40% de los pacientes con insuficiencia cardiaca con fracción de eyección reducida. La prevalencia de la apnea central del sueño aumenta de forma paralela al incremento de la gravedad de la insuficiencia cardiaca y al empeoramiento de la disfunción cardiaca, explica el Prof. Dr. Michael Arzt, Clínica del Hospital Universitario de Ratisbona y Policlínica de Medicina Interna II, Cardiología de Ratisbona, Alemania [14]. Existen varios mecanismos por los que la apnea central del sueño puede afectar negativamente a la función cardiaca, como el aumento de la actividad del sistema nervioso simpático y la hipoxemia intermitente. Además, la apnea central del sueño es un marcador de riesgo independiente de mal pronóstico y muerte en pacientes con insuficiencia cardiaca.
En el estudio canadiense depresión positiva continua en las vías respiratorias para pacientes con apnea central del sueñoe insuficiencia cardiaca(CANPAP), los pacientes con insuficiencia cardiaca y apnea central del sueño fueron asignados aleatoriamente a recibir o no CPAP. El estudio se interrumpió antes de tiempo y no mostró ningún efecto positivo de la CPAP sobre la morbilidad o la mortalidad. Un análisis post hoc sugirió que la mortalidad podría ser menor si el índice de apnea-hipopnea (IAH; el número de episodios de apnea o hipopnea por hora de sueño) se redujera a menos de 15 episodios por hora [15].
Efectos de la servoventilación adaptativa
Ambos tipos de trastornos respiratorios del sueño, la apnea obstructiva y la apnea central del sueño (AOS y AAC, respectivamente), son frecuentes en pacientes con insuficiencia cardiaca y fracción de eyección reducida (ICrEF). Hasta ahora, no estaba claro si el tratamiento de los trastornos respiratorios del sueño mediante servoventilación adaptativa (ASV) reduce la morbilidad y la mortalidad en estos pacientes. La servoventilación adaptativa es una terapia de ventilación no invasiva que alivia eficazmente la apnea central del sueño proporcionando un soporte de presión inspiratoria servocontrolada además de presión positiva espiratoria en las vías respiratorias.
El estudio SERVE-HF (Tratamiento de los trastornos respiratorios del sueño con apnea central del sueño predominante mediante servoventilación adaptativa en pacientes con insuficiencia cardiaca) investigó los efectos de la ASV (AutoSet CS, ResMed) sobre la supervivencia y los resultados cardiovasculares en pacientes con insuficiencia cardiaca con fracción de eyección reducida y apnea del sueño predominantemente central que fueron tratados además del tratamiento médico requerido por las directrices. Un total de 1.325 pacientes con una fracción de eyección ventricular izquierda del 45% o inferior, un índice de apnea-hipopnea (IAH) de 15 o más eventos (eventos de apnea o hipopnea) por hora y un predominio de eventos centrales fueron asignados aleatoriamente a un tratamiento médico basado en las directrices con ASV o a un tratamiento médico basado en las directrices únicamente (control). El criterio de valoración primario en el análisis del tiempo transcurrido hasta el acontecimiento fue el primer acontecimiento mortal por cualquier causa, una intervención cardiovascular que salvara la vida (trasplante de corazón, implantación de un dispositivo de asistencia cardiaca, reanimación tras una parada cardiaca súbita o una descarga adecuada que salvara la vida) o un ingreso hospitalario no planificado debido a un empeoramiento de la insuficiencia cardiaca.
En el grupo con ASV, el IAH medio después de 12 meses fue de 6,6 eventos por hora. La incidencia del criterio de valoración primario no fue significativamente diferente entre el grupo ventilado con ASV y el grupo de control (54,1% y 50,8%, respectivamente; cociente de riesgos, 1,13; intervalo de confianza del 95% [CI], 0,97-1,31; p=0,10). La mortalidad por cualquier causa y la mortalidad cardiovascular fueron significativamente mayores en el grupo de ASV que en el grupo de control (cociente de riesgos para la muerte por cualquier causa, 1,28; IC 95%, 1,06-,55; p=0,01; y cociente de riesgos para la muerte cardiovascular, 1,34; IC 95%, 1,09-1,65; p=0,006). Así pues, la ASV no tuvo un efecto significativo sobre el criterio de valoración primario en pacientes con insuficiencia cardiaca con fracción de eyección reducida y apnea del sueño predominantemente central, pero tanto la mortalidad por todas las causas como la mortalidad cardiovascular aumentaron con esta terapia [16]. Se han propuesto varias explicaciones de cómo la ASV puede desencadenar arritmias ventriculares, como los cambios rápidos en los gases sanguíneos, los niveles de pH y potasio, y los efectos sobre el retorno venoso y la tensión transmural de la pared de la presión positiva aplicada en las vías respiratorias.
Por lo tanto, un análisis auxiliar del subestudio principal SERVE-HF evaluó el impacto de la ASV en la carga de arritmias ventriculares nocturnas en pacientes tratados con ASV con ICrEF y apnea central del sueño. Desde el inicio hasta el seguimiento a los 3 y 12 meses 12 meses de seguimiento, el número de complejos ventriculares prematuros (control: mediana 19,7, 19,0 y 19,0; ASV: 29,1, 29,0 y 26,0 eventos/h; p=0,800) y la aparición de ≥1 taquicardia ventricular no continua/noche (control: 18, 25 y 18% de los pacientes; ASV: 24, 16 y 24% de los pacientes; p=0,095) fueron similares en los grupos de control y ASV. La adición de ASV al tratamiento médico requerido por las directrices no tuvo ningún efecto significativo sobre la ectopia ventricular nocturna o las taquiarritmias durante un periodo de 12 meses en pacientes vivos con ICrEF y apnea central del sueño. Los resultados no apoyan la hipótesis de que la ASV pueda provocar una muerte súbita cardiaca al desencadenar taquiarritmias ventriculares [17].
Por el contrario, el ensayo ADVENT-HF, un estudio multicéntrico, multinacional, aleatorizado, abierto, de grupos paralelos con evaluación ciega de los criterios de valoración del tratamiento médico estándar para la IC-FEr sola frente a la administración adicional de ASV en pacientes con IC-FEr y trastornos respiratorios del sueño, no logró demostrar un efecto positivo o negativo del tratamiento con ASV sobre el pronóstico en pacientes con IC-FEr (FEVI <45%) y apnea obstructiva o central del sueño. [18].
Los trastornos respiratorios relacionados con el sueño no sólo se limitan a los pacientes con IC-FEr
Los datos actualmente disponibles sobre los trastornos respiratorios del sueño en la insuficiencia cardiaca se centran principalmente en la IC-FEr, mientras que los datos sobre los trastornos respiratorios del sueño y la insuficiencia cardiaca con fracción de eyección preservada (IC-FEp) son limitados. Sin embargo, los trastornos respiratorios del sueño de moderados a graves también parecen ser una comorbilidad común en la IC-FEM, afectando al 37-58% de los pacientes. Por ejemplo, el tratamiento del SAOS en pacientes con IC-FEM ofrece la oportunidad de mejorar la calidad de vida y el rendimiento físico, y tiene el potencial de prevenir la progresión de la IC-FEM al reducir la presión arterial y la carga de trabajo cardiaca y prevenir el remodelado cardiaco. Debido a la diferente fisiopatología, impacto e implicaciones pronósticas y modalidades de tratamiento, es por tanto crucial distinguir entre pacientes con IC con AOS o ASI predominante.
El objetivo del análisis del registro SleepHF-XT era, por tanto, investigar la prevalencia y los factores predictivos específicos de cada sexo de los trastornos respiratorios relacionados con el sueño (tanto AOS como AAC) en pacientes con IC-FEp en comparación con aquellos con fracción de eyección ligeramente reducida (IC-FMr) o IC-FEr. De los 3289 pacientes incluidos, 2032 tenían ICFpEF, 559 ICFmrEF y 698 ICFrEF. La prevalencia de los trastornos respiratorios del sueño fue elevada en la IC-FEp, pero significativamente inferior a la de la IC-FEM o la IC-FEr (36% frente a 41 y 48%, respectivamente). Las tasas de trastornos respiratorios del sueño en hombres y mujeres fueron del 41 y el 28% para la HFpEF, del 44 y el 30% para la HFmrEF, y del 50 y el 40% para la HFrEF. La proporción de hombres y mujeres con trastornos respiratorios del sueño que presentaban AOS fue significativamente mayor en la IC-FEp que en la IC-FEr. El sexo masculino, la edad avanzada, un mayor índice de masa corporal y la clase funcional III/IV de la Asociación Cardiaca de Nueva York fueron factores predictivos significativos de los trastornos respiratorios del sueño de moderados a graves en pacientes con IC-FEp. La prevalencia de los trastornos respiratorios del sueño en la HFpEF fue, por tanto, elevada, pero inferior a la de los pacientes con HFmrEF o HFrEF. Los trastornos respiratorios del sueño de moderados a graves se produjeron con mayor frecuencia en hombres que en mujeres en todo el espectro de la insuficiencia cardiaca. En ambos sexos, la proporción de AOS con IC-FEp fue mayor que la de aquellos con IC-FEr [19].
Las agrupaciones de pacientes pueden apoyar la toma de decisiones clínicas
El estudio FACE, un estudio de cohortes observacional, prospectivo, multicéntrico y europeo, utilizó datos del mundo real para evaluar el efecto de la terapia PAP con ASV sobre la morbilidad y la mortalidad en pacientes con ICFrEF, ICFmrEF o ICFpEF y trastornos respiratorios centrales del sueño o CSA/OSA coexistentes. Los datos a tres meses se presentaron en subgrupos de pacientes definidos mediante un análisis de clases latentes (ACL). La ECV identificó por primera vez seis grupos discretos de pacientes que representan subgrupos clínicamente relevantes relacionados con el tratamiento de la DSB en pacientes con insuficiencia cardiaca con diferente uso de ASV y pronóstico. La tasa a los 3 meses de los criterios de valoración primarios fue significativamente mayor en los pacientes del grupo 1 (predominantemente hombres, FEVI baja, IC grave, ASI; 13,9% frente a 1,5-5% en los otros grupos, p<0,01). Esto puede mejorar el fenotipado de los pacientes en la práctica clínica y permitir la individualización de la terapia.
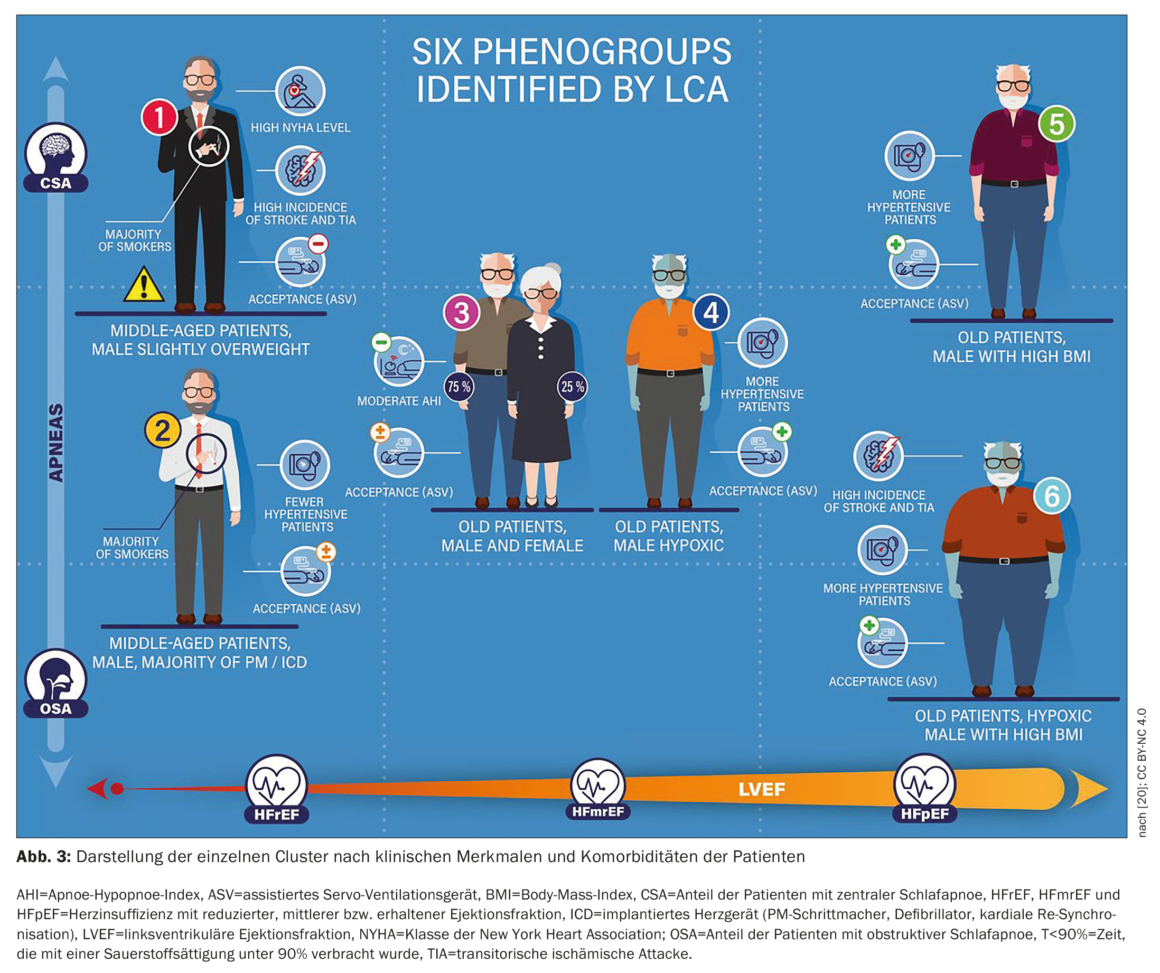
La figura 3 [20] muestra la presentación clínica de cada grupo. Los principales parámetros que diferenciaron los grupos fueron el IAH obstructivo, el IAH central, la FEVI (%), la clase I/II de la NYHA, el T90 y la presencia de HFrEF. Como era de esperar, hubo diferencias significativas en los datos demográficos de los pacientes, las características de la enfermedad de la IC y las características del SDB entre los grupos resultantes directamente de la metodología del ACV. Curiosamente, la adherencia a la ASV y el rechazo de la ASV difirieron significativamente entre los grupos, aunque estas variables no se incluyeron en el modelo de ECV. La tasa a los 3 meses de los criterios de valoración primarios fue significativamente mayor en los pacientes del grupo 1 (predominantemente hombres, FEVI baja, IC grave, ASI; 13,9% frente a 1,5-5% en los otros grupos, p<0,01). Este grupo correspondía a aquellos con un mal pronóstico bajo terapia ASV en la población inscrita en SERVE-HF [20].
Congreso: 89ª Conferencia Anual de la DGK
Literatura:
- Börgel J: Neues vom unheilvollen Duo Nr. 1: Arterielle Hypertonie und Schlafapnoe. 89. Jahrestagung der DGK, 12.04.2023, Sitzung: Kardiovaskuläre Erkrankungen und schlafbezogene Atmungsstörungen im digitalen Zeitalter.
- Becker HF, et al.: Effect of Nasal Continuous Positive Airway Pressure Treatment on Blood Pressure in Patients With Obstructive Sleep Apnea. Circulation 2002; https://doi.org/10.1161/01.CIR.0000042706.47107.7A.
- Fava C, et al.: Effect of CPAP on Blood Pressure in Patients With OSA/Hypopnea: A Systematic Review and Meta-analysis. ScienceDirect 2014; https://doi.org/10.1378/chest.13-1115.
- Liping L, et al.: Continuous Positive Airway Pressure in Patients With Obstructive Sleep Apnea and Resistant Hypertension: A Meta-Analysis of Randomized Controlled Trials. J Clin Hypertens (Greenwich) 2016 Feb; doi: 10.1111/jch.12639.
- Azarbarzin A, et al.: The hypoxic burden of sleep apnoea predicts cardiovascular disease-related mortality: the Osteoporotic Fractures in Men Study and the Sleep Heart Health Study. Eur Heart J. 2019; doi: 10.1093/eurheartj/ehy624.
- Mehra R, Azarbarzin A: Sleep Apnea–Specific Hypoxic Burden and Not the Sleepy Phenotype as a Novel Measure of Cardiovascular and Mortality Risk in a Clinical Cohort. Am J Respir Crit Care Med 2022; doi: 10.1164/rccm.202110-2371ED.
- Sapiña-Beltrán E, et al.: Differential blood pressure response to continuous positive airway pressure treatment according to the circadian pattern in hypertensive patients with obstructive sleep apnoea. European Respiratory Journal 2019;
doi: 10.1183/13993003.00098-2019. - Sinha AM: Neues vom unheilvollen Duo Nr. 2: Vorhofflimmern und Schlafapnoe. 89. Jahrestagung der DGK, 12.04.2023, Sitzung: Kardiovaskuläre Erkrankungen und schlafbezogene Atmungsstörungen im digitalen Zeitalter.
- Iwasaki Y: Mechanism and management of atrial fibrillation in the patients with obstructive sleep apnea. Journal of Arrhythmia 2022;
https://doi.org/10.1002/joa3.12784. - Chen YL, et al.: GJA1 Expression and Left Atrial Remodeling in the Incidence of Atrial Fibrillation in Patients with Obstructive Sleep Apnea Syndrome. Biomedicines 2021; doi: 10.3390/biomedicines9101463.
- Shapira-Daniels A, et al.: Prevalence of Undiagnosed Sleep Apnea in Patients With Atrial Fibrillation and its Impact on Therapy. JACC Clin Electrophysiol 2020; doi: 10.1016/j.jacep.2020.05.030
- Nelliah CJ, et al.: Impact of CPAP on the Atrial Fibrillation Substrate in Obstructive Sleep Apnea: The SLEEP-AF Study. JACC Clin Electrophysiol 2022; doi: 10.1016/j.jacep.2022.04.015.
- Boriani G, et al.: Association between implantable defibrillator-detected sleep apnea and atrial fibrillation: The DASAP-HF study. J Cardiovasc Electrophysiol 2022; doi: 10.1111/jce.15506.
- Arzt M: Neues vom unheilvollen Duo Nr. 3: Herzinsuffizienz und Schlafapnoe. 89. Jahrestagung der DGK, 12.04.2023, Sitzung: Kardiovaskuläre Erkrankungen und schlafbezogene Atmungsstörungen im digitalen Zeitalter.
- Bradley TD, et al.: Continuous positive airway pressure for central sleep apnea and heart failure. N Engl J Med 2005; doi: 10.1056/NEJMoa051001.
- Cowie MR, et al.: Adaptive Servo-Ventilation for Central Sleep Apnea in Systolic Heart Failure. N Engl J Med 2015; doi: 10.1056/NEJMoa1506459.
- Fisser C, et al.: Effects of Adaptive Servo-Ventilation on Nocturnal Ventricular Arrhythmia in Heart Failure Patients With Reduced Ejection Fraction and Central Sleep Apnea-An Analysis From the SERVE-HF Major Substudy. Front Cardiovasc Med 2022; doi: 10.3389/fcvm.2022.896917.
- Lyons OD, et al.: Design of the effect of adaptive servo-ventilation on survival and cardiovascular hospital admissions in patients with heart failure and sleep apnoea: the ADVENT-HF trial. Eur J Heart Fail 2017; doi: 10.1002/ejhf.790; Bradley D, et al.: ESC Congress 2022.
- Arzt M, et al.: Prevalence and predictors of sleep-disordered breathing in chronic heart failure: the SchlaHF-XT registry. ESC Heart Fail 2022;
doi: 10.1002/ehf2.14027. - Tamisier R, et al.: Adaptive servo ventilation for sleep apnoea in heart failure: the FACE study 3-month data. Thorax 2022; doi: 10.1136/thoraxjnl-2021-217205.
CARDIOVASC 2023; 22(2): 42–47