La artritis psoriásica (APs) supone una gran carga para los enfermos y muchos de ellos no responden satisfactoriamente a los tratamientos disponibles hasta la fecha [2]. Ahora los pacientes con APs de moderada a grave pueden beneficiarse de una opción adicional de terapia biológica eficaz y tolerable [1].
Del 1 al 3% de personas que padecen psoriasis en Suiza, aproximadamente una de cada tres también está afectada por la PsA [2, 3]. Las manifestaciones clínicas típicas de la enfermedad sistémica inflamatoria crónica incluyen artritis, entesitis, dactilitis, dolencias axiales y psoriasis cutánea y ungueal [4]. Si la APs progresa sin control, puede provocar la destrucción de la articulación y la consiguiente discapacidad y un mayor riesgo de mortalidad. Las enfermedades concomitantes que aparecen con frecuencia, como las enfermedades cardiovasculares, el síndrome metabólico, la obesidad, la diabetes o los trastornos psiquiátricos, merman aún más la funcionalidad física y la calidad de vida de los afectados [2]. Desde el 17 de marzo de 2022, el risankizumab (Skyrizi®) ofrece una opción terapéutica adicional [1].
Ampliación de las indicaciones del risankizumab [1]
Casi tres años después de su aprobación en la psoriasis en placas de moderada a grave en abril de 2019, el risankizumab (150 mg) puede utilizarse ahora como monoterapia o en combinación con fármacos antirreumáticos modificadores de la enfermedad (FAME) no biológicos para tratar a adultos con APs activa que hayan tenido una respuesta inadecuada o sean intolerantes a uno o más FAME [1, 5]. El inhibidor selectivo de la IL-23 se caracteriza, entre otras cosas, por un intervalo de tratamiento cómodo para el paciente de 3 meses tras 2 inyecciones iniciales en las semanas 0 y 4 [1, 6]. Su eficacia a largo plazo y su perfil de seguridad beneficioso y estable en la psoriasis han quedado demostrados en varios estudios de fase III [6-9]. Los resultados de los estudios de fase III aleatorizados y controlados con placebo KEEPsAKE 1 y 2 [2, 4] muestran que el risankizumab también puede influir positivamente en la evolución de la enfermedad en pacientes con APs activa.
Eficacia probada y buena tolerabilidad en la APs [2, 4]
En KEEPsAKE 1 y 2, un total de 1408 pacientes adultos con APs con respuesta inadecuada o intolerancia a los DMARD sintéticos convencionales (cs) (KEEPsAKE 1) y/o biológicos (b) DMARDs (KEEPsAKE 2) aleatorizados a 24 semanas de tratamiento doble ciego con risankizumab (150 mg) o placebo. En la posterior extensión abierta (OLE), todos los pacientes recibieron risankizumab. Tras 24 semanas, un número significativamente mayor de pacientes alcanzó el criterio de valoración primario de una respuesta del 20% según los criterios del Colegio Americano de Reumatología (ACR 20) con risankizumab que con placebo en ambos estudios(tabla). También se obtuvieron resultados significativamente mejores en el brazo de risankizumab en términos de respuesta ACR 50 y ACR 70 y de mejora de la entesitis, la dactilitis, la fatiga y la funcionalidad física [2, 4]. Según los últimos datos presentados en el Congreso de la EADV de 2021, la eficacia del risankizumab en la OLE siguió aumentando numéricamente. Por ejemplo, la tasa de respuesta ACR 20 en pacientes tratados de forma continuada con risankizumab a las 52 semanas fue del 70,0% en KEEPsAKE 1 y del 58,5% en KEEPsAKE 2, que también incluyó a pacientes con respuesta inadecuada a bDMARD anteriores [10]. En general, el risankizumab se toleró bien y el perfil de seguridad fue comparable al observado en pacientes con psoriasis [2, 4].
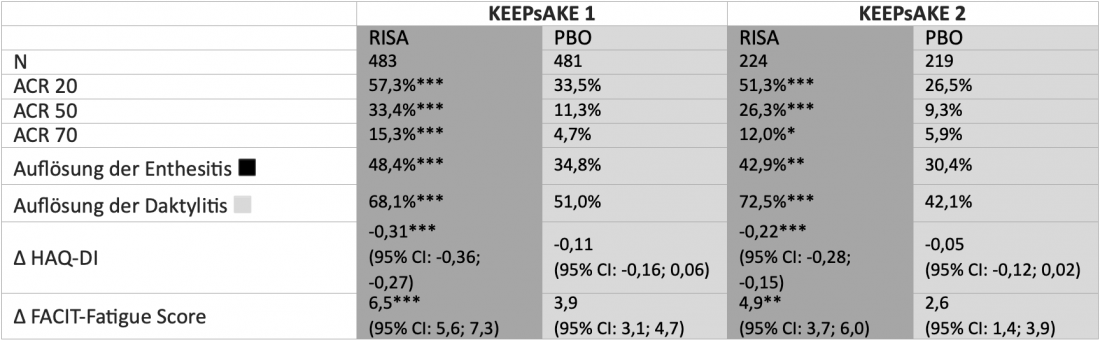
Mesa: Respuesta de los pacientes con artritis psoriásica activa que tomaron RISA tras 24 semanas en los ensayos aleatorizados de fase III KEEPsAKE 1 y 2, controlados con OBP. Los pacientes de KEEPsAKE 1 habían respondido previamente de forma inadecuada o no habían tolerado ≥ 1 csDMARDs. Los pacientes de KEEPsAKE 2 habían respondido previamente de forma inadecuada o no habían tolerado ≤ 2 bDMARDs y/o ≥ 1 csDMARD. Imputación de no respondedores (NRI) con imputaciones múltiples si faltan datos debido a COVID-19, o NRI si no faltan datos debido a COVID-19. *p<0,05; **p<0,01; ***p< 0,001.
◾ Definido como índice de entesitis de Leeds (LEI)=0 en pacientes con LEI>0 al inicio del estudio . ◽ Definido como Índice de Dactilitis de Leeds (LDI)=0 en pacientes con LDI>0 al inicio del estudio. RISA: 150 mg de risankizumab en las semanas 0, 4 y 16; PBO: placebo; ACR 20/50/70: mejora del 20/50/70% en los criterios del Colegio Americano de Reumatología; HAQ-DI: Cuestionario de Evaluación de la Salud-Índice de Discapacidad; FACIT-Fatiga: Cuestionario de Evaluación Funcional de la Fatiga de la Terapia de Enfermedades Crónicas. Adaptado de [2, 4]
Conclusión
La ampliación de la indicación del risankizumab en marzo de 2022 permite ahora a los pacientes adultos con APs activa beneficiarse de esta opción de tratamiento eficaz a largo plazo con un perfil de seguridad estable y un uso fácil para el paciente [1, 6]. Como demuestran los resultados de KEEPsAKE 1 y 2, el tratamiento con el inhibidor de la IL-23 puede aliviar significativamente los síntomas asociados a la APs [2, 4].
Literatura
Los profesionales pueden solicitar las referencias en medinfo.ch@abbvie.com.
Con el apoyo financiero de AbbVie AG, Alte Steinhauserstrasse 14, 6330 Cham.
Breve información técnica Skyrizi
CH-SKZD-220042_03/2022