Los tumores malignos del tracto gastrointestinal son frecuentes y la necesidad de nuevas opciones terapéuticas es elevada. En la reunión anual de la ASCO de este año se presentaron nuevos e interesantes resultados de estudios sobre carcinomas colorrectales, así como sobre carcinomas de esófago, de la unión gastroesofágica y de estómago. Pronto podrían cambiar la práctica clínica diaria.
Los tumores malignos del tracto gastrointestinal son frecuentes. En EE.UU. se esperan este año 338.090 nuevos casos (alrededor del 20% de todas las neoplasias malignas de diagnóstico reciente) y 169.280 fallecimientos (alrededor del 30% de todas las muertes causadas por neoplasias malignas) [1]. Según el Registro Suizo del Cáncer, 22.505 personas en Suiza fueron diagnosticadas de cáncer colorrectal (CCR) durante el periodo de observación de 2013 a 2017, y 8939 fallecieron a causa de esta enfermedad. En el mismo periodo, murieron 5009 de las 7727 personas que tenían carcinomas de esófago (O), unión gastroesofágica (GJ) y estómago [2]. Estas cifras ponen de manifiesto la necesidad de nuevas opciones terapéuticas para el tratamiento de las enfermedades tumorales de estos sistemas orgánicos.
En la reunión anual de la Sociedad Americana de Oncología ( ASCO), celebrada en junio de 2021, se presentaron los resultados de nuevos estudios sobre carcinomas colorrectales y sobre carcinomas de esófago, unión gastroesofágica y estómago. A continuación se expondrán las normas de tratamiento actuales, así como los avances científicos de especial interés presentados recientemente.
Carcinomas de colon
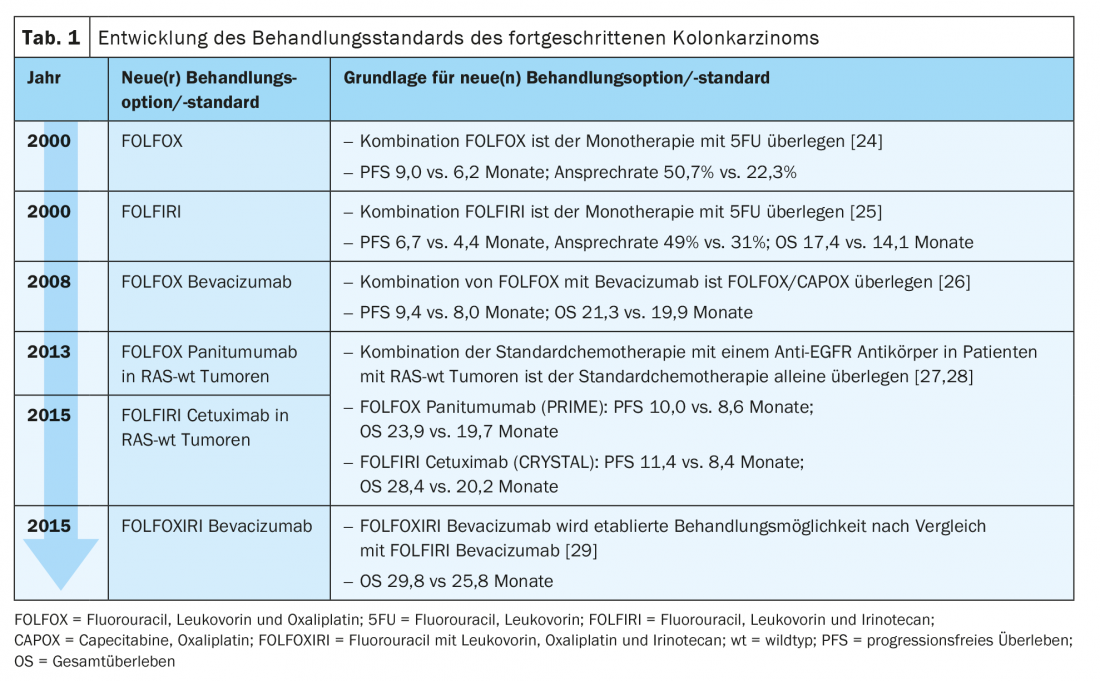
El tratamiento estándar del cáncer de colon avanzado en la primera línea de tratamiento consiste hoy en día en una combinación de dos a tres agentes quimioterapéuticos con un anticuerpo (Ab) contra el receptor del factor de crecimiento epidérmico (EGFR) o contra el factor de crecimiento endotelial vascular (VEGF) (Tab. 1) .
Con el creciente uso de la patología molecular en la práctica clínica, también se ha hecho posible el análisis de la inestabilidad de microsatélites (MSI) como aproximación a posibles defectos en el sistema de reparación de errores de emparejamiento del ADN. Aunque la frecuencia de la MSI en el CCR depende del estadio y se encuentra con más frecuencia en los estadios iniciales (I/II: aprox. 20%; III: aprox. 12%; IV: 4-5%) [3], la MSI también es de interés en los estadios tumorales avanzados, especialmente en relación con las opciones de tratamiento inmunoterapéutico. Le et al. demostraron en 2015 que la presencia de deficiencia de reparación de emparejamientos erróneos (MMR-d) en carcinomas de distintos orígenes tisulares se asocia a una mayor tasa de respuesta (RR), una mayor supervivencia sin progresión (SLP) y una mejor supervivencia global ( SG) cuando se trata con pembrolizumab, un anticuerpo anti-PD-1. El colectivo de este estudio estaba formado por una gran proporción de pacientes con CCR [4]. Basándose en esto, actualmente se está investigando el uso de los Ab monoclonales anti-PD-1 pembrolizumab y nivolumab -también en combinación con el Ab anti-CTLA4 ipilimumab- en pacientes con carcinomas de colon avanzados.
Keynote-177
El ensayo de fase III KEYNOTE-177 comparó el uso de pembrolizumab (nombre comercial KEYTRUDA®; fabricante Merck/MSD) como tratamiento de primera línea para el CCR avanzado y metastásico con un nivel alto de MSI (MSI-H) con la quimioterapia estándar. Se aleatorizó a 307 pacientes a un brazo de intervención con pembrolizumab 200 mg cada tres semanas y a un brazo de comparación con quimioterapia estándar basada en fluorouracilo +/- bevacizumab o cetuximab. Los criterios de valoración primarios fueron la SG y la SLP. El segundo análisis provisional tras un periodo medio de observación de 32,4 meses ya mostró una SLPm claramente superior para la inmunoterapia (16,5 frente a 8,2 meses). La tasa de respuesta global (ORR) según los Criterios de Evaluación de la Respuesta en Tumores Sólidos (RECIST) también fue significativamente mayor en el grupo de pembrolizumab (43,8% frente a 33,1%). Además, hubo un número significativamente menor de acontecimientos adversos graves relacionados con el tratamiento (TRAE) en el grupo de intervención (22% TRAE ≥grado3 frente a 66%) [5]. En la reunión anual de ASCO 2021, estos prometedores datos podrían confirmarse ahora. Después de 36 meses, la tasa de SLP era del 42% en el brazo de intervención frente al 11% en el brazo estándar. La ventaja de ORR para el grupo de pembrolizumab fue del 45,1% frente al 33,1%, aún más pronunciada que en el análisis anterior. El tiempo transcurrido desde la aleatorización hasta la siguiente línea de tratamiento o hasta la muerte del paciente (SLP 2) también fue significativamente mayor en el grupo de pembrolizumab (54,0 frente a 24,9 meses). Además, el tratamiento con pembrolizumab mostró una tasa de SG significativamente superior a los 36 meses (61% frente a 50%). En el diseño del estudio se incluye un estudio cruzado, y la mediana de la SG para el grupo de pembrolizumab aún no se había alcanzado en el momento de la presentación en la Reunión Anual de la ASCO de 2021 [6]. El pembrolizumab está aprobado para el tratamiento del CCR metastásico con MSI-H como monoterapia en primera línea de tratamiento en Suiza [7].
CheckMate 142
En el estudio de fase II CheckMate 142, se está investigando el papel del nivolumab (nombre comercial OPTIVO®; fabricante BMS) en pacientes con CCR MSI-H avanzado o metastásico tras progresión bajo/después de, o en caso de intolerancia a, fluorouracilo en combinación con oxaliplatino y/o irinotecán. Se incluyeron 74 pacientes con ≥3líneas de tratamiento previas que recibieron al menos una dosis de nivolumab 3 mg/kg de peso corporal cada quince días. El criterio de valoración primario fue la ORR según RECIST. Después de doce meses, el RR fue del 31% y el 69% de los pacientes tuvieron una evolución estable de la enfermedad durante al menos doce semanas. La duración media de la respuesta al tratamiento aún no se había alcanzado en el momento de la inclusión de los datos [8]. El diseño del estudio se amplió durante el curso y se investigó una inmunoterapia combinada con nivolumab e ipilimumab a dosis bajas (nombre comercial YERVOY®; fabricante BMS) como primera línea de tratamiento para la población de pacientes con CCR metastásico. Aquí se observó un RR del 64%, una respuesta completa (RC) en el 9% y un control sostenido de la enfermedad tras 24 meses en el 79% de los casos [9]. El nivolumab está aprobado como monoterapia o en combinación con ipilimumab para el tratamiento de pacientes adultos con CCR metastásico con MMR-d/MSI-H tras un tratamiento previo a base de fluoropirimidina en combinación con irinotecán u oxaliplatino en Suiza [7,10]. Existe una recomendación sobre la cobertura de costes para el nivolumab por parte de la Oficina Federal de Salud Pública (FOPH) de la Confederación Suiza, pero no para el ipilimumab [7].
Carcinomas de esófago, unión gastroesofágica y estómago
CheckMate 648
Hasta ahora, el pronóstico del carcinoma escamoso avanzado de esófago ha sido lamentablemente muy limitado, con una mediana de SG de unos diez meses, a pesar del uso de agentes quimioterapéuticos. El ensayo CheckMate 648 compara ahora la quimioterapia sola con la combinación de quimioterapia y nivolumab, y con la combinación de los inmunoterápicos nivolumab e ipilimumab en la primera línea de tratamiento. Cerca de 1.000 pacientes con carcinoma escamoso avanzado de esófago fueron asignados aleatoriamente a tres grupos de tratamiento, independientemente de su estado respecto a PD-L1: (1) nivolumab (240 mg quincenales) y quimioterapia (fluorouracilo y cisplatino cuatro veces por semana); (2) nivolumab (3 mg/kg de peso corporal quincenales) e ipilimumab (1 mg/kg de peso corporal seis veces por semana); (3) quimioterapia sola. Los criterios de valoración primarios fueron la SG y la SLP en el grupo de pacientes con expresión de PD-L1 ≥1%. Los criterios de valoración secundarios se definieron como SG, SLP y RR en todos los pacientes, independientemente de la expresión de PD-L1.
A los doce meses, la población con expresión de PD-L1 ≥1%mostró una tasa de SG del 58% en el grupo de nivolumab + quimioterapia frente al 37% en el grupo de quimioterapia y una mediana de supervivencia beneficiosa de 6,3 meses para la combinación de nivolumab + quimioterapia. Esto también se confirmó en los pacientes que se incluyeron independientemente de la expresión de PD-L1, con una tasa de SG del 54% frente al 44% y un beneficio de supervivencia de 2,5 meses. Sin embargo, un examen más detallado del análisis de subgrupos con un desglose del beneficio de supervivencia según el estado PD-L1 muestra que existe un efecto dominante de la subpoblación PD-L1-positiva y que el beneficio de supervivencia detectable está impulsado principalmente por este subgrupo. Sigue siendo cuestionable si los pacientes PD-L1-negativos se benefician. También hubo ventajas clínicamente significativas para nivolumab + quimioterapia en términos de SLP y RR.
La comparación entre nivolumab + ipilimumab y quimioterapia sola arrojó resultados similares con una SG del 57% frente al 37% a los 12 meses y un beneficio de supervivencia de 4,6 meses con la inmunoterapia en la población de pacientes con expresión de PD-L1 ≥1%. El análisis de los subgrupos según el estado PD-L1 es muy similar a la comparación de nivolumab + quimioterapia frente a quimioterapia. Basándose en estos datos, el uso de nivolumab + quimioterapia y nivolumab + ipilimumab en pacientes con carcinoma de células escamosas del esófago PD-L1-positivo avanzado debe considerarse el nuevo estándar. Actualmente, el nivolumab y el ipilimumab aún no están aprobados para esta indicación en Suiza [7,10]. Para los pacientes con cáncer de esófago PD-L1 negativo, la quimioterapia sola sigue siendo una opción.
Si se aprobara el nivolumab en esta indicación en primera línea de tratamiento, cambiaría la secuencia de opciones terapéuticas, al menos para aquellos pacientes con tumores PD-L1 positivos. Hasta la fecha, el nivolumab está indicado para el tratamiento del adenocarcinoma avanzado o recurrente del estómago o la GEJ tras dos o más terapias sistémicas previas – actualmente se requiere una aprobación de costes en Suiza [7,10]. Por lo tanto, si su uso se desplaza ahora a la primera línea de tratamiento, esta opción farmacológica debe reconsiderarse en las líneas de tratamiento posteriores. Sopesar los factores específicos de cada paciente -por ejemplo, la presencia de enfermedades autoinmunes- podría ser un principio rector en este sentido. En principio, el uso de las opciones terapéuticas más eficaces al inicio del tratamiento es un principio oncológico común y sugiere el uso de la inmunoterapia en la primera línea de tratamiento, siempre que no existan contraindicaciones.
CheckMate 649
Enzinger et al. estableció el FOLFOX (fluorouracilo, leucovorina, oxaliplatino) como régimen de quimioterapia de primera línea para el tratamiento de pacientes con carcinoma metastásico de la Ö/GEJ en 2016. Su estudio demostró una SG y una SLP comparables con la terapia estándar de entonces ECF (epirrubicina, cisplatino, fluorouracilo) frente a FOLFOX para esta población de pacientes, predominantemente adenocarcinomas [11]. Tanto en el brazo de intervención como en el grupo de control, la quimioterapia se combinó con cetuximab. Sin embargo, esto no se corresponde con un régimen terapéutico estándar establecido para los carcinomas de la Ö/GEJ y el estómago y no permite extraer conclusiones sobre el beneficio específico del grupo al utilizar el anti-EGFR-Ab en ambos grupos de estudio.
CheckMate 649 compara ahora la quimioterapia estándar sola (CAPOX, capecitabina y oxali-platino tres veces por semana o FOLFOX fluorouracilo dos veces por semana) con el tratamiento combinado de quimioterapia y nivolumab (360 mg tres veces por semana o 240 mg dos veces por semana) y con la combinación de inmunoterapia de nivolumab + ipilimumab en la primera línea de tratamiento. Se incluyeron pacientes con adenocarcinomas avanzados de la Ö/GEJ y el estómago. Los criterios de valoración primarios para el grupo de nivolumab + quimioterapia y para el grupo de quimioterapia fueron la SLP y la SG en pacientes con una puntuación combinada positiva (CPS) ≥5%– donde CPS describe la proporción de células tumorales e inmunitarias (linfocitos y macrófagos) PD-L1-positivas en relación con todas las células tumorales. Tras un periodo de observación de aproximadamente un año, se observó una superioridad significativa de nivolumab + quimioterapia tanto en SLP como en SG. Este efecto también pudo verificarse en los pacientes con un SPC ≥1%y en todos los pacientes aleatorizados [12]. Ahora se han presentado datos adicionales de subgrupos en la Reunión Anual de la ASCO. Aquí, los beneficios de SG y SLP de nivolumab + quimioterapia fueron más pronunciados en pacientes con carcinomas con umbrales de PD-L1 más altos. En la población general, se observó un beneficio de la inmunoterapia independientemente del estado de PD-L1, aunque, como en el caso del CheckMate 648, éste fue impulsado por la subpoblación PD-L1-positiva. Para los adenocarcinomas de la Ö/GEJ y el estómago positivos para PD-L1, el FOLFOX combinado con nivolumab es, por tanto, un nuevo estándar. Actualmente, el nivolumab no está aprobado para esta indicación en Suiza [7]. Los datos sobre el brazo del estudio con nivolumab + ipilimumab aún están pendientes [13].
KEYNOTE-811
El ensayo REAL-2, un estudio de no inferioridad, estableció CAPOX en 2008 como alternativa al fluorouracilo y el cisplatino en el tratamiento del carcinoma avanzado de oe/GEJ y estómago, independientemente de su histología. Se combinaron una fluoropirimidina y un compuesto de platino con la antraciclina epirubicina [14].
En el ensayo ToGA, un estudio aleatorizado de fase III, se investigó entonces la adición de trastuzumab, un anti-HER2-Ab, a esta quimioterapia estándar (capecitabina y cisplatino, o fluorouracilo y cisplatino) en la terapia de primera línea. Se incluyeron pacientes con carcinomas avanzados HER-2 positivos de estómago y GEJ. La combinación triple existente de REAL-2 con una antraciclina no se integró en el diseño de este estudio debido a la cardiotoxicidad de este grupo de fármacos y a las propiedades cardiotóxicas del trastuzumab. Debido a un aumento significativo de la SG, la combinación de quimioterapia y trastuzumab se convirtió en el nuevo tratamiento estándar en esta población de pacientes [15].
En el estudio KEYNOTE-811, se está investigando ahora la adición de pembrolizumab 200 mg cada tres semanas al estándar antes mencionado en el tratamiento de primera línea para este mismo grupo de pacientes. Los resultados iniciales se presentaron en la reunión anual ASCO 2021: Hubo una mejora significativa del RR del 74,4% frente al 51,9% y una tasa de RC del 11,3% frente al 3,1% con pembrolizumab + quimioterapia. La tasa de remisión parcial fue del 63% frente al 49%. Los criterios de valoración primarios de la SG y la SLP siguen pendientes de [16].
Actualización de CROSS/Actualización de Neo-AEGIS
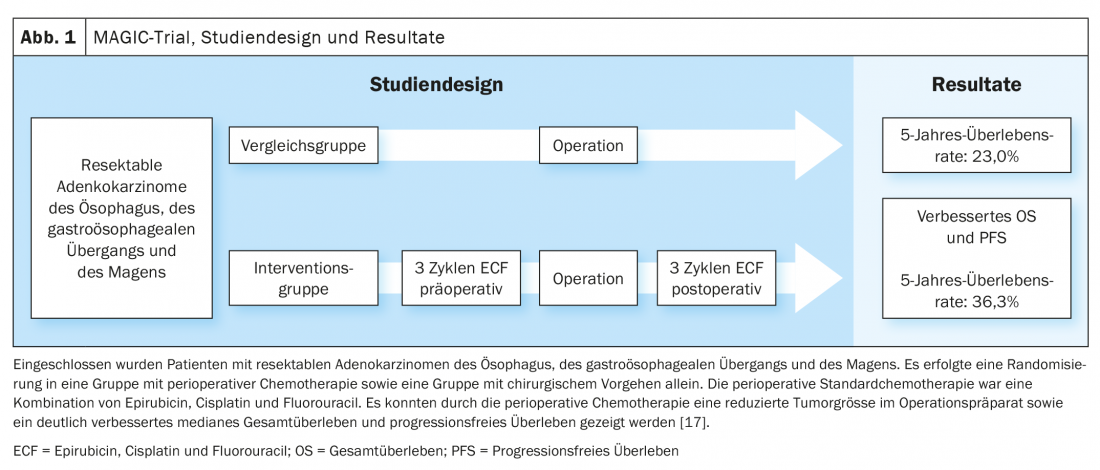
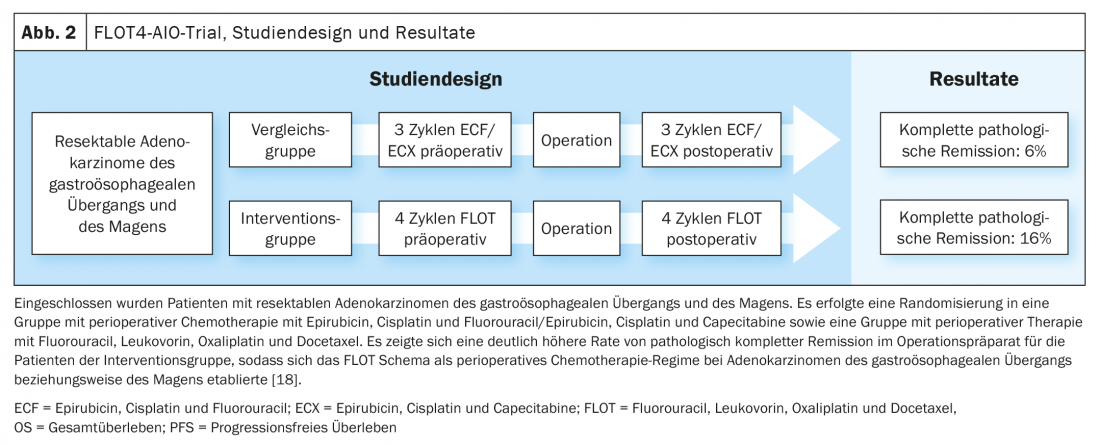
Basándose en los datos del estudio MAGIC y en el desarrollo ulterior del concepto de tratamiento en el estudio FLOT4-AIO, la quimioterapia perioperatoria con FLOT (fluorouracilo, leucovorina, oxaliplatino, docetaxel) se ha convertido en una opción de tratamiento curativo establecida para los carcinomas gastroesofágicos (Fig. 1, Fig. 2) [17,18]. Esto contrasta con el concepto de terapia trimodal del estudio CROSS (Fig. 3) [19]. La cuestión de cuál de los dos enfoques -quimioterapia perioperatoria (protocolo MAGIC/FLOT) o radioquimioterapia neoadyuvante análoga a CROSS- ofrece una ventaja está siendo abordada actualmente por el estudio Neo-AEGIS.
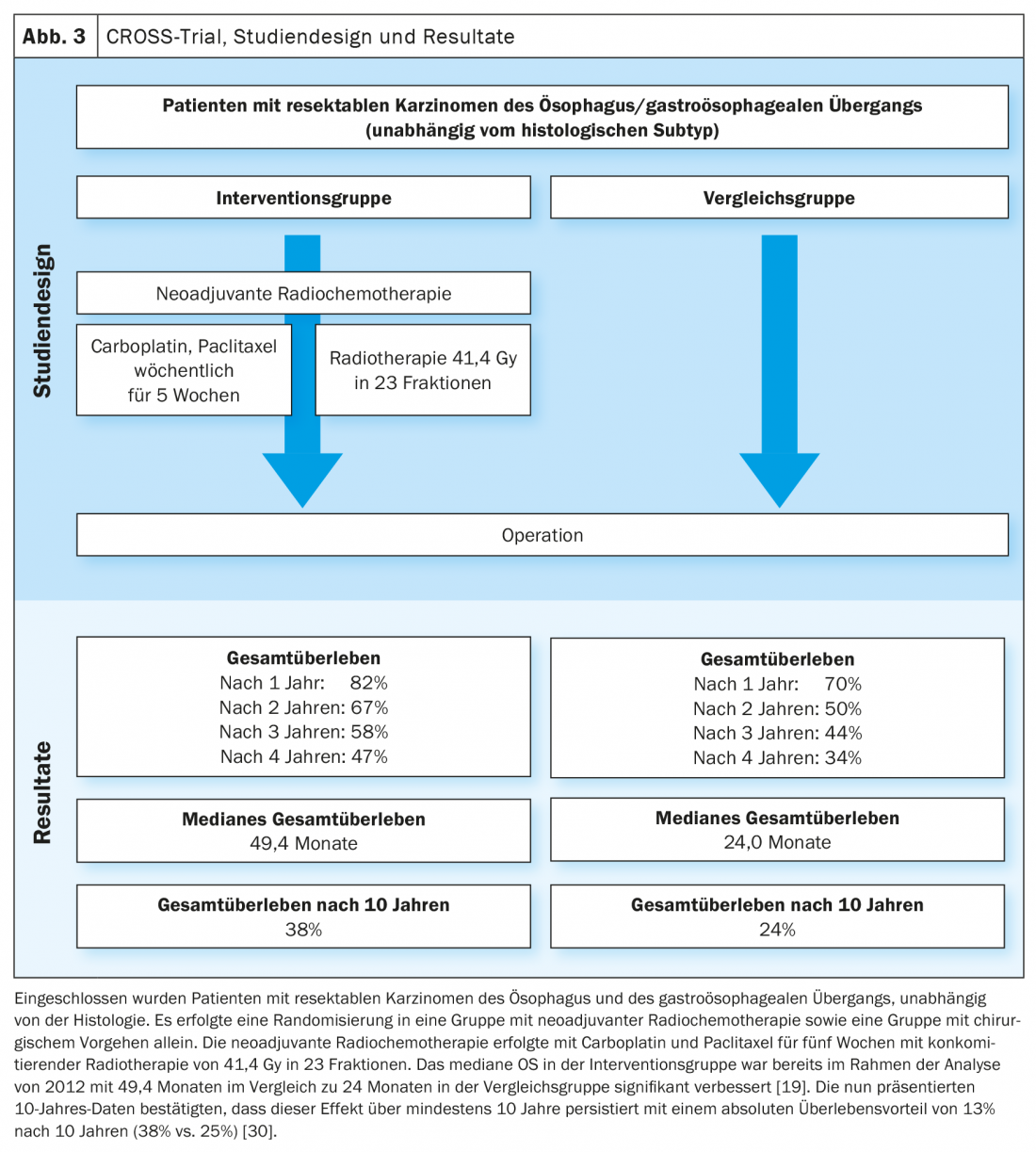
Para ello, los pacientes con adenocarcinomas resecables de la Ö/GEJ fueron aleatorizados 1:1 a quimioterapia perioperatoria (inicialmente análoga a MAGIC, en el curso análoga a FLOT4-AIO) y terapia trimodal análoga a CROSS [20]. En el análisis actual (ASCO 2021), se siguió un enfoque de no inferioridad. No hubo pruebas de una clara inferioridad de la quimioterapia perioperatoria en comparación con el enfoque trimodal. No obstante, los pacientes tratados con CROSS mostraron una mayor tasa de resección sana (R0), más ganglios linfáticos histológicamente negativos tras la terapia previa (ypN0), un mayor grado de regresión tumoral y RC patológica. La tasa de neutropenia ≥Grado3 y el número de sepsis neutropénicas fueron mayores en el grupo de quimioterapia perioperatoria, mientras que las muertes postoperatorias en el hospital/neumonía postoperatoria y SDRA, así como las insuficiencias anastomóticas fueron aproximadamente igual de frecuentes. El criterio de valoración principal del estudio fue la SG, que mostró un resultado comparable tras un periodo de observación de tres años [21].
Por lo tanto, aún no se puede derivar una recomendación clara de los datos actuales del estudio Neo-AEGIS. Los factores del paciente, como las comorbilidades, deben tenerse en cuenta a la hora de seleccionar el concepto terapéutico. Además, las opciones terapéuticas posteriores también deben incluirse en la elección de la terapia. Así pues, tras el régimen CROSS, es concebible la inmunoterapia adyuvante con nivolumab, de forma análoga al estudio CheckMate 577. Para investigarlo, los pacientes con indicios de células de carcinoma residuales en la muestra quirúrgica tras la terapia trimodal fueron asignados aleatoriamente a un grupo de intervención con nivolumab y a un grupo de control con placebo. Hubo una supervivencia libre de enfermedad significativamente mayor en el grupo de nivolumab (22,4 meses frente a 11,0 meses) [22]. El nivolumab está aprobado en Suiza para esta indicación, aunque la FOPH no recomienda actualmente que se cubran los costes [7,10].
GO2
Muchos estudios que configuran el panorama oncológico se basan en poblaciones con una edad media en torno a los 60 años. Sin embargo, esto sólo refleja de forma limitada la realidad de la vida cotidiana en oncología, ya que la población de pacientes oncológicos está formada cada vez más por pacientes de edad avanzada con comorbilidades o limitaciones en su estado de salud relacionadas con la edad.
Esta cuestión se abordó en la Reunión Anual de la ASCO de 2021 para pacientes con cáncer gastroesofágico avanzado. El ensayo de fase III GO2 incluyó una población de pacientes con una edad media de 76 años. Se administró quimioterapia paliativa trisemanal con CAPOX en tres niveles de dosis: dosis completa (oxaliplatino 130 mg/m2 el día 1 y capecitabina 625 mg/m2 dos veces al día los días 1-14) y 80% y 60% de esta dosis. Un enfoque de no inferioridadmostró una SLP comparable sin reducciones significativas entre los tres grupos de dosificación con una mejor tolerabilidad general del nivel de dosificación más bajo [23].
Mensajes para llevarse a casa
- La inmunoterapia con pembrolizumab produce una mejora de la supervivencia libre de progresión y de la supervivencia global, así como una tasa de respuesta al tratamiento superior a la de la quimioterapia estándar en el tratamiento de primera línea del cáncer de colon avanzado y metastásico con alta inestabilidad de microsatélites (MSI-H).
- La combinación de nivolumab y quimioterapia, así como la inmunoterapia combinada con nivolumab e ipilimumab, dan lugar a una mejor supervivencia global que la quimioterapia estándar sola en el tratamiento de primera línea del carcinoma escamoso avanzado de esófago con expresión de PD-L1 ≥1%.
- La combinación de nivolumab y quimioterapia da lugar a una mejor supervivencia libre de progresión y supervivencia global que la quimioterapia estándar sola en el tratamiento de primera línea del adenocarcinoma avanzado de esófago, unión gastroesofágica y estómago, en particular en la subpoblación PD-L1 positiva.
- La quimioterapia perioperatoria no es inferior al enfoque de tratamiento trimodal con radioquimioterapia neoadyuvante en el tratamiento curativo de los adenocarcinomas resecables del esófago y de la unión gastroesofágica en términos de supervivencia global, pero conduce más frecuentemente a la neutropenia y consigue menos resecciones R0 y
- Regresión tumoral en tumor primario y ganglios linfáticos.
Literatura:
- Siegel RL, et al: Estadísticas del cáncer 2021. CA Cancer J Clin. 2021; 71: 7-33.
- Registro Nacional del Cáncer, www.nkrs.ch/de/stat (último acceso en septiembre de 2021)
- Battaglin F, et al: Inestabilidad de microsatélites en el cáncer colorrectal: visión general de su importancia clínica y nuevas perspectivas. Clin Adv Hematol Oncol. 2018; 16(11): 735-745.
- Le DT, et al: Bloqueo de PD-1 en tumores con deficiencia de reparación del emparejamiento múltiple. N Engl J Med. 2015; 372(26): 2509-2520.
- André T, et al: Pembrolizumab en cáncer colorrectal avanzado con alta inestabilidad de microsatélites. N Engl J Med. 2020; 383(23): 2207-2218.
- André T, et al.: Supervivencia global final del estudio de fase III KN177: pembrolizumab frente a quimioterapia en cáncer colorrectal metastásico (CCRm) con inestabilidad de microsatélites-alta/déficit de reparación de emparejamientos (MSI-H/dMMR). Resumen 3500, Reunión virtual ASCO 2021, 4-8 de junio de 2021.
- Oficina Federal de Salud Pública FOPH: Spezialitätenliste. www.spezialitätenliste.ch (último acceso en septiembre de 2021)
- Overman MJ, et al: Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer (CheckMate 142): an open-label, multicentre, phase 2 study. Lancet Oncol. 2017; 18(9): 1182-1191. fe de erratas en: Lancet Oncol. 2017; 18(9).
- Helwick C: Análisis actualizado de CheckMate 142: Nivolumab en primera línea más ipilimumab en dosis bajas en el cáncer colorrectal metastásico MSI-H/dMMR. ASCO Post. 2020. https://ascopost.com/issues/april-25-2020/checkmate-142-updated-analysis/
- Compendio OPTIVO. https://compendium.ch/product/1310903-opdivo-inf-konz-40-mg-4ml/mpro#MPro7100 (último acceso en septiembre de 2021)
- Enzinger PC, et al: CALGB 80403 (Alliance)/E1206: Estudio aleatorizado de fase II de tres regímenes de quimioterapia más cetuximab en cánceres metastásicos de esófago y de la unión gastroesofágica. J Clin Oncol. 2016; 34(23): 2736-2742.
- Janjigian YY, et al: Nivolumab en primera línea más quimioterapia frente a quimioterapia sola para el adenocarcinoma avanzado gástrico, de la unión gastroesofágica y esofágico (CheckMate 649): ensayo aleatorizado, abierto, de fase 3. Lancet. 2021; 398(10294): 27-40.
- Moehler MH, et al: Nivolumab (NIVO) de primera línea (1L) más quimioterapia (quimio) frente a quimioterapia en cáncer gástrico avanzado/cáncer de la unión gastroesofágica/adenocarcinoma esofágico (CG/CGEE/EAC): Datos ampliados de eficacia y seguridad de Checkmate 649. Resumen 4002, Reunión virtual ASCO 2021, 4-8 de junio de 2021.
- Cunningham D, et al: Capecitabina y oxaliplatino para el cáncer esofagogástrico avanzado. N Engl J Med. 2008; 358: 36-46.
- Bang YJ, et al: Trastuzumab en combinación con quimioterapia frente a quimioterapia sola para el tratamiento del cáncer gástrico o de la unión gastroesofágica avanzado HER2-positivo (ToGA): un ensayo de fase 3, abierto, aleatorizado y controlado. Lancet. 2010; 376: 687-697.
- Janjigian YY, et al: Pembrolizumab más trastuzumab y quimioterapia para el cáncer metastásico de estómago o de la unión gastroesofágica (G/GEJ) HER2+: resultados iniciales del estudio global de fase 3 KEYNOTE-811. Resumen 4013, Reunión virtual ASCO 2021, 4-8 de junio de 2021.
- Cunningham D, et al: Quimioterapia perioperatoria frente a cirugía sola para el cáncer gastroesofágico resecable. N Engl J Med. 2006; 355: 11-20.
- Al-Batran SE, et al: Regresión histopatológica tras la administración neoadyuvante de docetaxel, oxaliplatino, fluorouracilo y leucovorina frente a epirubicina, cisplatino y fluorouracilo o capecitabina en pacientes con adenocarcinoma gástrico o de la unión gastroesofágica resecable (FLOT4-AIO): resultado de la parte de fase 2 de un ensayo multicéntrico, abierto y aleatorizado de fase 2/3. Lancet Oncol. 2016; 17: 1697-1708.
- Van Hagen P, et al: Quimiorradioterapia peroperatoria para el cáncer de esófago o de la unión. N Engl J Med 2012; 366; 2074-2084.
- Reynolds JV, et al: ICORG 10-14: Ensayo neoadyuvante en el estudio internacional del adenocarcinoma de esófago y de la unión esofagogástrica (Neo-AEGIS). BMC Cáncer. 2017; 17: 401.
- Reynolds JV, et al: Neo-AEGIS (Neoadjuvant trial in Adenocarcinoma of the Esophagus and Esophago-Gastric Junction International Study): Resultados preliminares del ECA de fase III de CROSS frente a quimioterapia perioperatoria (protocolo MAGIC o FLOT modificado). Resumen 4004, Reunión virtual ASCO 2021, 4-8 de junio de 2021.
- Kelly RJ, et al: Investigadores de CheckMate 577. Nivolumab adyuvante en cáncer de esófago o de la unión gastroesofágica resecados. N Engl J Med. 2021; 384(13): 1191-1203.
- Hall PS, et al: Eficacia de la quimioterapia de intensidad reducida con oxaliplatino y capecitabina en la calidad de vida y el control del cáncer entre pacientes ancianos y frágiles con cáncer gastroesofágico avanzado. El ensayo clínico aleatorizado de fase 3 GO2. JAMA Oncol. 2021; 7(6): 869-877.
- De Gramont A, et al: Leucovorina y fluorouracilo con o sin oxaliplatino como tratamiento de primera línea en el cáncer colorrectal avanzado. J Clin Oncol. 2000; 18(16): 2938-2947.
- Douillard JY, et al: Irinotecán combinado con fluorouracilo comparado con fluorouracilo solo como tratamiento de primera línea para el cáncer colorrectal metastásico: un ensayo aleatorizado multicéntrico. Lancet. 2000; 355(9209): 1041-1047. Fe de erratas en: Lancet. 2000; 355(9212): 1372.
- Saltz LB, et al: Bevacizumab en combinación con quimioterapia basada en oxaliplatino como tratamiento de primera línea en el cáncer colorrectal metastásico: un estudio aleatorizado de fase III. J Clin Oncol. 2008; 26(12): 2013-2019. fe de erratas en: J Clin Oncol. 2008; 26(18): 3110. fe de erratas en: J Clin Oncol. 2009; 27(4): 653.
- Douillard JY, et al: Tratamiento con panitumumab-FOLFOX4 y mutaciones RAS en el cáncer colorrectal. N Engl J Med. 2013; 369(11): 1023-1034.
- Van Cutsem E, et al: Tratamiento con fluorouracilo, leucovorina e irinotecán más cetuximab y mutaciones RAS en el cáncer colorrectal. J Clin Oncol. 2015; 33(7): 692-700.
- Cremolini C, et al: FOLFOXIRI más bevacizumab frente a FOLFIRI más bevacizumab como tratamiento de primera línea de pacientes con cáncer colorrectal metastásico: supervivencia global actualizada y análisis de subgrupos moleculares del estudio TRIBE de fase 3 y etiqueta abierta. Lancet Oncol. 2015; 16(13): 1306-1315.
- Eyck BM, et al: Ten-Year Outcome of Neoadjuvant Chemoradiotherapy Plus Surgery for Esophageal Cancer: The Randomized Controlled CROSS Trial. J Clin Oncol. 2021; 39(18): 1995-2004.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2021; 9(5): 12-18