En la actualidad existen cuatro inhibidores de JAK aprobados en Europa: tofacitinib, baricitinib, upadacitinib y filgotinib. Aunque en los últimos 12 meses no ha habido muchas novedades sobre los dos primeros, han ocurrido muchas cosas, sobre todo en relación con el upadacitinib, como se resumió en el Rheumatism Update 2021.
Por ejemplo, se publicó el primer estudio cara a cara (SELECT-CHOICE) en pacientes bDMARD-IR: 612 pacientes con artritis reumatoide activa a pesar del tratamiento con csDMARD y fracaso terapéutico con al menos un biológico temprano fueron aleatorizados de forma ciega y controlada con placebo a abatacept i.v. (n=309) o upadacitinib (n=303) [2]. El criterio de valoración primario fue la DAS28(PCR) desde el inicio hasta la semana 12. El upadacitinib (UPA) obtuvo mejores resultados que el abatacept (ABA) en todos los parámetros estudiados. La proporción de pacientes con remisión de la DAS28(CRP) fue de casi el 30% con UPA frente al 13% con ABA. La Prof. Dra. Andrea Rubbert-Roth, del Departamento de Reumatología del Hospital Cantonal de St. Gallen, que también es la primera autora del estudio, concluyó que el tratamiento con UPA es superior al abatacept en cuanto a eficacia en pacientes con AR con una respuesta inadecuada a los bDMARD, con una incidencia ligeramente superior de acontecimientos adversos graves (3,3% frente a 3,4%). 1,6%, 2 TEV y 1 MACE* ocurrieron con UPA, curiosamente, el herpes zóster ocurrió con la misma frecuencia en ambos grupos con 4 pacientes cada uno).
En otro estudio (SELECT-COMPARE), los pacientes cuya AR estaba activa a pesar del metotrexato fueron aleatorizados a UPA 15 mg/día (n=651) frente a adalimumab (ADA, n=327) frente a placebo (n=651). En caso de respuesta insuficiente (definida como ausencia de ACR20 tras 14 semanas = no respondedor o CDAI >10 = respuesta parcial), se les podía cambiar al otro régimen farmacológico activo sin interrupción a partir de la semana 14.
* Eventos cardiovasculares adversos mayores (= muerte cardiovascular, infarto de miocardio no mortal, cardiopatía coronaria, eventos cerebrovasculares).
Filgotinib “altamente potente“ para la terapia de la AR
El resultado del cambio: Los pacientes que pasaron de ADA a UPA obtuvieron mejores resultados que los que habían pasado de UPA a ADA. Al cambiar de adalimumab a upadacitinib, el 47% de los no respondedores y el 58% de los respondedores incompletos alcanzaron el CDAI-LDA; por el contrario, estas cifras fueron del 36% y el 45%, respectivamente. Estos son los primeros datos que muestran lo que puede hacerse cuando ha habido una respuesta inadecuada a un inhibidor de JAK, afirma el profesor Rubbert-Roth.
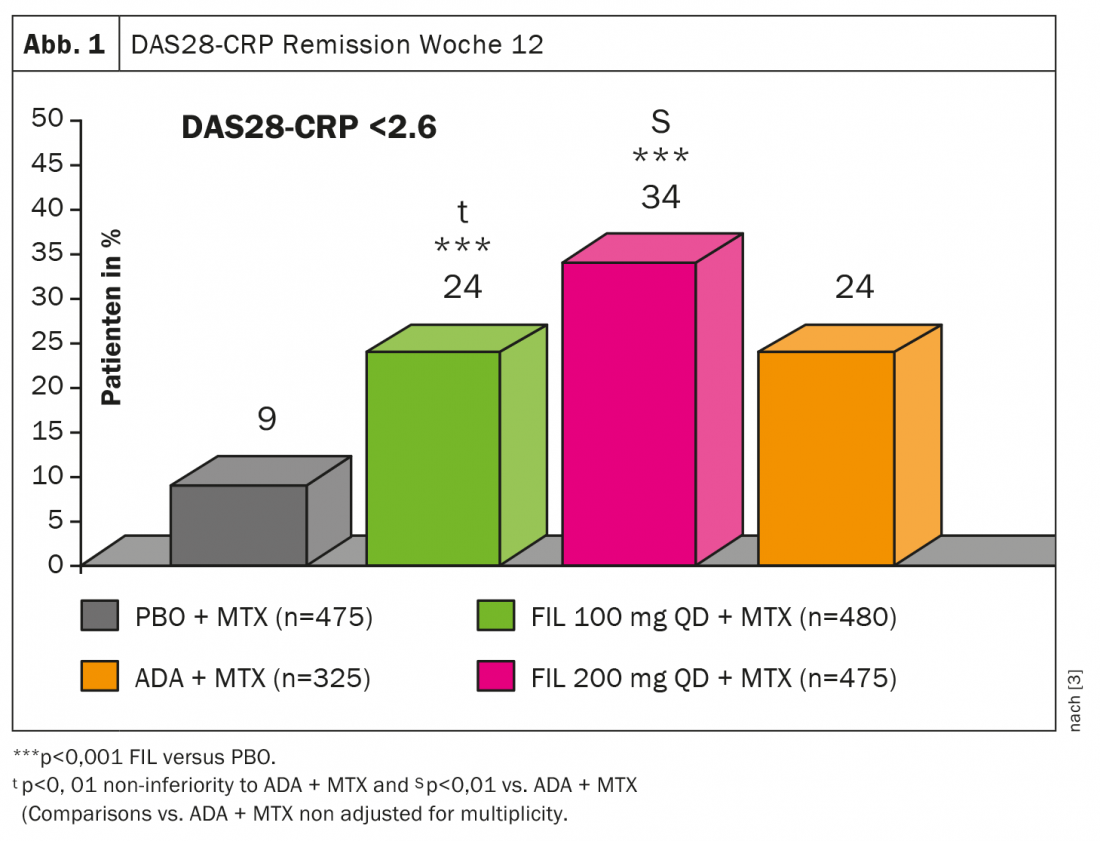
Con respecto al filgotinib (FIL), recientemente se han publicado los datos del estudio FINCH1, un ensayo de fase 3 doble ciego controlado con placebo en el que participaron 1755 pacientes con AR activa a pesar del metotrexato (MTX) [3]. Se ajustó a FIL 100 mg (n=480), FIL 200 mg (n=475), ADA (n=325) o placebo (n=475), el criterio de valoración principal fue ACR20 en la semana 12. la emisión de DAS28(CRP) en la semana 12 estaba bajo la combinación FIL 200 mg más MTX mejor que ADA + MTX o FIL 100 mg + MTX (Fig.1). Aunque la superioridad sólo fue visible en la dosis más alta: “El filgotinib también es un inhibidor de JAK muy potente para el tratamiento de la AR”, concluyó el experto.
Resultados de estudios sobre productos biológicos
También han surgido nuevos hallazgos en la investigación sobre productos biológicos. Un estudio analizó si existe algún beneficio en el inicio precoz de los fármacos biológicos. El estudio NORD-STAR, un ensayo aleatorizado y multicéntrico en 812 pacientes con AR temprana, publicado el año pasado, comparó cuatro brazos de tratamiento diferentes [4]:
- MTX + prednisona (disminución progresiva a 5 mg /d) o MTX + SSA + HCQ + esteroides intraarticulares
- MTX + certolizumab pegol
- MTX + Abatacept
- MTX + tocilizumab
Como resultado, no hubo ningún beneficio significativo. El MTX + abatacept logró la mayor tasa de remisión del CDAI, y la terapia combinada convencional no fue inferior al certolizumab + MTX o al tocilizumab + MTX. Sin embargo, el estudio no tenía potencia suficiente para comparar los tres brazos de bDMARD. Si lo hiciera, le parecería, al menos numéricamente, que la tasa de remisión del CDAI bajo MTX + Abatacept es más alta después de todo, un 56,3%, que lo que se ve bajo certolizumab (52,6%) o tocilizumab (48,7%), dijo el Prof. Rubbert-Roth. Sin embargo, el estudio continuará, con una segunda parte en la que se examinarán y compararán 2 estrategias de desescalada.
El riesgo de linfoma no aumenta
Los linfomas fueron un gran tema en relación con la terapia con bloqueadores del TNF durante años: por un lado, se demostró que se producen más linfomas cuando la actividad de la enfermedad es alta. Por otro lado, también se ha detectado un aumento de las tasas de linfoma en pacientes con AR inicialmente bajo terapia con inhibidores del TNF, “y admito que nunca lo entendí, porque los pacientes experimentan una reducción de la actividad de la enfermedad bajo los bloqueadores del TNF”, afirmó el Prof. Rubbert-Roth. Pensó que probablemente se debía a que los pacientes habían tenido AR durante mucho tiempo. Un estudio de 2020 volvió a examinar este fenómeno y analizó los datos del registro sueco de AR.
Para los pacientes con bDMARD (n=16 392) y aquellos sin biológicos (n=55 253), se registraron todos los linfomas de nueva aparición entre 2001 y 2016. El análisis de los pacientes que fueron tratados con un biológico después de 2006 mostró que los primeros incluso tenían un riesgo reducido de desarrollar linfoma (HR ajustado 0,69; IC del 95%: 0,28-0,73) en comparación con los pacientes sin tratamiento biológico. “Se trata de datos muy positivos, que sin duda ayudan a respaldar el beneficio de los biológicos”, explicó el reumatólogo.
Por último, el Prof. Rubbert-Roth también informó de resultados positivos sobre el uso y la seguridad de los biológicos en pacientes con AR con antecedentes de neoplasia maligna. En un metaanálisis basado en 12 estudios con 13.598 pacientes con AR, 10 estudios sobre bloqueantes del TNF y 3 estudios con rituximab, se investigó el riesgo relativo de recurrencia o de un segundo carcinoma [5]. En este caso, los resultados mostraron que el riesgo era comparable entre los bloqueantes del TNF, el rituximab y los csDMARD y era independiente de la duración y el intervalo de la terapia con inhibidores del TNF.
Mensajes para llevarse a casa
- Upadacitinib: interesantes datos de cambio del ensayo SELECT-COMPARE, primer estudio cara a cara en pacientes bDMARD-IR frente a abatacept
- Filgotinib: superioridad frente a ADA sólo en la dosis más alta
- No hubo superioridad en las terapias combinadas que contienen bDMARD para el tratamiento de la AR temprana en comparación con la estrategia csDMARD.
- El riesgo de linfoma en pacientes con AR sigue siendo elevado en comparación con la población normal, pero ni los inhibidores del TNF ni los biológicos sin TNF aumentan el riesgo. Existe incluso una tendencia a la reducción del riesgo de linfoma bajo terapia biológica.
- En caso de antecedentes de neoplasia, los bloqueantes del TNF, el rituximab y los csDMARD son comparables en cuanto al riesgo de recidiva o segundo tumor.
Literatura:
- RA: Therapy, Rheumatism Update 2021 (en línea), 12.03.2021.
- Rubbert-Roth A, et al: Ensayo de upadacitinib o abatacept en la artritis reumatoide. N Engl J Med 2020; 383: 1511-1521; doi: 10.1056/NEJMoa2008250.
- Combe B et al. Filgotinib frente a placebo o adalimumab en pacientes con artritis reumatoide y respuesta inadecuada al metotrexato: ensayo clínico aleatorizado de fase III. Ann Rheum Dis 2021; doi: 10.1136/annrheumdis-2020-219214.
- Hetland ML, et al: Tratamiento convencional activo y tres tratamientos biológicos diferentes en la artritis reumatoide temprana: ensayo clínico de fase IV iniciado por el investigador, aleatorizado y ciego al observador. BMJ 2020; 371: m4328; doi: 10.1136/bmj.m4328.
- Xie W, et al: Un metaanálisis de las terapias biológicas sobre el riesgo de cáncer nuevo o recurrente en pacientes con artritis reumatoide y una neoplasia previa. Reumatología 2020; 59: 930-939; doi: 10.1093/rheumatology/kez475.
InFo PAIN & GERIATURE 2021; 3(1): 34-36 (publicado el 3.7.21, antes de impresión).