Los tumores de cabeza y cuello fueron el séptimo cáncer más frecuente en todo el mundo en 2018. Los factores de riesgo más importantes son el consumo de nicotina y alcohol. El pronóstico y las opciones de tratamiento multimodal de los pacientes con tumores de cabeza y cuello varían en función de los factores epidemiológicos, la localización anatómica y el estadio tumoral. Una visión general.
Los tumores de cabeza y cuello fueron el séptimo cáncer más frecuente en todo el mundo en 2018 (890.000 nuevos casos) [1]. En EE.UU., los tumores de cabeza y cuello representaron el 3% de todos los cánceres (51.540 nuevos casos) y algo más del 1,5% de todas las muertes por cáncer (10.030 fallecimientos) [2]. Estas neoplasias se asocian sobre todo al consumo de nicotina y alcohol como factores de riesgo más importantes. En las últimas décadas, se ha observado un descenso general de la incidencia, en particular debido a la disminución del consumo de nicotina [3,4]. Por el contrario, se ha demostrado un aumento del cáncer de orofaringe en personas más jóvenes en Norteamérica y el norte de Europa, debido principalmente a una mayor incidencia de tumores asociados a subtipos de alto riesgo del virus del papiloma humano (VPH) (especialmente el VPH de tipo 16) [4,5].
El pronóstico y las opciones de tratamiento multimodal de los pacientes con cáncer de cabeza y cuello varían en función de los factores epidemiológicos, la localización anatómica y el estadio tumoral. Los tumores de cabeza y cuello representan un grupo heterogéneo de enfermedades. Este artículo de revisión se centra en las opciones de tratamiento de los carcinomas de células escamosas recidivantes y metastásicos, así como localmente avanzados, originados en las mucosas (predominantemente cavidad oral, faringe y laringe). No se tratará aquí el tratamiento en las fases iniciales de estos tumores, ya que no se han producido cambios relevantes en la terapia en los últimos años.
El tratamiento de los pacientes con tumores de cabeza y cuello es complejo e incluye no sólo el tratamiento médico del tumor y los efectos agudos de la cirugía, la quimioterapia y la radioterapia, sino también la orientación y el asesoramiento para hacer frente a los impedimentos permanentes y las consecuencias psicosociales resultantes. Afortunadamente, los descubrimientos recientes han dado lugar a mejoras significativas en los resultados del tratamiento. Los avances en cirugía y radioterapia han mejorado la conservación funcional de los órganos correspondientes y han reducido la morbilidad y la mortalidad en general. Por ejemplo, las nuevas técnicas de cirugía asistida por robot para el carcinoma orofaríngeo [6] y las de microcirugía láser mínimamente invasiva para el carcinoma laríngeo e hipofaríngeo [7] pueden aumentar de forma relevante la probabilidad de preservar la función. Los avances en radioterapia conformada, como la radioterapia de intensidad modulada (IMRT) y la radioterapia guiada por imagen, también pueden reducir la morbilidad [8]. En particular, la introducción de los inhibidores de puntos de control inmunitarios para el tratamiento del cáncer de cabeza y cuello recurrente o metastásico ha mejorado significativamente el pronóstico de muchos pacientes, lo que se comentará en primer lugar a continuación.
Tumores de cabeza y cuello recidivantes y/o con metástasis
Los tumores de cabeza y cuello recidivantes y/o con metástasis se asocian a un mal pronóstico. La mayoría de los pacientes con recidiva primaria localizada -al igual que los pacientes con tumores metastásicos de cabeza y cuello- reciben terapia sistémica paliativa, ya que sólo los pacientes seleccionados con recidiva locorregional pueden ser tratados con cirugía o radioterapia renovada [9]. En consecuencia, siempre es necesaria una evaluación interdisciplinar de la situación de la enfermedad, de los posibles tratamientos anteriores y de la situación individual para la elección individual de la mejor estrategia terapéutica. Durante muchos años, la terapia estándar para los tumores recidivantes y/o metastásicos fue el denominado “régimen EXTREME”, que incluye quimioterapia a base de platino (cisplatino o carboplatino) en combinación con fluorouracilo (5-FU) y cetuximab, un anticuerpo contra el receptor del factor de crecimiento epidérmico (EGFR), seguido de terapia de mantenimiento con cetuximab [10]. El tratamiento con el régimen EXTREME mostró una mediana de supervivencia global de unos diez meses en el estudio pivotal. Para las pacientes que no cumplían los requisitos para el régimen EXTREME, los taxanos y el metotrexato eran algunas de las pocas opciones de tratamiento disponibles. Con estas sustancias, la mediana de supervivencia global desciende a seis meses [11]. Estos datos demuestran que se necesitan urgentemente nuevas opciones de tratamiento para los pacientes con cáncer de cabeza y cuello recurrente/metastásico.
Las terapias con inhibidores de puntos de control se han establecido como un nuevo estándar en muchas entidades tumorales en los últimos años. Los tumores de cabeza y cuello se asocian a déficits inmunitarios, como la alteración de la función de las células asesinas naturales y el deterioro de los linfocitos T infiltrantes de tumores, lo que constituye el fundamento para investigar los inhibidores de puntos de control inmunitarios en estos tumores [11]. El nivolumab y el pembrolizumab, ambos anticuerpos monoclonales IgG4 anti-PD-1, se estudiaron en ensayos de fase III en pacientes con carcinoma de células escamosas de cabeza y cuello (cavidad oral, orofaringe, laringe o hipofaringe) tras el fracaso de la quimioterapia basada en platino y se compararon con el anticuerpo o la quimioterapia a elección del médico responsable del estudio (docetaxel, cetuximab o metotrexato). “Fracaso del platino” se definió como la progresión de la enfermedad en los seis meses siguientes a la quimioterapia con platino que se había utilizado con intención curativa (combinación con radioterapia) o paliativa. El estudio CheckMate 141 es el primer estudio de fase III que demostró la eficacia del nivolumab en comparación con la quimioterapia (cociente de riesgos [HR] para la muerte 0,70; p=0,01). Además, nivolumab demostró ser mejor tolerado (efectos secundarios G3/4 13,1% frente a 35,1% para nivolumab y quimioterapia, respectivamente) y condujo a una mejora de la calidad de vida [12,13]. El nivolumab fue la primera opción de tratamiento que mejoró significativamente la supervivencia global en pacientes con cáncer de cabeza y cuello recidivante/metastásico en los que había fracasado la quimioterapia basada en platino [12]. En el ensayo KEYNOTE-040, de diseño similar al ensayo CheckMate-141, el pembrolizumab también aumentó la supervivencia global en comparación con la quimioterapia [14]. Merece la pena mencionar que en ambos estudios no se exigió la evidencia de la expresión de PD-L1 como criterio de inclusión y el criterio de valoración primario no dependió del estado de PD-L1. Ninguno de los estudios mostró una diferencia significativa en la supervivencia libre de progresión. Así pues, al igual que en otros tumores sólidos, el aumento de la supervivencia global se debió principalmente a que la inmunoterapia permitió controlar la enfermedad a largo plazo en algunos pacientes. Por ejemplo, aunque sólo el 13% de los pacientes mostraron una respuesta radiológica al nivolumab, la duración media de la respuesta fue de 9,7 meses, el doble que con la quimioterapia [15]. Los anticuerpos contra PD-L1 se investigaron como monoterapia y en combinación con anticuerpos contra CTLA-4 tras el fracaso de la terapia basada en platino. Tras los estudios iniciales de fase II con durvalumab (anticuerpo anti-PD-L1) en pacientes con alta expresión de PD-L1 (≥25%) en el estudio HAWK [16] y durvalumab, durvalumab más tremelimumab (anticuerpo anti-CTLA-4) o tremelimumab solo en pacientes con baja expresión de PD-L1 (<25%) en el estudio CONDOR [17], se inició el estudio de fase III EAGLE [18]. En este ensayo, los pacientes con cáncer de cabeza y cuello recidivante/metastásico en los que había fracasado la terapia basada en platino fueron aleatorizados entre durvalumab más tremelimumab, monoterapia con durvalumab o quimioterapia estándar a elección del médico del ensayo. El estudio no mostró ningún beneficio para la supervivencia con durvalumab (HR 0,88; p=0,20) o durvalumab más tremelimumab (HR 1,04; p=0,76) en comparación con la quimioterapia. Teniendo en cuenta la limitada potencia de las comparaciones entre estudios, cabe destacar que la mediana de supervivencia global en el brazo de durvalumab fue similar a la de nivolumab en el ensayo CheckMate-141 (7,6 y 7,5 meses, respectivamente), pero la mediana de supervivencia global en el brazo de control fue numéricamente más larga en el ensayo EAGLE en comparación con CheckMate-141 (8,3 meses y 5,1 meses, respectivamente). Un análisis exploratorio del estudio EAGLE sugiere que esta supervivencia global superior a la esperada en el grupo de control puede deberse a unas características desequilibradas en el momento de la inclusión en el estudio (mayor porcentaje de pacientes con ECOG PS 0 y metástasis a distancia sin recidiva local/regional en el grupo de control), al mayor uso de paclitaxel en el grupo de control y al tratamiento posterior con anticuerpos anti-PD-1. [18]. Actualmente no está claro hasta qué punto la diferencia entre los anticuerpos PD-1 y PD-L1 tiene relevancia clínica.
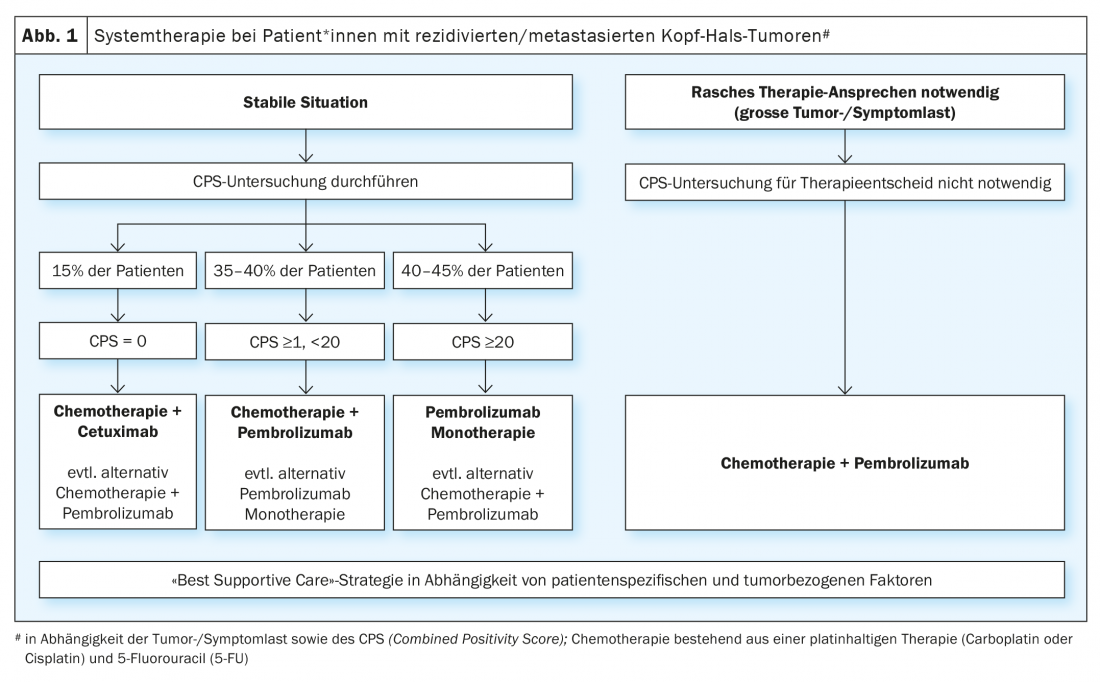
El beneficio demostrado de la terapia con inhibidores de puntos de control inmunitarios en pacientes con cáncer de cabeza y cuello recidivante/metastásico tras el fracaso de la terapia basada en platino condujo a la evaluación de estas sustancias en la terapia paliativa de primera línea. El ensayo aleatorizado de fase III KEYNOTE-048 comparó la monoterapia con pembrolizumab y un tratamiento combinado con platino/5-FU y pembrolizumab con el régimen EXTREME (platino/5-FU/ cetuximab) [19]. Se realizaron análisis estadísticos para la supervivencia global en la población total y en subgrupos definidos en función de la expresión de PD-L1. La expresión de PD-L1 se clasificó según la denominada ” puntuación de positividad combinada” (CPS) (CPS ≥1 y ≥20). El SPC se define como el número de células PD-L1-positivas (células tumorales, linfocitos, macrófagos) dividido por el número total de células tumorales y multiplicado por un factor 100. La monoterapia con pembrolizumab mejoró significativamente la supervivencia global en pacientes con SPI ≥1 y ≥20. Aunque la tasa de respuesta fue menor que con la quimioterapia (19-21% frente a 36%), la duración media de la respuesta se multiplicó por cinco con la monoterapia con pembrolizumab (20,9 frente a 4,5 meses). La quimioterapia más pembrolizumab mejoró significativamente la supervivencia global en las tres poblaciones. No hubo diferencias significativas en la tasa de respuesta y el tiempo libre de progresión entre el tratamiento combinado de quimioterapia más pembrolizumab y el régimen EXTREME. Como era de esperar, la monoterapia con pembrolizumab se asoció a una menor toxicidad, mientras que platino/5-FU más pembrolizumab tuvo una tasa de acontecimientos adversos similar a la del régimen EXTREME. El ensayo de fase III KESTREL aleatorizó a los pacientes 2:1:1 a durvalumab solo, durvalumab más tremelimumab o al régimen EXTREME (NCT02551159). El criterio de valoración primario es la supervivencia global con durvalumab en monoterapia en comparación con EXTREME en pacientes con alta expresión de PD-L1 (definida como una expresión de > 50% en células tumorales o >25% en linfocitos infiltrantes tumorales). El criterio de valoración secundario es la supervivencia global con durvalumab más tremelimumab en comparación con EXTREME para todos los pacientes. Aún no se ha publicado ningún dato. Sin embargo, se anunció a través de un comunicado de prensa que el estudio no cumplía sus criterios de valoración.
Para la terapia de primera línea, puede resumirse que el estudio KEYNOTE-048 es el primer estudio positivo desde la publicación del estudio EXTREME en 2009 y ha cambiado el estándar de atención. Sin embargo, aún quedan algunas cuestiones abiertas relativas a la práctica diaria. Una es si los pacientes con un SPC ≥20, que representaron el 44% de los pacientes con expresión probada de PD-L1 en el ensayo KEYNOTE-048, fueron la razón del beneficio de la monoterapia con pembrolizumab en el grupo de SPC ≥1. La pregunta de si la monoterapia con pembrolizumab es suficiente para los pacientes con SPC 1-19 no puede responderse de forma inequívoca. Un análisis de subgrupos del ensayo KEYNOTE-048 mostró que el pembrolizumab seguía aportando un beneficio en comparación con el EXTREME en el SPC 1-19 (HR 0,86), aunque menor que en los pacientes* con SPC ≥20 (HR 0,58) [20]. En la práctica clínica, la decisión a favor de la monoterapia con pembrolizumab frente a la terapia combinada con platino/5-FU más pembrolizumab para pacientes con SPC 1-19 depende principalmente de la carga tumoral y sintomática. Además, también deben tenerse en cuenta las comorbilidades y el estado general de los afectados. En pacientes con CPS 1-19 y una carga tumoral elevada y/o síntomas significativos relacionados con el tumor, suele preferirse la quimioinmunoterapia combinada para maximizar la respuesta potencial. Otra cuestión es la secuencia de tratamiento de los pacientes PD-L1-negativos, que constituyen alrededor del 15% de los afectados. Un análisis de subgrupos para pacientes PD-L1 negativos en el estudio KEYNOTE 048 mostró un beneficio para el régimen EXTREME en comparación con el tratamiento combinado con pembrolizumab (HR 1,22) [20]. Sin embargo, dado el pequeño número de pacientes de esta cohorte y el hecho de que se trataba de un análisis de subgrupos no planificado, no se puede concluir que los pacientes PD-L1 negativos no deban ser tratados con la combinación de platino/5-FU y pembrolizumab. En resumen, la monoterapia con pembrolizumab en pacientes con alta expresión de PD-L1 (CPS ≥20) y la terapia combinada de platino/5-FU y pembrolizumab, independientemente de la expresión de PD-L1, pero especialmente en tumores PD-L1 positivos, representan un nuevo estándar terapéutico. (Fig. 1). Para los pacientes que muestren progresión tumoral bajo o después de esta terapia de primera línea, las quimioterapias mencionadas (docetaxel, metotrexato) o el tratamiento con cetuximab son opciones terapéuticas disponibles. Actualmente se están investigando nuevos enfoques inmunoterapéuticos en numerosos estudios. Por ejemplo, el estudio INTERLINK-1 está abierto al reclutamiento en varios centros de Suiza. Este ensayo aleatorizado compara el cetuximab con la combinación de cetuximab y el inhibidor del punto de control inmunitario monalizumab dirigido contra NKG2A (NCT04590963).
Además de la expresión de PD-L1, el estado del VPH también podría servir como biomarcador clínico para predecir la respuesta a la terapia con inhibidores de puntos de control inmunitarios. La infección por VPH conduce a la producción de proteínas relacionadas con el virus que pueden desencadenar una respuesta de células T de novo y una mayor infiltración del tumor con células T CD8+ [21]. En el ensayo de fase II KEYNOTE-055, la tasa de respuesta al pembrolizumab fue del 22% en pacientes con tumores p16 positivos y del 16% en tumores p16 negativos [22]. Un metaanálisis también mostró que el estado del VPH parece correlacionarse con la tasa de respuesta al tratamiento anti-PD-1 independientemente de la expresión de PD-L1 y de la carga de mutaciones tumorales [23]. Otro metaanálisis concluyó que las pacientes con tumores VPH positivos presentaban resultados significativamente mejores cuando eran tratadas con inhibidores de los puntos de control inmunitarios [24]. Todavía no se puede evaluar definitivamente si estos resultados son relevantes en la práctica clínica diaria. Las directrices actuales sobre inmunoterapia para los tumores de cabeza y cuello aún no recomiendan utilizar el estado del VPH para tomar decisiones sobre el tratamiento [25].
Tumores de cabeza y cuello localmente avanzados
Más del 60% de los pacientes con carcinoma de células escamosas de cabeza y cuello presentan un estadio III o IV, que se caracteriza por tumores de gran tamaño con una marcada invasión local, evidencia de metástasis en los ganglios linfáticos regionales, o ambas cosas. La enfermedad localmente avanzada conlleva un alto riesgo de recidiva local (del 15% al 40%) y de metástasis a distancia [26]. Los enfoques multimodales han mejorado las tasas de curación al tiempo que pretenden preservar la función y la calidad de vida [27]. Las decisiones terapéuticas en estas fases requieren un complejo equilibrio entre la morbilidad, los posibles efectos secundarios y la preservación de la función. También dependen en gran medida del tamaño y la localización anatómica del tumor primario, el estadio de la enfermedad, la edad de la persona afectada, sus preferencias, así como su estado general y las enfermedades concomitantes. Por lo tanto, estas decisiones terapéuticas deben tomarse siempre de forma interdisciplinar en el marco de una junta tumoral.
En el caso de tumores localmente avanzados y resecables, la terapia adyuvante, consistente en radioterapia o radioquimioterapia combinada (RCT), sigue a la resección con intención curativa. Esto depende de los factores de riesgo y las comorbilidades de los afectados. La evidencia microscópica de células tumorales en el resecado (R1) y la evidencia de crecimiento extracapsular en los ganglios linfáticos se consideran factores de riesgo de “alto riesgo”. Si están presentes, se recomienda un ECA combinado adyuvante. El cisplatino se ha consolidado aquí como el agente quimioterapéutico [28,29].
Cuando la resección quirúrgica es técnica o comórbidamente inviable o conduciría a resultados funcionales potencialmente pobres a largo plazo, la ECA definitiva es el estándar curativo establecido. Un gran metaanálisis (Meta-analysis of Chemotherapy in Head and Neck Cancer [MACH-NC]) incluyó a casi 20 000 pacientes con cáncer de cabeza y cuello localmente avanzado. El ECA combinado demostró reducir la mortalidad a 5 años en 6,5 puntos porcentuales en comparación con la radioterapia sola (HR 0,83; p<0,001). La inducción adicional o la quimioterapia adyuvante no mejoraron significativamente la supervivencia global en comparación con la ECA sola [30]. La dosis alta de cisplatino (100 mg/m2 de superficie corporal, administrada por vía intravenosa cada 21 días durante tres ciclos) administrada simultáneamente con radioterapia como parte de un ECA definitivo es el tratamiento estándar actual. Sin embargo, debido a las importantes toxicidades a corto y largo plazo asociadas al cisplatino, su uso se reserva principalmente a los pacientes más jóvenes que no presentan comorbilidades graves [30–32]. Esto dio lugar a varias modificaciones y variaciones del régimen originalmente utilizado de cisplatino (una vez cada tres semanas). Las revisiones sistemáticas compararon los datos entre el cisplatino una vez por semana y el cisplatino cada tres semanas (criterio de inclusión: dosis acumulada de cisplatino de ≥180 mg/m2). Esto mostró resultados similares y tasas más bajas de efectos secundarios graves, especialmente nefro y ototoxicidad [33]. Esto también se confirmó en nuestro propio análisis, aunque la dosis acumulada de cisplatino fue menor en los pacientes tratados a intervalos semanales [34]. Por lo tanto, la terapia semanal con cisplatino puede utilizarse como una alternativa aceptable, ya que la dosis es más controlable y la nefro y ototoxicidad suelen ser menos graves. Además, en pacientes que no son aptos para el cisplatino (por ejemplo, pacientes con enfermedad renal crónica, pérdida de audición crónica, edad avanzada o estado funcional ECOG límite), el carboplatino se utiliza a menudo en combinación con un taxano, aunque no existe una comparación directa en ensayos controlados aleatorizados. El cetuximab administrado simultáneamente con radioterapia ya fue aprobado como terapia estándar en 2006 después de que los datos demostraran que este tratamiento producía una mejora del control locorregional y de la supervivencia global en comparación con la radioterapia sola [35]. Sin embargo, ensayos aleatorizados recientes sugieren que la radioterapia combinada con cetuximab en pacientes con cáncer orofaríngeo VPH-positivo tiene peores resultados, incluida una menor supervivencia, cuando se compara directamente con altas dosis de cisplatino en combinación con radioterapia [36,37]. Así pues, la ECA combinada con cisplatino sigue siendo la terapia estándar preferida.
Otro enfoque prometedor para mejorar el pronóstico es combinar la ECA basada en cisplatino con xevinapant. El xevinapant es un antagonista de los inhibidores de la apoptosis. En un ensayo aleatorizado de fase II, la adición de xevinapant a la ECA mejoró significativamente la tasa de control tumoral locorregional como criterio de valoración primario en el plazo de 18 meses en un 21% en comparación con el placebo en combinación con la ECA (54% frente a 33%; p=0,026) [38]. Además, se observó un beneficio significativo en términos de supervivencia libre de progresión tras un seguimiento de dos años en comparación con el brazo de control (HR 0,37; p=0,0069). Tras un periodo de seguimiento de tres años, Xevinapant más ECA mostró una reducción estadísticamente significativa del 51% en el riesgo de muerte en comparación con placebo más ECA (HR 0,49; p=0,0261). Para confirmar estos resultados, actualmente se está llevando a cabo el ensayo aleatorizado de fase III TrilynX (NCT04459715).
Debido a los datos alentadores en el cáncer de cabeza y cuello recidivante/metastásico, numerosos estudios investigan actualmente el uso de inhibidores de puntos de control inmunitarios en estadios más tempranos, especialmente en tumores localmente avanzados en combinación con ECA. Por ejemplo, el estudio multinacional de fase III JAVELIN Head and Neck 100 [39] ya investigó la eficacia del avelumab, un inhibidor de PD-L1, en combinación con ECA con cisplatino en comparación con el placebo en combinación con ECA. El ensayo se interrumpió prematuramente tras un análisis intermedio porque no mostró ninguna mejora en el tiempo libre de progresión [40]. Un estudio en curso está investigando el valor de la terapia de mantenimiento con atezolizumab tras la finalización del ECA (IMvoke010; NCT03452137). Otros estudios están probando ECA combinados con inhibidores de puntos de control inmunitarios seguidos de terapia de mantenimiento. El mayor de estos ensayos es KEYNOTE-412 (pembrolizumab frente a placebo; NCT03040999).
Otro enfoque interesante que se ha investigado en varios tumores y que ha dado resultados prometedores es el uso neoadyuvante de inhibidores de puntos de control inmunitarios [41,42]. Teniendo en cuenta la situación de tratamiento naïve y la falta de células resistentes al tratamiento en comparación con la situación de recaída/metastásica, la inmunoterapia neoadyuvante puede conseguir un efecto terapéutico más potente y duradero. Por ejemplo, el tratamiento neoadyuvante anti-PD-1 en un modelo de ratón con tumores de cabeza y cuello dio lugar a una conversión de la inmunodominancia funcional e indujo respuestas inmunitarias robustas dirigidas contra el tumor [43]. Schoenfeld et al. investigaron el nivolumab (N) de forma neoadyuvante en un estudio de fase II y la combinación de nivolumab más ipilimumab (N+I) en una segunda cohorte de 29 pacientes no tratados con carcinoma de cavidad oral [44]. El nivolumab (3 mg/kg) se administró en las semanas 1 y 3, mientras que el ipilimumab (1 mg/kg) se administró sólo en la semana 1. Aunque un total de 21 pacientes experimentaron acontecimientos adversos, incluidos de grado 3/4 en 2 (N) y 5 (N+I) pacientes, no hubo retrasos en la cirugía. Además, hubo pruebas de respuesta a estas terapias en ambas cohortes. En concreto, cuatro pacientes (N, n=1; N+I, n=3) tuvieron una respuesta completa o casi completa (<10% de células tumorales vitales). Estos resultados hablan en favor de la tolerabilidad clínica y la eficacia de la inmunoterapia neoadyuvante. El estudio CAIO [45], el estudio IMCISION [46], el estudio CheckMate 358 [47], así como otros estudios [48–50], han aportado otros datos interesantes sobre el uso neoadyuvante de inhibidores de puntos de control inmunitarios, todos los cuales han demostrado la viabilidad y eficacia de esta estrategia terapéutica. En consecuencia, se iniciaron estudios más amplios sobre esta base (por ejemplo, el estudio aleatorizado de fase III KEYNOTE-689, NCT03765918). Además, es importante explorar posibles predictores de respuesta para permitir la selección de pacientes adecuados. En este caso, es importante un análisis detallado de las muestras tumorales, así como de los posibles cambios en el microambiente tumoral y de las células inmunitarias infiltradas en el tumor.
Resumen/Conclusión
La introducción de la inmunoterapia en el tratamiento de los tumores de cabeza y cuello recidivantes y/o metastásicos ha cambiado fundamentalmente la terapia de estos cuadros clínicos y ha mejorado significativamente su pronóstico. El tratamiento análogo al del estudio KEYNOTE-048 (quimioterapia con platino + 5-FU + pembrolizumab o pembolizumab mono en función del CPS y la carga tumoral/sintomática) se ha establecido como la nueva terapia paliativa de primera línea. Debido a los resultados alentadores en los estadios tumorales avanzados, la cuestión del beneficio de la inmunoterapia también se plantea para los estadios tumorales más tempranos, en combinación o secuencia con la radioterapia y la quimioterapia. Es muy probable que la secuencia de las distintas modalidades de tratamiento influya significativamente en los resultados. Sobre todo si se tiene en cuenta que la respuesta antitumoral de las células T tiene diferentes fases a las que pueden dirigirse diferentes inmunoterapias, y que tanto la radio como la quimioterapia pueden modular el sistema inmunitario al tiempo que tienen efectos citotóxicos contra las células T [51]. Se están explorando otros enfoques combinados novedosos en ensayos clínicos que combinan inmunoterapias con vacunas contra el VPH, vacunas contra tumores específicos de pacientes, terapias dirigidas a células T, virus oncolíticos y otros inmunomoduladores.
Mensajes para llevarse a casa
- La introducción de la inmunoterapia con inhibidores de puntos de control inmunitarios en el tratamiento del cáncer de cabeza y cuello recurrente/metastásico ha mejorado significativamente el pronóstico de estos pacientes.
- La monoterapia con el anticuerpo anti-PD-1 pembrolizumab en pacientes con alta expresión de PD-L1 (CPS ≥20) y la terapia combinada de platino/5-FU y pembrolizumab (independientemente de la expresión de PD-L1, pero especialmente en el caso de un CPS ≥1) representan el nuevo estándar terapéutico para los tumores de cabeza y cuello recidivantes/metastásicos basado en el estudio KEYNOTE-048.
- Para los tumores localmente avanzados e inoperables, la radioquimioterapia (RCT) definitiva combinada con cisplatino sigue siendo la terapia estándar. Las alternativas farmacológicas al cisplatino en combinación con radioterapia son el carboplatino combinado con un taxano y el cetuximab. El Xevinapant (antagonista de los inhibidores de la apoptosis) como complemento de la ECA parece prometedor (ensayo aleatorizado de fase III actualmente en curso).
- El uso de la inmunoterapia en estadios tumorales más tempranos en combinación con la ECA, como terapia de mantenimiento o en el contexto neoadyuvante, es objeto de estudios en curso.
Conflictos de intereses
ED:
No hay conflictos de intereses.
SR: Honorarios por actividades de consultoría (pago al Hospital Universitario de Basilea) de Astra-Zeneca, BMS, Boehringer-Ingelheim, Eisai, Eli Lilly, Merck Serono, MSD, Novartis, Pfizer, Roche, Takeda. Financiación de la investigación de AbbVie, Astra-Zeneca, BMS, Boehringer-Ingelheim, Merck. Apoyo a la participación en el congreso de Amgen, AstraZeneca, BMS, Boehringer-Ingelheim, MSD, Roche, Takeda. Miembro de la Comisión Federal de Drogas de la Oficina Federal de Salud Pública.
Literatura:
- Bray F, et al: Estadísticas mundiales sobre el cáncer 2018: Estimaciones de GLOBOCAN sobre la incidencia y la mortalidad mundial de 36 tipos de cáncer en 185 países. CA Cancer J Clin 2018; 68: 394-424.
- Siegel RL, et al: Una evaluación del progreso en el control del cáncer. CA Cancer J Clin 2018; 68: 329-339.
- Mourad M, et al: Tendencias epidemiológicas del cáncer de cabeza y cuello en Estados Unidos: un estudio de población del SEER. J Oral Maxillofac Surg 2017; 75: 2562-2572.
- Fitzmaurice C, et al. Incidencia mundial, regional y nacional del cáncer, mortalidad, años de vida perdidos, años vividos con discapacidad y años de vida ajustados en función de la discapacidad para 32 grupos de cáncer, de 1990 a 2015: Un análisis sistemático para el estudio de la carga mundial de morbilidad Colaboración para la carga mundial de morbilidad del cáncer. JAMA Oncol. 2017; 3: 524-548.
- Gillison ML, et al: Epidemiología del carcinoma de células escamosas de cabeza y cuello positivo para el virus del papiloma humano. J Clin Oncol 2015; 33: 3235-3242.
- Moore EJ, Janus J, Kasperbauer J: Cirugía robótica transoral de la orofaringe: Consideraciones clínicas y anatómicas. Clin. Anat. 2012; 25: 135-141.
- Weiss BG, et al: Microcirugía transoral con láser para el tratamiento del cáncer hipofaríngeo en 211 pacientes. Head Neck 2017; 39: 1631-1638.
- Gupta T, et al: Revisión sistemática y metaanálisis de la radioterapia de intensidad modulada frente a la radioterapia convencional bidimensional y/o tridimensional en el tratamiento con intención curativa del carcinoma de células escamosas de cabeza y cuello. PLoS One. 2018; 13. DOI:10.1371/journal.pone.0200137.
- Vermorken JB, Specenier P: Tratamiento óptimo del cáncer de cabeza y cuello recurrente/metastásico. Anales de Oncología. Oxford University Press, 2010. DOI:10.1093/annonc/mdq453.
- Vermorken JB, et al: Quimioterapia basada en platino más cetuximab en el cáncer de cabeza y cuello. N Engl J Med 2008; 359: 1116-1127.
- Saleh K, et al.: Nuevos avances en el tratamiento del cáncer de cabeza y cuello – Impacto del pembrolizumab. Ther. Clin. Gestión de riesgos 2018; 14: 295-303.
- Ferris RL, et al: Nivolumab para el carcinoma escamoso recurrente de cabeza y cuello. N Engl J Med 2016; 375: 1856-1867.
- Harrington KJ, et al: Nivolumab frente a terapia estándar de agente único a elección del investigador en carcinoma de células escamosas recurrente o metastásico de cabeza y cuello (CheckMate 141): resultados de calidad de vida relacionada con la salud de un ensayo aleatorizado de fase 3. Lancet Oncol 2017; 18: 1104-1115.
- Cohen EEW, et al: Pembrolizumab frente a metotrexato, docetaxel o cetuximab para el carcinoma de células escamosas de cabeza y cuello recurrente o metastásico (KEYNOTE-040): un estudio aleatorizado, abierto, de fase 3. Lancet 2019; 393: 156-167.
- Ferris RL, et al: Nivolumab frente a la elección del investigador en el carcinoma de células escamosas recurrente o metastásico de cabeza y cuello: actualización de la supervivencia a largo plazo a 2 años del CheckMate 141 con análisis según la expresión de PD-L1 del tumor. Oral Oncol 2018; 81: 45-51.
- Zandberg DP, et al: Durvalumab para el carcinoma de células escamosas de cabeza y cuello recurrente o metastásico: Resultados de un estudio de fase II de un solo brazo en pacientes con expresión de PD-L1 en células tumorales ≥25% que han progresado con quimioterapia basada en platino. Eur J Cancer 2019; 107: 142-152.
- Siu LL, et al: Safety and Efficacy of Durvalumab with or Without Tremelimumab in Patients with PD-L1-Low/Negative Recurrent or Metastatic HNSCC: The Phase 2 CONDOR Randomized Clinical Trial. JAMA Oncol 2019; 5: 195-203.
- Ferris RL, et al: Durvalumab con o sin tremelimumab en pacientes con carcinoma de células escamosas de cabeza y cuello recurrente o metastásico: EAGLE, un estudio de fase III aleatorizado y abierto. Ann Oncol 2020; 31: 942-950.
- Burtness B, et al: Pembrolizumab solo o con quimioterapia frente a cetuximab con quimioterapia para el carcinoma de células escamosas recurrente o metastásico de cabeza y cuello (KEYNOTE-048): un estudio aleatorizado, abierto, de fase 3. Lancet 2019; 394: 1915-1928.
- Burtness B, et al: Resumen LB-258: Eficacia del pembrolizumab de primera línea (1L) según la puntuación positiva combinada de PD-L1 <1, 1-19 y ≥20 en el carcinoma de células escamosas de cabeza y cuello (CECC) recurrente y/o metastásico (R/M): Análisis de subgrupos de KEYNOTE-048. Investigación sobre el cáncer. Asociación Americana para la Investigación del Cáncer (AACR), 2020.
- Matlung SE, et al.: Diferencias en los infiltrados de células T y la supervivencia entre el carcinoma orofaríngeo de células escamosas VPH+ y VPH-. Futur. Sci. OA. 2016; 2. DOI:10.4155/fso.15.88.
- Bauml J, et al: Pembrolizumab para el cáncer de cabeza y cuello resistente al platino y al cetuximab: resultados de un estudio de fase II de un solo brazo. J Clin Oncol 2017; 35: 1542-9.
- Wang J, et al: El estado positivo al VPH se asocia con un microambiente inmunitario inflamado y una mejor respuesta a la terapia anti-PD-1 en el carcinoma de células escamosas de cabeza y cuello. Sci Rep 2019; 9. DOI:10.1038/s41598-019-49771-0.
- Xu Y, et al.: Programmed Death-1/Programmed Death-Ligand 1-Axis Blockade in Recurrent or Metastatic Head and Neck Squamous Cell Carcinoma Stratified by Human Papillomavirus Status: A Systematic Review and Meta-Analysis. Front Immunol 2021; 12. DOI:10.3389/fimmu.2021.645170.
- Cohen EEW, et al: Declaración de consenso de la Sociedad para la Inmunoterapia del Cáncer sobre la inmunoterapia para el tratamiento del carcinoma de células escamosas de cabeza y cuello (HNSCC). J Immunother Cancer 2019; 7. DOI:10.1186/s40425-019-0662-5.
- Braakhuis BJM, Brakenhoff RH, René Leemans C: Elección del tratamiento para los cánceres de cabeza y cuello localmente avanzados en función de los factores de riesgo: Factores de riesgo biológicos. Ann Oncol 2012; 23. DOI:10.1093/annonc/mds299.
- Brana I, Siu LL: Cáncer de células escamosas de cabeza y cuello localmente avanzado: elección del tratamiento en función de los factores de riesgo y optimización de la prescripción de fármacos. Ann Oncol 2012; 23. DOI:10.1093/annonc/mds322.
- Cooper JS, et al: Radioterapia y quimioterapia concurrentes postoperatorias para el carcinoma escamoso de alto riesgo de cabeza y cuello. N Engl J Med 2004; 350: 1937-1944.
- Bernier J, et al: Irradiación postoperatoria con o sin quimioterapia concomitante para el cáncer de cabeza y cuello localmente avanzado. N Engl J Med 2004; 350: 1945-1952.
- Pignon JP, et al: Metaanálisis de la quimioterapia en el cáncer de cabeza y cuello (MACH-NC): una actualización de 93 ensayos aleatorizados y 17.346 pacientes. Radioterapia Oncol 2009; 92: 4-14.
- Adelstein D, et al: NCCN guidelines® insights head and neck cancers, version 2.2017 actualizaciones destacadas de las directrices de la NCCN. JNCCN J Natl Compr Cancer Netw 2017; 15: 761-770.
- Adelstein DJ, et al: Una comparación intergrupal de fase III de la radioterapia estándar y dos programas de quimiorradioterapia concurrente en pacientes con cáncer escamoso de cabeza y cuello irresecable. J Clin Oncol 2003; 21: 92-98.
- Mohamed A, et al: Quimiorradioterapia concurrente con cisplatino semanal frente a quimiorradioterapia tri semanal en el carcinoma de células escamosas localmente avanzado de cabeza y cuello: Análisis comparativo. Cabeza Cuello. 2019; 41: 1490-1498.
- Helfenstein S, et al: Cisplatino cada 3 semanas o cada semana simultáneamente con radioterapia para pacientes con carcinoma de células escamosas de cabeza y cuello – Un análisis multicéntrico y retrospectivo. Radiat Oncol 2019; 14. DOI:10.1186/s13014-019-1235-y.
- Bonner JA, et al: Radioterapia más cetuximab para el cáncer de cabeza y cuello locorregionalmente avanzado: datos de supervivencia a 5 años de un ensayo aleatorizado de fase 3 y relación entre la erupción inducida por el cetuximab y la supervivencia. Lancet Oncol 2010; 11: 21-28.
- Mehanna H, et al: Radioterapia más cisplatino o cetuximab en el cáncer de orofaringe de bajo riesgo positivo al virus del papiloma humano (De-ESCALaTE VPH): un ensayo de fase 3 aleatorizado y controlado abierto. Lancet 2019; 393: 51-60.
- Gillison ML, et al: Radioterapia más cetuximab o cisplatino en el cáncer de orofaringe positivo al virus del papiloma humano (NRG Oncology RTOG 1016): un ensayo aleatorizado, multicéntrico y de no inferioridad. Lancet 2019; 393: 40-50.
- Bourhis J, et al: TrilynX: Un ensayo de fase 3 de xevinapant y quimiorradiación concurrente para el cáncer de cabeza y cuello localmente avanzado. J Clin Oncol 2021; 39: TPS6091-TPS6091.
- Yu Y, Lee NY: JAVELIN Head and Neck 100: Un ensayo de fase III de avelumab y quimiorradiación para el cáncer de cabeza y cuello localmente avanzado. Futur Oncol 2019; 15: 687-694.
- Cohen EE, et al.: Primary results of the phase III JAVELIN head & neck 100 trial: Avelumab plus chemoradiotherapy (CRT) followed by avelumab maintenance vs CRT in patients with locally advanced squamous cell carcinoma of the head and neck (LA SCCHN). Congreso de la ESMO 2020: Anales de Oncología (2020) 31 (suppl_4): S599-S628.
- Topalian SL, Taube JM, Pardoll DM: Bloqueo neoadyuvante de puntos de control para la inmunoterapia del cáncer. Ciencia 2020; 367. DOI:10.1126/science.aax0182.
- Rothschild SI, et al: SAKK 16/14: Durvalumab in Addition to Neoadjuvant Chemotherapy in Patients With Stage IIIA(N2) Non-Small-Cell Lung Cancer-A Multicenter Single-Arm Phase II Trial. J Clin Oncol 2021; 39: 2872-2880.
- Friedman J, et al: El bloqueo neoadyuvante del punto de control inmunitario PD-1 invierte la inmunodominancia funcional entre las células T específicas de antígenos tumorales. Clin Cancer Res 2020; 26: 679-689.
- Schoenfeld JD, et al: Nivolumab neoadyuvante o nivolumab más ipilimumab en el carcinoma de células escamosas de la cavidad oral no tratado: un ensayo clínico aleatorizado abierto de fase 2. JAMA Oncol 2020; 6: 1563-1570.
- Ferrarotto R, et al.: Impacto del durvalumab neoadyuvante con o sin tremelimumab en la densidad de linfocitos tumorales CD8+, la seguridad y la eficacia en pacientes con cáncer de orofaringe: resultados del ensayo CIAO. Clin Cancer Res 2020; 26: 3211-3219.
- Vos JL, et al: La inmunoterapia neoadyuvante con nivolumab e ipilimumab induce respuestas patológicas importantes en pacientes con carcinoma de células escamosas de cabeza y cuello. Nat Commun 2021; 12. DOI:10.1038/s41467-021-26472-9.
- Ferris RL, et al: Nivolumab neoadyuvante para pacientes con carcinomas de células escamosas de cabeza y cuello resecables VPH-positivos y VPH-negativos en el ensayo CheckMate 358. J Immunother Cancer 2021; 9. DOI:10.1136/jitc-2021-002568.
- Merlino DJ, et al: Respuestas discordantes entre tumores primarios de cabeza y cuello y metástasis ganglionares tratados con nivolumab neoadyuvante: correlación del efecto radiográfico y patológico del tratamiento. Front Oncol 2020; 10. DOI:10.3389/fonc.2020.566315.
- Xiong Y, et al: Efectos inmunológicos de la inmunoterapia con nivolumab en pacientes con carcinoma de células escamosas de la cavidad oral. BMC Cancer 2020; 20. DOI: 10.1186/s12885-020-06726-3.
- Uppaluri R, et al: Pembrolizumab neoadyuvante y adyuvante en cáncer de cabeza y cuello resecable localmente avanzado y no relacionado con el virus del papiloma humano: un ensayo multicéntrico de fase II. Clin Cancer Res 2020; 26: 5140-52.
- Yan Y, et al.: Combinación de inhibidores del punto de control inmunitario con la terapia convencional del cáncer. Frente. Immunol. 2018; 9. DOI:10.3389/fimmu.2018.01739.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2022; 10(1): 5-11