Existen varias opciones de tratamiento nuevas para el cáncer de mama metastásico HR-positivo. El objetivo de la conferencia anual de oncología de St. ¿Cómo podría ser un algoritmo terapéutico moderno?
“Cuando hablamos de nuevas terapias en este ámbito, nos referimos principalmente al everolimus (Afinitor®), el palbociclib (Ibrance®), el ribociclib (Kisqali®) y el abemaciclib (aún no aprobado en Suiza); en cierta medida también al fulvestrant, que apareció en el mercado a principios de la década de 2000″, afirma la Dra. Müller. “Los estudios sobre los inhibidores de la aromatasa letrozol y anastrozol ejemplifican lo que conseguimos con los fármacos más antiguos en el ámbito posmenopáusico de primera línea: En comparación con el tamoxifeno, prolongaron significativamente la supervivencia sin progresión y dieron lugar a una respuesta comparable o superior [1–3].”
En el ensayo FALCON [4], el fulvestrant demostró ser superior al anastrozol en primera línea. Después de unos seis meses, las curvas de SLP divergieron. La respuesta fue comparable. Un análisis de subgrupos mostró que las pacientes sin afectación visceral en particular vivían más tiempo sin progresión (HR 0,59), mientras que las que tenían afectación visceral no se beneficiaban del anastrozol (HR 0,99).
Actualmente, la terapia endocrina es la opción preferida para los carcinomas de mama avanzados con receptores de estrógenos positivos, incluso para las metástasis viscerales (sólo no en casos de “crisis visceral” o sospecha de resistencia endocrina – para estos casos, debe optarse por la quimioterapia primaria). Pero, ¿qué sustancias activas y combinaciones se prefieren en la terapia endocrina moderna?
Problema: Resistencia
“El desarrollo de resistencia a las terapias endocrinas es inevitable en la situación metastásica”, afirmó la ponente. Se habla de “resistencia primaria” si el tumor progresa en menos de medio año bajo terapia endocrina, mientras que se habla de “resistencia secundaria” si progresa sólo después de este periodo. Esto se aplica a la situación metastásica primaria.
En la situación adyuvante inicial, “principalmente resistente” significa una recaída temprana hasta dos años después del inicio de la terapia endocrina adyuvante. “Secundariamente resistentes” son los tumores que recidivan sólo después de dos a unos seis años (bajo terapia adyuvante prolongada), y “sensibles” son los que recidivan sólo al menos un año después del final de la terapia adyuvante.
Los mecanismos de resistencia son múltiples. Por ejemplo, son frecuentes las mutaciones del RE (mutación activadora ESR-1). Son adquiridas, se dan en el 15-30% de las tratadas previamente con terapia endocrina y provocan resistencia al tamoxifeno, a los inhibidores de la aromatasa y al fulvestrant (posiblemente no al fulvestrant-HD [5]). Otros mecanismos de resistencia incluyen vías de transducción de señales de derivación celular.
Solución: Nuevas sustancias activas
Para algunas de estas vías de derivación, ya están disponibles los nuevos fármacos mencionados anteriormente.
El everolimus, por ejemplo, se dirige a la derivación a través de la vía PI3K/AKT/mTOR mediante la inhibición de mTOR. Como serina-treonina quinasa, la mTOR tiene una función clave en esta vía de señalización, que se sabe que está alterada en muchos tumores malignos humanos. BOLERO-2 [6] mostró una superioridad significativa en el criterio de valoración primario de la SLP en el contexto de segunda línea en combinación con exemestano en comparación con el exemestano solo. Las curvas divergieron al cabo de un mes y medio y la respuesta también reflejó el beneficio. No se pudo demostrar ningún efecto significativo en el criterio de valoración secundario, la supervivencia global, aunque, por supuesto, el estudio estaba potenciado principalmente para la SLP. Una toxicidad molesta y común del fármaco es la estomatitis, que -como demostró el ensayo SWISH- puede controlarse al menos hasta cierto punto con un enjuague bucal de dexametasona cuatro veces al día. Además, puede producirse neumonitis, lo que requiere una interrupción de la terapia en caso de síntomas moderados y graves. En general, la calidad de vida no parece verse afectada de forma relevante por el principio activo, pero no parece mejorar en comparación con el exemestano solo.
Otro modo de acción es la inhibición CDK4/6. El complejo ciclina D-CDK4/6 regula la progresión del ciclo celular a través de la fosforilación de la proteína retinoblastoma (Rb). La resistencia endocrina está asociada a la expresión persistente de ciclina D y a la fosforilación de Rb. Los inhibidores selectivos de la cinasa CDK4/CDK6 se dirigen precisamente a este punto. En el ensayo PALOMA-3 [7], que se presentó en ASCO 2015 y en otros lugares, el palbociclib demostró ser superior al fulvestrant solo en el contexto de segunda línea en combinación con fulvestrant. También en este caso, las curvas de SLP se separaron muy pronto (después de un mes y medio aproximadamente). Si nos fijamos en la toxicidad, el perfil con neutropenia y alopecia puede recordar al principio a la quimioterapia. “Sin embargo, la alopecia es casi siempre de grado 1 y la neutropenia es claramente diferente de la que se produce con la quimioterapia”, explicó el ponente. Las células madre hematopoyéticas y los progenitores tempranos de neutrófilos dependen de la actividad de la ciclina D-CDK4/6 para entrar, progresar y proliferar en el ciclo celular. Mientras que con los inhibidores de la quinasa CDK4/CDK6, la neutropenia resulta así de la detención del ciclo celular y, por tanto, la recuperación suele ser rápida en el curso (no acumulativa), el daño del ADN y la apoptosis de los precursores proliferantes en la quimioterapia conducen a una recuperación retardada. Las neutropenias de grado 3/4 con palbociclib son controlables en la medida en que más de dos tercios de los acontecimientos se producen en el primer ciclo, y tras la reducción de la dosis el riesgo de neutropenias graves es bajo [8].
¿Y la primera línea?
MONALEESA-2 [9] demostró la superioridad de ribociclib con letrozol sobre el letrozol solo en el contexto de primera línea (reducción del riesgo en el criterio de valoración primario SLP de más del 40% y mejora de la respuesta). Los resultados fueron flanqueados por PALOMA-2 (palbociclib) [10] y MONARCH-3 (abemaciclib) [11] – el efecto de los diferentes inhibidores de la cinasa CDK4/CDK6 es comparable. Las diferencias se observan principalmente en el perfil de toxicidad. Los acontecimientos adversos graves más frecuentes fueron neutropenia en PALOMA-2 y MONALEESA-2, junto con alopecia, fatiga y anemia en palbociclib y, además, náuseas en ribociclib. En MONARCH-3, se trataba principalmente de diarrea, junto con fatiga y también neutropenia y alopecia.
“Los análisis de subgrupos correspondientes muestran que hasta ahora no se ha podido identificar ningún grupo de pacientes clínico o molecular claro que no se beneficie de los nuevos fármacos. Así que tampoco existen aún biomarcadores predictivos establecidos”, explicó el Dr. Müller. “La eficacia parece ser la misma en las mujeres mayores de 70 años. La tolerabilidad es, sin embargo, -como era de esperar- significativamente peor aquí”. La calidad de vida con palbociclib en primera línea no es peor, pero tampoco mejor que con letrozol solo [12]. En segunda línea, sin embargo, la combinación con el inhibidor CDK4/6 es superior a la monoterapia con fulvestrant en términos de calidad de vida [13].
¿Cómo decidir?
Además de biomarcadores válidos, en el momento de la presentación aún faltaban datos de SG con una potencia adecuada sobre los nuevos agentes dirigidos en el cáncer de mama metastásico con receptores hormonales positivos, así como estudios sobre la secuencia óptima.
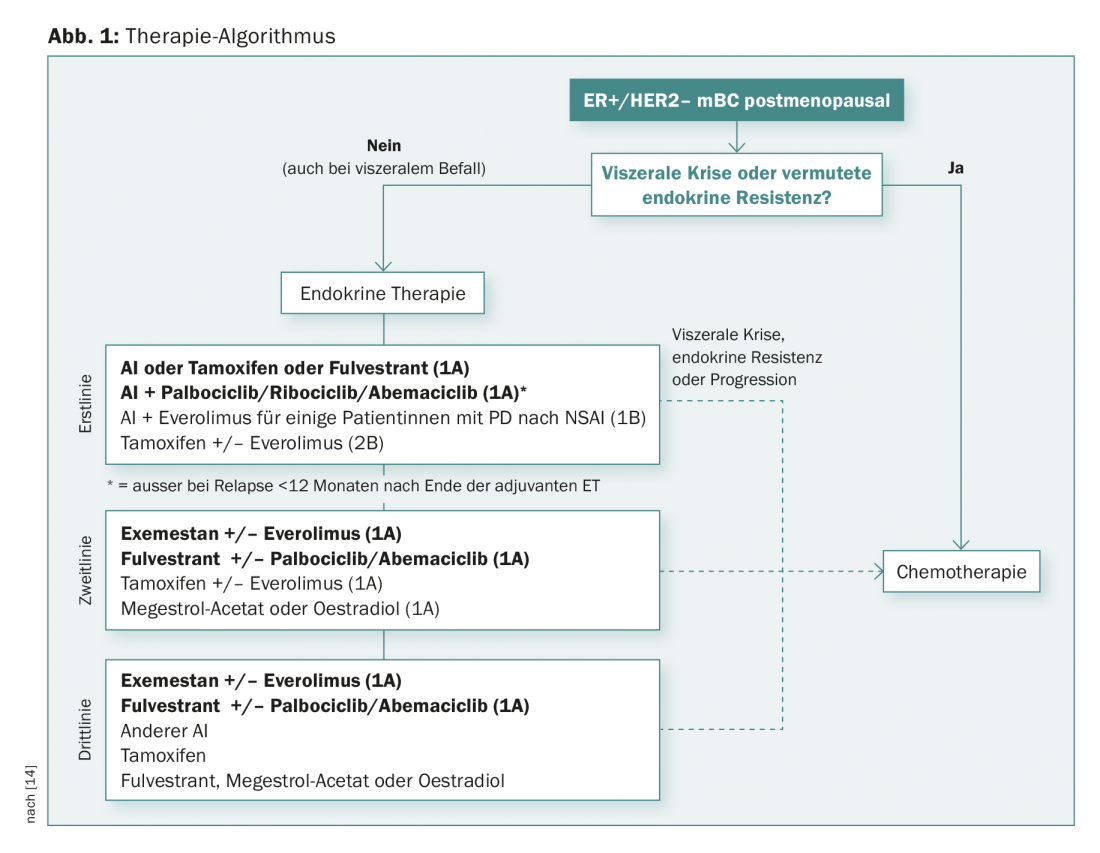
En la figura 1 se muestra un posible algoritmo para pacientes posmenopáusicas con enfermedad metastásica ER+/HER2-. “La terapia endocrina sola es una buena opción en la presión de remisión baja. La combinación con la inhibición de CDK4/CDK6 es eficaz en primera línea y también posteriormente. Es una opción importante en la presión de remisión (aunque también en los ancianos con más toxicidad). El everolimus y el exemestano son eficaces tras el fracaso de la terapia endocrina. Eficaz” con las nuevas sustancias sigue significando actualmente una mejora de la SLP y de la respuesta (y aún no de la SG)”, resumió el Dr. Müller.
Fuente: 28º Curso de formación continua para médicos sobre oncología clínica, 22-24 de febrero de 2018, St.
Literatura:
- Mouridsen H, et al: Estudio de fase III de letrozol frente a tamoxifeno como tratamiento de primera línea del cáncer de mama avanzado en mujeres posmenopáusicas: análisis de la supervivencia y actualización de la eficacia del Grupo Internacional de Letrozol para el Cáncer de Mama. J Clin Oncol 2003 Jun 1; 21(11): 2101-2109.
- Nabholtz JM, et al: Anastrozol (Arimidex) frente a tamoxifeno como terapia de primera línea para el cáncer de mama avanzado en mujeres posmenopáusicas: análisis de supervivencia y resultados de seguridad actualizados. Eur J Cancer 2003 Ago; 39(12): 1684-1689.
- Nabholtz JM, et al: El anastrozol es superior al tamoxifeno como terapia de primera línea para el cáncer de mama avanzado en mujeres posmenopáusicas: resultados de un ensayo aleatorizado multicéntrico norteamericano. Grupo de estudio de Arimidex. J Clin Oncol 2000 Nov 15; 18(22): 3758-3767.
- Robertson JFR, et al: Fulvestrant 500 mg frente a anastrozol 1 mg para el cáncer de mama avanzado con receptores hormonales positivos (FALCON): un ensayo internacional, aleatorizado, doble ciego, de fase 3. Lancet 2016 dic 17; 388(10063): 2997-3005.
- Fribbens C, et al: Mutaciones plasmáticas de ESR1 y el tratamiento del cáncer de mama avanzado con receptores de estrógeno positivos. J Clin Oncol 2016 Sep 1; 34(25): 2961-2968.
- Baselga J, et al: Everolimus en el cáncer de mama avanzado posmenopáusico con receptores hormonales positivos. N Engl J Med 2012 Feb 9; 366(6): 520-529.
- Cristofanilli M, et al: Fulvestrant más palbociclib frente a fulvestrant más placebo para el tratamiento del cáncer de mama metastásico con receptores hormonales positivos y HER2 negativo que ha progresado con la terapia endocrina previa (PALOMA-3): análisis final del ensayo controlado aleatorizado multicéntrico, doble ciego, de fase 3. Lancet Oncol 2016; 17(4): 425-439.
- Verma S, et al: Palbociclib en combinación con fulvestrant en mujeres con cáncer de mama metastásico avanzado receptor hormonal positivo/HER2 negativo: Análisis detallado de seguridad de un estudio multicéntrico, aleatorizado, controlado con placebo, de fase III (PALOMA-3). Oncologist 2016 Oct; 21(10): 1165-1175.
- Hortobagyi GN, et al: Ribociclib como terapia de primera línea para el cáncer de mama avanzado HR-positivo. N Engl J Med 2016; 375: 1738-1748.
- Finn RS, et al: Palbociclib y letrozol en el cáncer de mama avanzado. N Engl J Med 2016 Nov 17; 375(20): 1925-1936.
- Goetz MP, et al: MONARCH 3: Abemaciclib como terapia inicial para el cáncer de mama avanzado. J Clin Oncol 2017 Nov 10; 35(32): 3638-3646.
- Rugo HS, et al: Impacto de palbociclib más letrozol en la calidad de vida relacionada con la salud comunicada por las pacientes: resultados del ensayo PALOMA-2. Ann Oncol 2018 Ene 19. doi: 10.1093/annonc/mdy012 [Epub ahead of print].
- Harbeck N, et al: Calidad de vida con palbociclib más fulvestrant en cáncer de mama metastásico con receptores hormonales positivos y HER2 negativo previamente tratado: resultados comunicados por las pacientes del ensayo PALOMA-3. Ann Oncol 2016 Jun; 27(6): 1047-1054.
- Cardoso F, et al: 3ª Guía de consenso internacional ESO-ESMO para el cáncer de mama avanzado (ABC 3). Ann Oncol 2017 Jan 1; 28(1): 16-33.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2018; 6(2): 38-40.