Los carcinomas bronquiales son la causa más común de muertes relacionadas con el cáncer en todo el mundo. Con el desarrollo de los inhibidores de los puntos de control inmunitarios, el panorama terapéutico ha cambiado significativamente.
El diagnóstico y la terapia del carcinoma bronquial es un campo en rápida evolución y de considerable interés clínico debido a la elevada incidencia y mortalidad de estos tumores en todo el mundo. El rápido aumento de los conocimientos en biología molecular e inmunología y los avances en el diagnóstico molecular son factores impulsores del desarrollo del tratamiento personalizado de los tumores (“medicina de precisión”). Este desarrollo dista mucho de haberse completado.
En este artículo nos centramos en las innovaciones actuales en el tratamiento del carcinoma bronquial, haciendo hincapié en la terapia sistémica de los estadios avanzados del tumor en la primera línea de tratamiento. Se trata de enfoques de tratamiento que estamos aplicando actualmente en nuestra institución. No pretendemos ser completos ni tener una validez absoluta.
Conceptos básicos
En 2018, los carcinomas bronquiales tuvieron la mayor incidencia (11,6%) y la mayor mortalidad (18,4%) de todas las enfermedades tumorales del mundo, al mismo nivel que los tumores de mama [1]. En el periodo de 2011 a 2015, los carcinomas bronquiales ocuparon el tercer lugar en Suiza en términos de incidencia (aproximadamente 4300 nuevos casos al año), y el primer lugar entre las causas de muerte relacionadas con el cáncer [2]. La tasa relativa de supervivencia a 5 años del cáncer de pulmón en Suiza fue del 15% para los hombres y del 19% para las mujeres [3]. El tabaquismo sigue siendo la principal causa de cáncer de pulmón [4]. Alrededor del 20% de los carcinomas bronquiales se producen en “nunca fumadores” (<100 cigarrillos en total). La razón principal es la exposición a sustancias nocivas inhaladas (por ejemplo, radón, amianto, vapor de alquitrán) [5].
Carcinoma pulmonar de células pequeñas
El 10-15% de los carcinomas bronquiales de nuevo diagnóstico son cánceres de pulmón de células pequeñas (CPCP). Terapéuticamente relevante es la distinción entre enfermedad limitada LD (estadio I-III) y enfermedad extensa ED (estadio IV). Esta última es mucho más frecuente debido a la agresiva biología del tumor. La mediana de supervivencia global (SG) es de 15-20 meses para el LD-SCLC y de 8-13 meses para el ED-SCLC [6]. La mayoría de los CPCP presentan mutaciones inactivadoras de los genes supresores de tumores TP53 y RB1, mientras que las mutaciones “tratables” de los receptores tirosina quinasas suelen estar ausentes (en contraste con los carcinomas pulmonares no microcíticos, CPNM). Las normas actuales de la terapia dependiente de la etapa pueden resumirse como sigue:
Estadio I: Además de la cirugía, la quimioterapia adyuvante basada en platino proporciona un beneficio de SG en el estadio I (66,0 frente a 42,1 meses) [7].
Estadios II, III: La cirugía más quimioterapia es una opción en el estadio II; alternativamente, puede omitirse la cirugía y administrarse radioquimioterapia definitiva. Éste es también el tratamiento de elección en el estadio III y debe realizarse -si es posible- simultáneamente [8,9].
Estadio IV: La terapia sistémica paliativa es el tratamiento de elección para el ED-SCLC. A pesar de una respuesta inicial muy buena a la terapia, la mediana de supervivencia global es de sólo 10 meses. Los protocolos estándar son cisplatino y etopósido o carboplatino y etopósido [10]. Los protocolos difieren principalmente en cuanto a los efectos secundarios, menos en cuanto al efecto tumoral [11]. La radiación del tumor residual torácico no es una norma, sino una opción individual en caso de muy buena respuesta a la quimioterapia, así como de remisión completa de las metástasis extratorácicas [12].
El atezolizumab, un inhibidor del ligando 1 de la muerte programada (PD-L1) (inhibidor del punto de control inmunitario, ICI), combinado con quimioterapia y utilizado posteriormente como terapia de mantenimiento, proporciona un beneficio de supervivencia en la primera línea de tratamiento en comparación con la quimioterapia sola (12,3 frente a 10,3 meses, HR 0,7; IC del 95%: 0,54-0,91), como se demostró en el ensayo de fase III IMpower133. [13]. El ensayo de fase III CASPIAN con durvalumab y quimioterapia también fue positivo, como informó recientemente el fabricante [14]. Así pues, el ED-SCLC dispone ahora de dos nuevos enfoques para la quimioinmunoterapia combinada, siempre que los preparados sigan estando aprobados por las autoridades farmacológicas para esta indicación.
La irradiación profiláctica de todo el cerebro (IPC) se considera “estándar” en muchas directrices en los estadios II-IV tras una buena respuesta a la quimioterapia [15,16]. Sin embargo, un estudio japonés cuestiona esta norma, ya que no mostró ningún beneficio para la supervivencia de la ICP en comparación con la resonancia magnética (RM) del cráneo sola [17]. Estos datos parecen conducir ya a un abandono parcial de la norma anterior en la práctica clínica diaria [18]. La influencia de la inmunoterapia en la indicación de la ICP aún no está clara.
Muchos pacientes con CPCP experimentan recurrencia o progresión en un plazo de 6 a 12 meses. La razón de ello es probablemente la presencia de “células madre cancerosas” resistentes al cisplatino [19]. El tratamiento posterior depende del estado de la paciente, la extensión de la recidiva tumoral, la terapia previa y el intervalo libre de tratamiento [15–17]. Si existe una situación refractaria o una recaída resistente al platino, el topotecán es superior a los cuidados de apoyo solos [20] y equivalente a la terapia múltiple (ciclofosfamida, doxorrubicina y vincristina) en términos de tasa de respuesta global (TRO), supervivencia sin progresión (SLP) y SG, pero mejor tolerada [21]. El topotecán administrado por vía intravenosa y peroral son aproximadamente equivalentes en términos de eficacia y tolerabilidad [22]. Los pacientes en buen estado general (ECOG 0-2) con una “recaída sensible al platino” pueden ser tratados de nuevo con cisplatino/carboplatino y etopósido [23].
En nuestra opinión, el uso de inhibidores de los puntos de control inmunitarios tras el fracaso de la quimioterapia no es (todavía) estándar hoy en día. Los mejores datos hasta la fecha son los del pembrolizumab (para tumores PDL1 positivos) [24] y los del nivolumab [25].
Cáncer de pulmón de células no pequeñas
El cáncer de pulmón de células no pequeñas (CPCNP, aproximadamente el 85-90% de todos los carcinomas bronquiales) es un término clínico colectivo que engloba los adenocarcinomas (50-60%), los carcinomas de células escamosas (20-25%), los carcinomas de células grandes, los carcinomas adenoescamosos, los carcinomas neuroendocrinos (de los que se excluye el carcinoma pulmonar de células pequeñas) y los carcinomas sarcomatoides.
Estadios I/II: La terapia de elección en los estadios I y II es la cirugía radical según los estándares oncológicos (normalmente una lobectomía con disección sistemática de los ganglios linfáticos mediastínicos). A partir de un diámetro tumoral de 4 cm, está indicada la quimioterapia adyuvante con 4 ciclos de una combinación que contenga platino. Si existe una contraindicación para la cirugía, la radiación estereotáctica es una alternativa.
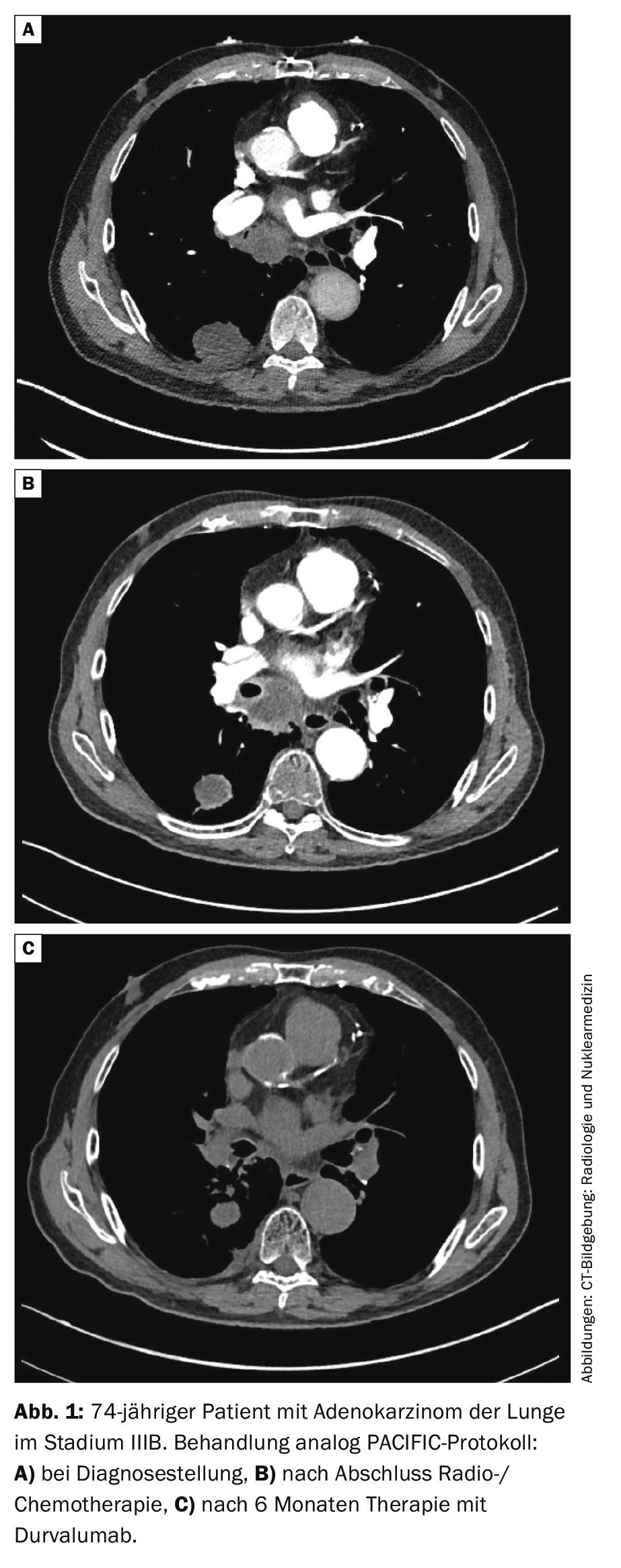
Estadio III: Para los tumores resecables en estadio III, está indicada la quimioterapia además de la cirugía. Puede realizarse antes (neoadyuvante) o después (adyuvante) de la cirugía. El beneficio de la radioterapia adicional (“terapia trimodal”) es controvertido. El ensayo suizo de fase III SAKK16/00 fue negativo con respecto a la irradiación preoperatoria [26]. La radioterapia postoperatoria (RTPO) no mostró ningún beneficio claro en un metaanálisis retrospectivo [27], aún están pendientes los datos del ensayo aleatorizado LungART. El CPNM no resecable en estadio III se somete a radioquimioterapia seguida de un año de inmunoterapia “consolidativa” con el anticuerpo PD-L1 durvalumab. La base es el estudio prospectivo aleatorizado de fase III PACIFIC [28, 29]. En el estudio, la supervivencia a 2 años fue del 66,3% con durvalumab y del 55,6% con placebo (HR 0,68; IC del 99,73%: 0,47-0,997; p=0,0025). La mediana de la SLP se prolongó significativamente con durvalumab en comparación con placebo (17,2 frente a 5,6 meses, HR 0,51, IC 95% 0,41-0,63, p<0,001). Por ello, la consolidación con durvalumab se considera hoy en día la norma (Fig. 1).
Estadio IV: Aparte de los estadios denominados “oligometastásicos”, en los que la cirugía y la radioterapia pueden utilizarse con intención curativa, la mayoría de los CPNM en estadio IV se tratan con intención puramente paliativa. Se distingue entre quimioterapia, terapia dirigida e inmunoterapia. La elección de la terapia depende del subtipo histológico, de la presencia de mutaciones driver (en tumores no escamosos) y de la expresión de PD-L1 del tumor. El estudio patológico molecular es la base para una terapia óptima (Fig. 2).
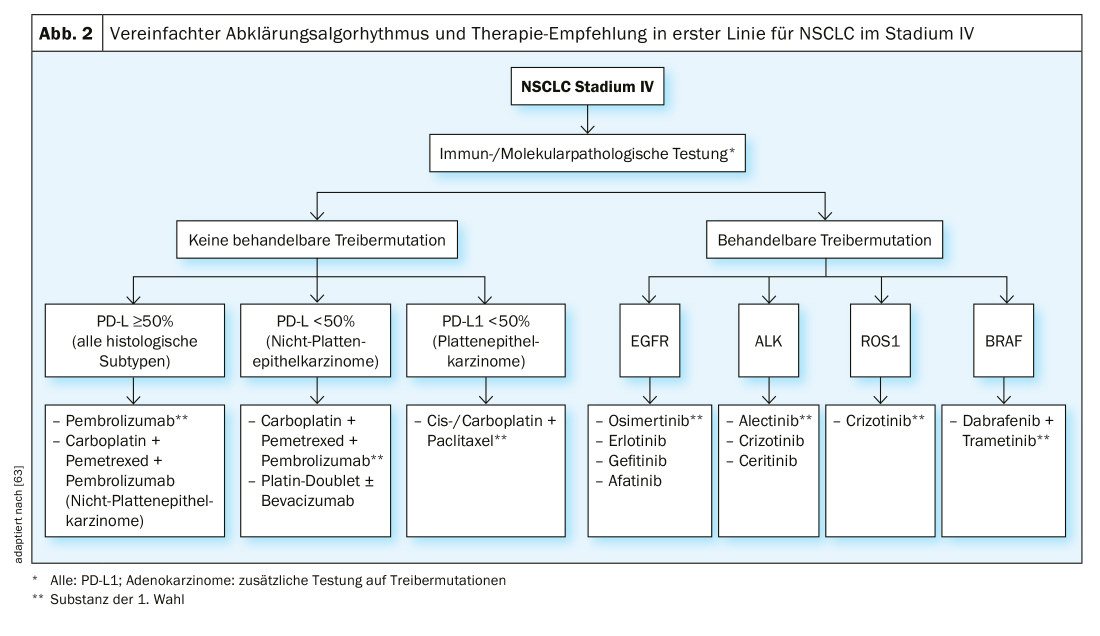
Si no hay “mutaciones conductoras” tratables, el tratamiento se basa principalmente en el estado de expresión de PD-L1. Para el CPNM (independientemente del subtipo histológico) con una expresión de PD-L1 ≥50%, el tratamiento con el inhibidor de PD-L1 pembrolizumab es superior a la quimioterapia convencional en términos de SG y SLP según el estudio KEYNOTE 024 [30]. Para los adenocarcinomas de pulmón con una expresión de PD-L1 ≤ 50%, una combinación de quimioterapia y pembrolizumab es preferible a la quimioterapia sola, de forma análoga al estudio KEYNOTE 189 [31]. La tasa de respuesta al tratamiento en el estudio con la adición de pembrolizumab fue del 48%, sin pembrolizumab del 19%. La tasa de supervivencia a los 12 meses fue del 69% para pembrolizumab + quimioterapia y del 49% para el grupo de quimioterapia sola. Una alternativa es el anticuerpo PD-L1 atezolizumab en combinación con carboplatino, paclitaxel y bevacizumab, según los resultados de los ensayos IMpower130 y -150 [32,33].
En el caso de los carcinomas de células escamosas con una expresión de PD-L1 ≤50%, la combinación de pembrolizumab con quimioterapia se asocia a un beneficio de SG y SLP según el estudio KEYNOTE 407 [34].
Si no se utilizó ningún inhibidor de los puntos de control inmunitarios en la primera línea de tratamiento, su uso está indicado en la segunda línea. El uso de nivolumab se asocia a un beneficio estadísticamente significativo de la ORR, la SG y la SLP en comparación con el docetaxel, independientemente de la expresión de PD-L1 en las células tumorales [35].
El tratamiento de segunda línea con atezolizumab se comparó con el docetaxel, y se halló un beneficio en la SG a favor del atezolizumab independientemente de la histología del CPNM [36,37]. El pembrolizumab se estudió en tumores con una expresión de PD-L1 de al menos el 1%, mostrando un beneficio significativo en la SG frente al docetaxel [38]. El tratamiento con inhibidores de los puntos de control inmunitarios debe administrarse mientras se demuestre una respuesta o mientras el paciente tolere el tratamiento sin efectos secundarios graves.
Mutaciones del conductor: En un número significativo de CPNM, se encuentra una mutación de un protooncogén a un oncogén, que codifica para un receptor tirosina quinasa (RTK) activador. Esta mutación provoca un aumento de la proliferación celular, resistencia a la apoptosis, angiogénesis y metástasis. Tales mutaciones se denominan mutaciones impulsoras. Suelen ser mutaciones somáticas y no mutaciones de la línea germinal [39]. Estos hallazgos condujeron al desarrollo de los inhibidores orales de la tirosina cinasa (ITC), cuyo efecto se basa en una inhibición más o menos selectiva de la vía de transducción de señales correspondiente. Teniendo en cuenta la probabilidad previa a la prueba, las pruebas para detectar la presencia de mutaciones son actualmente obligatorias para el CPNM no escamoso en estadio IV, pero no para el carcinoma de células escamosas y el CPCP. Debido a las limitaciones de tiempo, en nuestra institución realizamos las pruebas en dos pasos. El primer paso incluye pruebas rápidas para EGFR, ALK, ROS1, KRAS y BRAF. Si es negativo, en un segundo paso analizamos HER2, MET, RET, NTRK1-3 y otros marcadores. A continuación, analizaremos el tratamiento dirigido del CPNM en estadio IV con mutaciones impulsoras clásicas.
EGFR: Las mutaciones activadoras del protooncogen “receptor del factor de crecimiento epidérmico” (EGFR) se encuentran en el 13-15% de los adenocarcinomas pulmonares en Europa Central, agrupados en no fumadores (prevalencia superior al 50% según el estudio) [40]. Alrededor del 90% de los casos son una deleción del exón 19 o una mutación puntual del exón 21 L858R [41]. La terapia estándar en primera línea es un TKI del EGFR. Esta terapia se asocia a un beneficio estadísticamente significativo en la SLP en comparación con la quimioterapia basada en platino [42]. Los TKI disponibles son gefitinib y erlotinib (primera generación), afatinib y dacomtinib (segunda generación) y osimertinib (tercera generación). Con los TKI del EGFR de primera generación, la resistencia al tratamiento se produce por término medio al cabo de 10-14 meses, en el 50-60% de los casos debido a una segunda mutación del EGFR (T790M) [43]. El osimertinib, un TKI con buena disponibilidad en el SNC y eficacia en presencia de una mutación EGFR T790M, se evaluó frente al gefitinib y el erlotinib en el ensayo FLAURA. Los datos publicados en 2017 demostraron un beneficio estadísticamente significativo de la SLP a favor del osimertinib (18,9 meses con osimertinib frente a 10,2 meses con gefitinib y erlotinib, respectivamente, (HR 0,46; IC 95% 0,37-0,57; p<0,001) [44]. El osimertinib ha demostrado ser más eficaz contra las metástasis cerebrales y mejor tolerado. Los últimos datos del ensayo FLAURA, que se presentarán en el Congreso Anual de la ESMO 2019 en septiembre, muestran por primera vez un beneficio de supervivencia estadísticamente significativo del osimertinib después de [45]. Así pues, el osimertinib se establecerá definitivamente como terapia de primera línea para todos los pacientes con CPNM con mutación del EGFR, independientemente de la T790M o de las metástasis cerebrales. La combinación de un TKI del EGFR con quimioterapia principalmente en el CPNM con mutación del EGFR no se considera actualmente estándar, pero se ha investigado en varios estudios. El ensayo japonés de fase III NEJ009 comparó gefitinib con gefitinib + quimioterapia (carboplatino y pemetrexed), mostrando un beneficio estadísticamente significativo en la SLP (21 frente a 11 meses; CRI 0,49; IC 95%: 0,39-0,63) y en la SG (52 frente a 39 meses; CRI 0,70; IC 95%: 0,52-0,93), pero acompañado de una tasa más elevada de casos grado 3 Toxicidad (65% frente a 31%) [46]. Otros estudios (con erlotinib y gefitinib) confirman estos resultados. La combinación del TKI del EGFR erlotinib con el anticuerpo del VEGFR bevacizumab produjo un beneficio en la SLP pero no en la SG en comparación con la monoterapia con erlotinib [47].
ALK: Las translocaciones del protooncogen de la quinasa del linfoma anaplásico (ALK) se encuentran en el 3-5% de los adenocarcinomas pulmonares [48], de nuevo agrupadas en no fumadores [49]. Los ALK-TKI disponibles son crizotinib, ceritinib, alectinib, brigatinib y lorlatininb. El agente de primera línea de elección es el alectinib, debido a su buena movilidad en el SNC y a su superioridad frente al crizotinib en el estudio ALEX [50,51]. La elección de los ALK-TKI en líneas posteriores depende en particular de la disponibilidad, la infestación cerebral y las mutaciones de resistencia [52].
ROS1: Las translocaciones del protooncogen ROS 1 (ROS1) se encuentran en el 1-2% de los adenocarcinomas pulmonares, también en los no fumadores. Debido a la similitud estructural de las quinasas ALK y ROS1, muchos inhibidores de ALK distintos del alectinib también son adecuados para inhibir ROS1. El tratamiento de los tumores de pulmón con mutación ROS1 con crizotinib es la terapia de elección [53]. El lorlatinib mostró una eficacia muy buena en un estudio de fase II, especialmente en casos de resistencia al crizotinib [54]. El ceritinib, el entrectinib y el repotrectinib son otros potentes inhibidores de ROS1.
BRAF: La mutación puntual BRAF se encuentra en el 1-2% de los adenocarcinomas pulmonares tanto en fumadores como en no fumadores. En aproximadamente dos tercios de los casos, está presente una mutación V600E típica y tratable. En este caso, el tratamiento combinado con dabrafenib y trametinib es la terapia de elección, tanto en los pacientes sin tratamiento como en los pretratados [55,56]. Sin embargo, el CPNM con BRAF V600E también responde a la quimioterapia y a la inmunoterapia. Para las mutaciones BRAF distintas de la V600E, actualmente no se recomienda la terapia dirigida fuera de los ensayos.
KRAS: Si está presente una mutación activadora del protooncogen Kirsten ras (KRAS), anteriormente estos CPNM no se consideraban específicamente tratables y se sometían a quimioinmunoterapia. El KRAS se analizó de todos modos porque un resultado positivo hacía superflua la búsqueda de otras mutaciones impulsoras. En 2019, se comunicaron los primeros resultados de un ensayo clínico con el inhibidor específico de KRAS G12C AMG510 [57]. Estos resultados son muy alentadores y ahora se están abriendo estudios de seguimiento en muchos centros para el reclutamiento de un gran número de pacientes. También se están desarrollando otros inhibidores de KRAS.
RET: Las translocaciones reordenadas durante la transfección (RET) se encuentran en aproximadamente el 1-2% de los adenocarcinomas pulmonares. Los TKI menos selectivos, como el cabozantinib, sí mostraron cierto efecto, aunque muy limitado en el tiempo [58]. Por lo tanto, los inhibidores de RET altamente selectivos como LOXO-292 y BLU-667 representan un gran avance en el tratamiento de los tumores de pulmón con mutación de RET. El LOXO-292 se está estudiando en el ensayo LIBRETTO-001 (NCT03157128). Los resultados iniciales mostraron una tasa de respuesta del 65%, con una tolerabilidad muy buena [59]. Los nuevos datos se presentarán en el congreso anual de la IASLC en septiembre de 2019. Entre los centros participantes se encuentran Lucerna (CH) y Colonia (DE). El inhibidor de RET BLU-667 se está estudiando en el ensayo ARROW (NCT03037385). La tasa de respuesta preprimaria fue del 56% [60]. Entre los centros participantes se encuentra Heidelberg (DE).
NTRK: Las fusiones de uno de los protooncogenes “receptor neurotrófico tirosina quinasa 1-3” (NTRK 1-3) se encuentran en el 1% de los CPNM. El inhibidor de TRK larotrectinib (LOXO-101) ha mostrado hasta ahora una ORR del 75% en ensayos de fase I-II con respuesta sostenida y muy buena tolerabilidad [61]. Hasta ahora aprobado en EE.UU., la aprobación para Europa y Suiza aún está pendiente. El entrectinib (RXDX-101), otro inhibidor de la TRK, mostró una ORR del 57% en tumores sólidos con fusión NTRK probada en el análisis combinado de tres estudios de fase I-II, con una tolerabilidad también muy buena [62].
Conclusión
Los avances actuales en inmunoterapia y terapia dirigida demuestran que el potencial de estos enfoques en el carcinoma bronquial está lejos de agotarse. El beneficio de estas terapias en la paliación es indiscutible y también se están realizando ensayos clínicos en la situación adyuvante. Independientemente de esto, también hay que redoblar los esfuerzos en los ámbitos de la prevención y la detección precoz para que pueda lograrse una disminución de los carcinomas bronquiales (especialmente de los estadios metastásicos).
Mensajes para llevarse a casa
- Los carcinomas bronquiales son la causa más común de muertes relacionadas con el cáncer en todo el mundo y el tabaquismo es la causa principal.
- El nuevo tratamiento estándar para el cáncer de pulmón de células pequeñas (CPCP) en estadio IV es la combinación de quimioterapia (carboplatino y
- etopósido) con el inhibidor del punto de control inmunitario atezolizumab.
- Los pacientes con cáncer de pulmón no microcítico (CPNM) en estadio III se benefician de la consolidación de la inmunoterapia con durvalumab tras la radio/quimioterapia definitiva.
- El análisis del CPNM no escamoso en estadio avanzado para detectar la presencia de mutaciones impulsoras (en avance EGFR, ALK, ROS1 y BRAF) y el nivel de expresión de PD-L1 está guiando la elección de la terapia.
- Los CPNM con mutaciones tratables se tratan principalmente como diana; el tratamiento de los CPNM sin evidencia de una mutación conductora tratable se basa principalmente en el estado de expresión de PD-L1.
Literatura:
- Bray F, et al: Estadísticas mundiales sobre el cáncer 2018: Estimaciones de GLOBOCAN sobre la incidencia y la mortalidad mundial de 36 tipos de cáncer en 185 países. CA Cancer J Clin, 2018. 68(6): p. 394-424.
- www.bfs.admin.ch/bfs/de/home/statistiken/kataloge-datenbanken/tabellen.assetdetail.6466432.html.
- Arndt V: Informe suizo sobre el cáncer 2015: situación y evolución. 2016: Oficina Federal de Estadística (OFS).
- Forman D, et al: La carga mundial y regional del cáncer. Informe mundial sobre el cáncer, 2014. 2014: 16-53.
- Sun S, Schiller JH, Gazdar AF: Cáncer de pulmón en nunca fumadores: una enfermedad diferente. Nat Rev Cancer, 2007. 7(10): 778-790.
- van Meerbeeck JP, Fennell DA, De Ruysscher DK: Cáncer de pulmón microcítico. Lancet, 2011. 378(9804): 1741-1755.
- Yang CF, et al: Papel de la terapia adyuvante en una cohorte poblacional de pacientes con cáncer de pulmón microcítico en estadio inicial. J Clin Oncol, 2016. 34(10): 1057-1064.
- Warde P, Payne D: ¿Mejora la irradiación torácica la supervivencia y el control local en el carcinoma pulmonar microcítico en estadio limitado? Un metaanálisis. J Clin Oncol, 1992. 10(6): 890-895.
- Pignon JP, et al: Un metaanálisis de la radioterapia torácica para el cáncer de pulmón microcítico. New England Journal of Medicine, 1992. 327(23): 1618-1624.
- Mascaux C., et al.: Revisión sistemática del papel del etopósido y el cisplatino en la quimioterapia del cáncer de pulmón microcítico con evaluación metodológica y metaanálisis. Cáncer de pulmón, 2000. 30(1): 23-36.
- Rossi A, et al: Quimioterapia basada en carboplatino o cisplatino en el tratamiento de primera línea del cáncer de pulmón microcítico: el metaanálisis COCIS de datos de pacientes individuales. J Clin Oncol, 2012. 30(14): 1692-1698.
- Slotman BJ, et al: Uso de la radioterapia torácica para el cáncer de pulmón microcítico en estadio extenso: un ensayo controlado aleatorizado de fase 3. Lancet, 2015. 385(9962): 36-42.
- Horn L, et al: Atezolizumab en primera línea más quimioterapia en el cáncer de pulmón microcítico en estadio extenso. N Engl J Med, 2018. 379(23): 2220-2229.
- www.astrazeneca.com/media-centre/press-releases/2019/imfinzi-improves-overall-survival-at-interim-analysis-in-the-phase-iii-caspian-trial-in-1st-line-extensive-stage-small-cell-lung-cancer-27062019.html.
- Auperin A, et al: Irradiación craneal profiláctica para pacientes con cáncer de pulmón microcítico en remisión completa. Grupo de colaboración para una visión general de la irradiación craneal profiláctica. N Engl J Med, 1999. 341(7): 476-484.
- Slotman B, et al: Irradiación craneal profiláctica en el cáncer de pulmón microcítico extensivo. N Engl J Med, 2007. 357(7): 664-672.
- Takahashi T, et al: Irradiación craneal profiláctica frente a observación en pacientes con cáncer de pulmón microcítico de enfermedad extensa: un ensayo multicéntrico, aleatorizado, abierto, de fase 3. Lancet Oncol, 2017. 18(5): 663-671.
- Gjyshi O, et al: Evolving Practice Patterns in the Use of Prophylactic Cranial Irradiation for Extensive-Stage Small Cell Lung CancerProphylactic Cranial Irradiation for Extensive-Stage Small Cell Lung Cancer. JAMA Network Open, 2019. 2(8): e199135-e199135.
- Böttger F, et al.: La heterogeneidad tumoral subyace a la sensibilidad diferencial al cisplatino en modelos de ratón de cáncer de pulmón microcítico. Cell reports, 2019. 27(11): 3345-3358. e4.
- O’Brien ME, et al: Ensayo de fase III que compara los cuidados de apoyo solos con los cuidados de apoyo con topotecán oral en pacientes con cáncer de pulmón microcítico recidivante. J Clin Oncol, 2006. 24(34): 5441-5447.
- von Pawel J, et al: Topotecán frente a ciclofosfamida, doxorrubicina y vincristina para el tratamiento del cáncer de pulmón microcítico recidivante. J Clin Oncol, 1999. 17(2): 658-667.
- Eckardt JR, et al: Open-label, multicenter, randomized, phase III study comparing oral topotecan/cisplatin versus etoposide/cisplatin as treatment for chemotherapy-naive patients with extensive-disease small-cell lung cancer. J Clin Oncol, 2006. 24(13): 2044-2051.
- Garassino MC, et al: Resultados de los pacientes con cáncer de pulmón microcítico tratados con quimioterapia de segunda línea: un análisis retrospectivo multiinstitucional. Cáncer de pulmón, 2011. 72(3): 378-83.
- Chung HC, et al: Resumen CT073: Pembrolizumab tras dos o más líneas de terapia previa en pacientes con cáncer de pulmón microcítico (CPM) avanzado: Resultados de los estudios KEYNOTE-028 y KEYNOTE-158. Investigación sobre el cáncer, 2019. 79(13 Suplemento): CT073-CT073.
- Ready N, et al: Monoterapia con nivolumab de tercera línea en el CPCP recurrente: CheckMate 032. J Thorac Oncol, 2019. 14(2): 237-244.
- Pless M., et al: Quimiorradiación de inducción en el cáncer de pulmón no microcítico en estadio IIIA/N2: un ensayo aleatorizado de fase 3. The Lancet, 2015. 386(9998): 1049-1056.
- Burdett S, et al: Radioterapia postoperatoria para el cáncer de pulmón de células no pequeñas. Base de datos Cochrane de revisiones sistemáticas, 2016(10).
- Antonia SJ, et al: Durvalumab tras la quimiorradioterapia en el cáncer de pulmón no microcítico en estadio III. N Engl J Med, 2017. 377(20): 1919-1929.
- Antonia SJ, et al: Supervivencia global con Durvalumab tras quimiorradioterapia en CPNM estadio III. N Engl J Med, 2018. 379(24): 2342-2350.
- Reck M, et al: Pembrolizumab frente a quimioterapia para el cáncer de pulmón no microcítico PD-L1-positivo. N Engl J Med, 2016. 375(19): 1823-1833.
- Gandhi L, et al: Pembrolizumab más quimioterapia en el cáncer de pulmón no microcítico metastásico. N Engl J Med, 2018. 378(22): 2078-2092.
- Socinski, M.A., et al: Atezolizumab para el tratamiento de primera línea del CPNM metastásico no escamoso. N Engl J Med, 2018. 378(24): 2288-2301.
- West H., et al: Atezolizumab en combinación con carboplatino más quimioterapia con nab-paclitaxel en comparación con quimioterapia sola como tratamiento de primera línea para el cáncer de pulmón no microcítico no escamoso metastásico (IMpower130): un ensayo multicéntrico, aleatorizado, abierto, de fase 3. Lancet Oncol, 2019. 20(7): 924-937.
- Paz-Ares L, et al: Pembrolizumab más quimioterapia para el cáncer de pulmón escamoso no microcítico. N Engl J Med, 2018. 379(21): 2040-2051.
- Vokes EE, et al: Nivolumab frente a docetaxel en cáncer de pulmón no microcítico avanzado previamente tratado (CheckMate 017 y CheckMate 057): actualización a 3 años y resultados en pacientes con metástasis hepáticas. Ann Oncol, 2018. 29(4): 959-965.
- Rittmeyer A, et al: Atezolizumab frente a docetaxel en pacientes con cáncer de pulmón no microcítico previamente tratado (OAK): ensayo controlado aleatorizado multicéntrico, abierto, de fase 3. Lancet, 2017. 389(10066): 255-265.
- Fehrenbacher L, et al: Updated Efficacy Analysis Including Secondary Population Results for OAK: A Randomized Phase III Study of Atezolizumab versus Docetaxel in Patients with Previously Treatated Advanced Non-Small Cell Lung Cancer. J Thorac Oncol, 2018. 13(8): 1156-1170.
- Herbst RS, et al: Pembrolizumab frente a docetaxel para el cáncer de pulmón no microcítico avanzado, PD-L1-positivo, previamente tratado (KEYNOTE-010): ensayo controlado aleatorizado. Lancet, 2016. 387(10027): 1540-1550.
- Alexandrov LB, et al: Firmas de procesos mutacionales en el cáncer humano. Nature, 2013. 500(7463): 415.
- Shi Y, et al: A prospective, molecular epidemiology study of EGFR mutations in Asian patients with advanced non-small-cell lung cancer of adenocarcinoma histology (PIONEER). J Thorac Oncol, 2014. 9(2): 154-162.
- Mitsudomi T, Yatabe Y: El receptor del factor de crecimiento epidérmico en relación con el desarrollo tumoral: el gen EGFR y el cáncer. La revista FEBS, 2010. 277(2): 301-308.
- Lee CK, et al: Impacto del inhibidor del EGFR en el cáncer de pulmón no microcítico sobre la supervivencia libre de progresión y global: un metaanálisis. J Natl Cancer Inst, 2013. 105(9): 595-605.
- Wu SG, Shih J-Y, Manejo de la resistencia adquirida a la terapia dirigida a los TKI del EGFR en el cáncer de pulmón no microcítico avanzado. Cáncer molecular, 2018. 17(1): 38.
- Soria JC, et al: Osimertinib en el cáncer de pulmón no microcítico avanzado con mutación del EGFR no tratado. New England journal of medicine, 2018. 378(2): 113-125.
- Tagrisso mejora significativamente la supervivencia global en el ensayo de fase III FLAURA para el cáncer de pulmón no microcítico con mutación del EGFR de 1ª línea [press release]. Wilmington, DE: AstraZeneca; 9 de agosto de 2019. https://bit.ly/2ZGF7gZ.
- Nakamura A, et al: Estudio de fase III que compara la monoterapia con gefitinib (G) con la terapia combinada con gefitinib, carboplatino y pemetrexed (GCP) para pacientes (pts) no tratados con cáncer de pulmón no microcítico (CPNM) avanzado con mutaciones del EGFR (NEJ009). Revista de Oncología Clínica, 2018. 36(15_suppl): 9005-9005.
- Saito H, et al: Erlotinib más bevacizumab frente a erlotinib solo en pacientes con cáncer de pulmón no microcítico no escamoso avanzado EGFR-positivo (NEJ026): análisis intermedio de un ensayo de fase 3 abierto, aleatorizado y multicéntrico. Lancet Oncol, 2019. 20(5): 625-635.
- Soda M, et al: Identificación del gen de fusión transformante EML4-ALK en el cáncer de pulmón no microcítico. Nature, 2007. 448(7153): 561.
- Shaw AT, et al: Características clínicas y resultados de los pacientes con cáncer de pulmón no microcítico portadores de EML4-ALK. Revista de oncología clínica, 2009. 27(26): 4247.
- Peters S, et al: Alectinib frente a crizotinib en el cáncer de pulmón no microcítico ALK-positivo no tratado. N Engl J Med, 2017. 377(9): 829-838.
- Hida T, et al: Alectinib frente a crizotinib en pacientes con cáncer de pulmón no microcítico ALK-positivo (J-ALEX): un ensayo de fase 3 abierto y aleatorizado. Lancet, 2017. 390(10089): 29-39.
- Ryser CO, Diebold J, Gautschi O: Tratamiento del cáncer de pulmón no microcítico anaplásico linfoma quinasa-positivo: actualización y perspectivas. Curr Opin Oncol, 2019. 31(1): 8-12.
- Shaw AT, et al: Crizotinib en el cáncer de pulmón no microcítico reordenado ROS1. New England Journal of Medicine, 2014. 371(21): 1963-1971.
- Ou S, et al: OA02. 03 Clinical Activity of Lorlatinib in Patients with ROS1+ Advanced Non-Small Cell Lung Cancer: Phase 2 Study Cohort EXP-6. Journal of Thoracic Oncology, 2018. 13(10): S322-S323.
- Planchard D, et al: Dabrafenib más trametinib en pacientes con cáncer metastásico de pulmón de células no pequeñas mutante para BRAF(V600E)-tratado previamente: un ensayo de fase 2 abierto y multicéntrico. Lancet Oncol, 2016. 17(7): 984-993.
- Planchard D, et al: Dabrafenib más trametinib en pacientes con cáncer de pulmón no microcítico metastásico con mutación BRAF(V600E) no tratado previamente: un ensayo abierto de fase 2. Lancet Oncol, 2017. 18(10): 1307-1316.
- Fakih M, et al: Estudio de fase 1 que evalúa la seguridad, tolerabilidad, farmacocinética (PK) y eficacia de AMG 510, un nuevo inhibidor de KRASG12C de molécula pequeña, en tumores sólidos avanzados. Revista de Oncología Clínica, 2019. 37(15_suppl): 3003-3003.
- Gautschi O, et al: Targeting RET in Patients With RET-Rearranged Lung Cancers: Results From the Global, Multicenter RET Registry. J Clin Oncol, 2017. 35(13): 1403-1410.
- Drilon AE, et al: Estudio de fase 1 de LOXO-292, un inhibidor de RET potente y altamente selectivo, en pacientes con cánceres con alteración de RET. Revista de Oncología Clínica, 2018. 36(15_suppl): 102-102.
- Gainor JF, et al: Actividad clínica y tolerabilidad de BLU-667, un inhibidor de RET altamente potente y selectivo, en pacientes (pts) con cáncer de pulmón no microcítico (CPNM) avanzado RET-fusión+. Revista de Oncología Clínica, 2019. 37(15_suppl): 9008-9008.
- Drilon A, et al: Eficacia del larotrectinib en cánceres positivos para la fusión TRK en adultos y niños. New England Journal of Medicine, 2018. 378(8): 731-739.
- Demetri GD, et al: LBA17Eficacia y seguridad del entrectinib en pacientes con tumores con fusión NTRK positiva (NTRK-fp): análisis conjunto de STARTRK-2, STARTRK-1 y ALKA-372-001. Annals of Oncology, 2018. 29(suppl_8).
- “DeVita”, Hellman and Rosenberg’s Cancer: Principles & Practice of Oncology, 11ª edición; Wolters Kluwer, 2019.
InFo ONcOLOGíA & HEMATOLOGíA 2019; 7(4): 12-17.