Los nuevos sistemas de TAVI transfemoral, en desarrollo o ya certificados, abordan las debilidades y limitaciones potenciales, como la insuficiencia paravalvular o el riesgo de complicaciones vasculares. Este artículo, basado en una presentación en el IV Simposio de Válvulas Cardíacas de Berna, ofrece una visión de los últimos avances.
La implantación percutánea transcatéter de la válvula aórtica (TAVI) se ha convertido en un método reconocido y probado en el tratamiento de la estenosis valvular grave de la válvula aórtica desde la primera implantación en 2002. El concepto mínimamente invasivo se ha mejorado constantemente en los últimos años. Se probaron o perfeccionaron diferentes vías de acceso, así como diversos sistemas de globos o colgajos autoexpandibles. Según los datos clínicos de ensayos aleatorios y registros, la TAVI es superior al tratamiento farmacológico y está a la par con la cirugía cardiaca convencional en pacientes de alto riesgo. El abordaje transfemoral ofrece la ventaja de un procedimiento bajo anestesia local sin anestesia general y se utiliza en la mayoría de los casos con una anatomía adecuada. Basándose en los resultados clínicos, la terapia TAVI se incluyó en las directrices de la Sociedad Europea de Cardiología en 2012 con una recomendación de clase I B para pacientes inoperables y de clase IIa B para pacientes de alto riesgo con estenosis grave de la válvula aórtica. La experiencia clínica con procedimientos TAVI se basa en el uso de las bioprótesis Edwards Sapien y Medtronic Corevalve, que se han establecido como dispositivos principales en la práctica clínica para procedimientos transfemorales. El número total de procedimientos ha aumentado rápidamente en todo el mundo, pero también en Suiza. Desde la primera TAVI en Berna en 2007, se han realizado en Suiza aproximadamente 650 procedimientos al año.
Nuevos sistemas con certificación CE
Edwards Sapien 3: La Edwards Sapien 3 (Edwards Lifesciences Inc., CA, EE.UU.) es una evolución de la prótesis Edwards Sapien XT y, al igual que su predecesora, tiene un armazón de stent de aleación de cobalto-cromo y una válvula cardiaca de pericardio bovino. Mientras que la Sapien 3, sin cambios respecto a los modelos anteriores, se fija con un balón en el anillo nativo de la válvula aórtica, como novedad especial aporta por primera vez una costura de sellado de tereftalato de polietileno (PET) en la zona inferior externa de la válvula cardiaca (Fig. 1a).
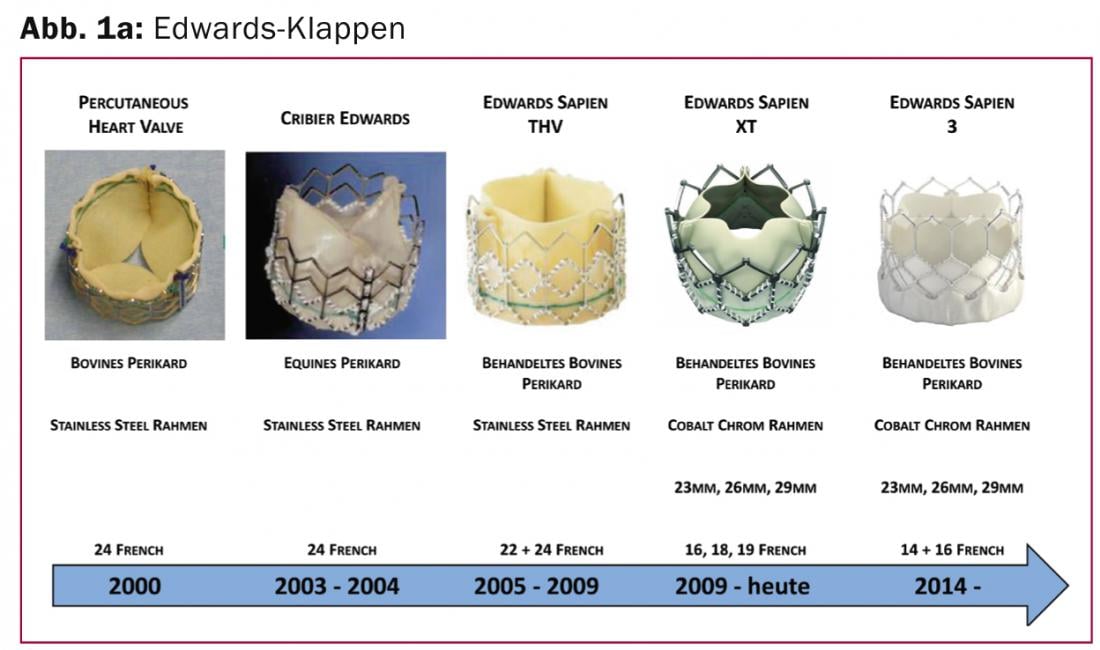
Esta costura de sellado está diseñada para rellenar los huecos entre la prótesis y la válvula nativa degenerativa, evitando las fugas paravalvulares. Un cambio en el diseño de la endoprótesis valvular también permite su implantación a través de esclusas de menor tamaño y un acceso más fácil a las arterias coronarias. Además del perfeccionamiento de la prótesis valvular, también se revisó a fondo el catéter femoral de implantación y se redujo su diámetro. Actualmente, sólo se requiere una vaina de 14 French (diámetro interior) para la implantación de una válvula de 23 y 26 mm, y una vaina de 16 French para la válvula de 29 mm. El sistema ha recibido recientemente la homologación CE y puede utilizarse comercialmente.
Colgajo Lotus de Boston Scientific: El sistema de colgajo Lotus autoexpandible (Boston Scientific, Natick, MA, EE.UU.) consiste en un colgajo de pericardio bovino insertado en una malla alargada de alambre de nitinol. Durante la implantación de esta válvula protésica, la endoprótesis se acorta y se ancla así en el anillo de la válvula aórtica nativa. Además de la ausencia de compromiso hemodinámico durante la implantación, la liberación controlada y lenta tiene, entre otras, la ventaja de que el sistema puede colocarse con gran precisión y, en caso necesario, recargarse completamente en el cuerpo incluso después de su despliegue completo. Como característica especial adicional, la válvula Lotus cuenta con material de sellado adaptable en la parte inferior de la prótesis, lo que provoca una reducción de la insuficiencia paravalvular de la válvula aórtica. La válvula Lotus se implanta a través de un catéter de 18 o 20 French, cuenta con la certificación CE y está disponible comercialmente en tamaños de 23 mm y 27 mm desde octubre de 2013.
St Jude Medical Portico: La válvula cardiaca Portico™ (St Jude Medical, St Paul, MN, EE.UU.) es una prótesis TAVI autoexpandible que consiste en un marco de stent de nitinol en el que se cose una válvula de pericardio bovino con un borde de pericardio porcino. Visualmente, la válvula es similar a la bioprótesis Corevalve de Medtronic, aunque la forma difiere principalmente en la porción distal, anular. Además, las celdas del armazón de la endoprótesis son mayores y la fuerza radial es menor. El concepto se basa en que esto debería reducir el riesgo de alteraciones de la conducción eléctrica y mejorar la adaptación de la prótesis a la anatomía nativa. El plano valvular también llega a situarse intraanularmente. La recientemente aprobada Portico™ (tamaños de prótesis de 23 – 25 mm) se inserta a través de un catéter de 18 French y puede reposicionarse parcialmente.
Direct Flow Medical: La prótesis valvular cardiaca Direct Flow Medical (Santa Rosa, CA, EE.UU.), recientemente certificada por la CE, presenta un diseño completamente diferente al de las demás bioprótesis TAVI. No tiene partes metálicas, dispone de un anillo aórtico y ventricular que evita las insuficiencias paravalvulares, y puede comprobarse su posición y estanqueidad tras la liberación completa y reposicionarse si es necesario. La experiencia clínica con esta válvula de pericardio bovino es aún limitada, se pueden tratar con ella dimensiones de anillo de hasta 28 mm.
Nuevos sistemas sin certificación CE utilizados en ensayos clínicos
Edwards Centera: La Edwards Centera (Edwards Lifesciences Inc., CA, EE.UU.) es una válvula protésica autoexpandible que consta de un armazón de stent de nitinol con una válvula de pericardio bovino. La forma especial de la endoprótesis valvular pretende facilitar la autoalineación y el centrado de la prótesis valvular en el anillo valvular nativo y utiliza una vaina de tereftalato de polietileno (PET) en la parte inferior para lograr el sellado y evitar las fugas paravalvulares. La liberación, muy controlada, se controla mediante un mecanismo eléctrico motorizado. A pesar de la elevada fuerza radial, también es posible reposicionar y retirar la válvula protésica durante la implantación si el posicionamiento no es óptimo. El Edwards Centera se está probando en ensayos clínicos en tamaños de 23 mm, 26 mm y 29 mm y puede insertarse mediante un catéter guía de 14 French. Los primeros resultados de esta prótesis valvular tuvieron una acogida positiva.
Medtronic CoreValve Evolut R: El sistema Medtronic CoreValve Revalving (Medtronic, Minneapolis, MN, EE.UU.) (fig. 1b) fue el segundo sistema introducido con éxito como sistema transcatéter para el tratamiento de la estenosis aórtica grave.
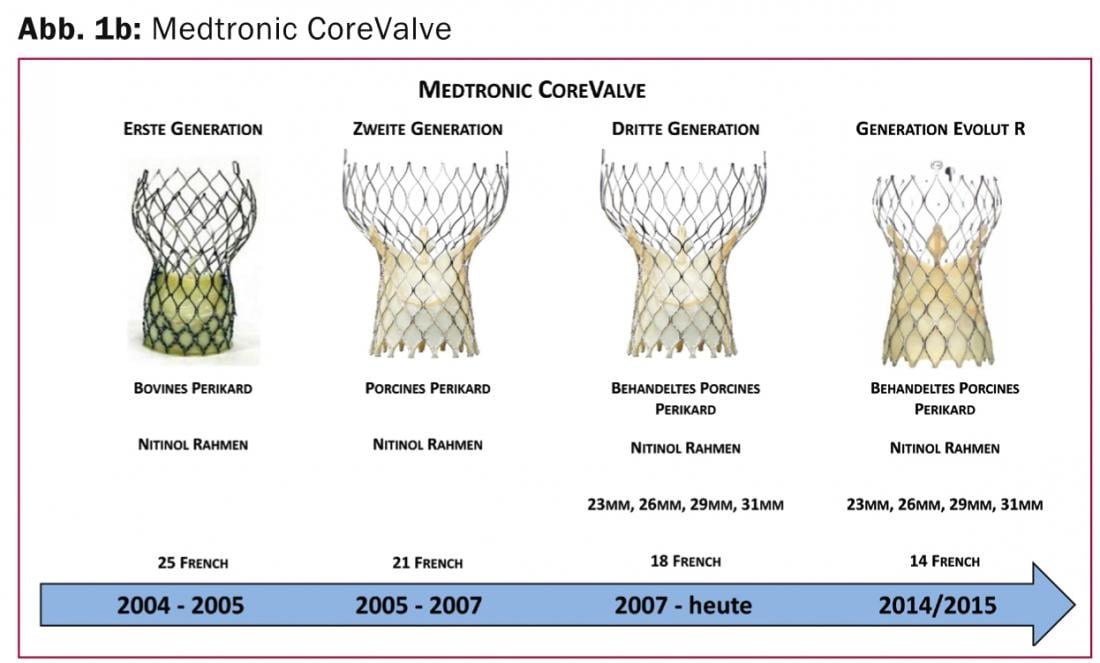
Desde su certificación con la marca CE en 2007, se ha utilizado con regularidad en todo el mundo y presenta una posición de válvula supraanular y una tecnología de implantación autoexpandible. La siguiente generación (Evolut R) tiene como objetivo el posicionamiento simplificado y repetido de la prótesis, es decir, el sistema puede volver a introducirse en el catéter y reposicionarse en caso de que la posición no sea óptima. Esta nueva tecnología ya se ha utilizado clínicamente en estudios y consiste en una aleación de níquel-titanio (Nitinol) ligeramente modificada con una geometría celular mejorada, así como una nueva estructura de la zona de salida y una reducción del tamaño de la prótesis en un 10%. El diseño modificado debería permitir un mejor ajuste y alineación de la válvula protésica incluso en anatomías de la raíz aórtica especialmente anguladas y cubre la gama más amplia de tamaños de anillo (18 -29 mm). La aprobación de este sistema mejorado, que utiliza pericardio porcino, está prevista para 2014 / 2015.
Otros sistemas valvulares transfemorales de nueva generación: En un futuro próximo, otros sistemas TAVI ampliarán la gama (Fig. 2) .
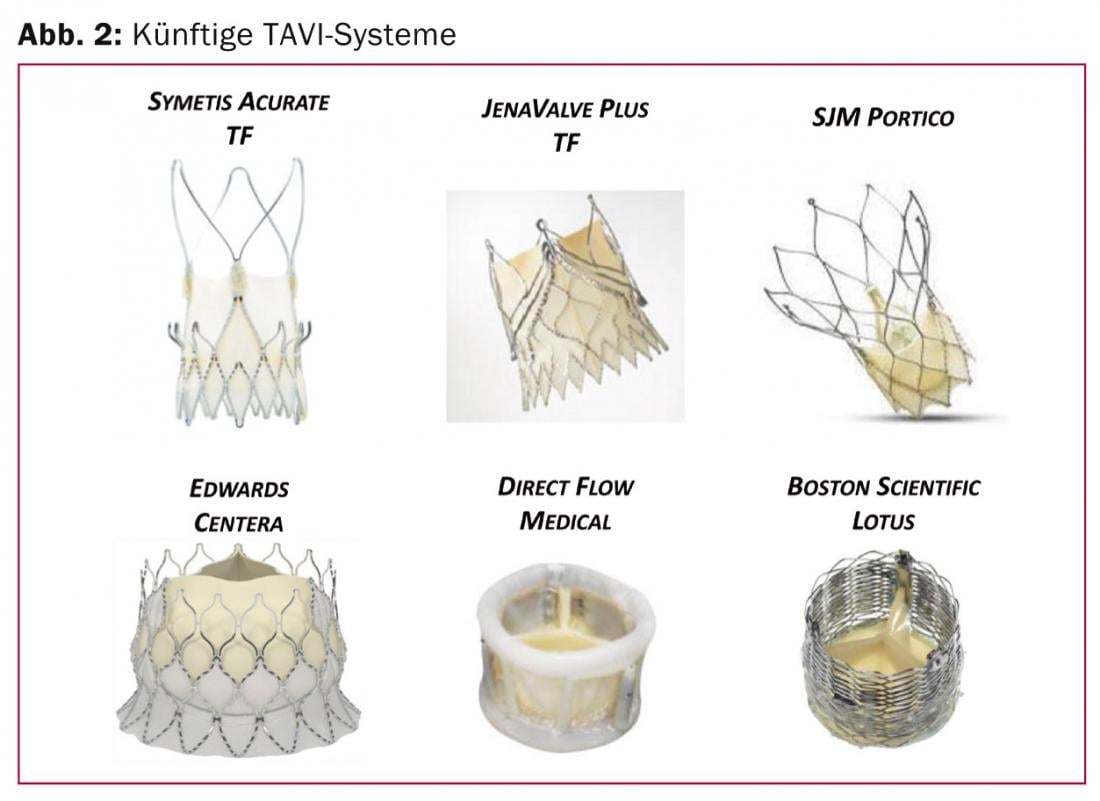
Se están desarrollando predominantemente sistemas autoexpandibles que, dependiendo de la anatomía, también pueden insertarse directamente en el anillo nativo sin predilatación. Se trata de sistemas como el Symetis Acurate TF (Symetis Inc, Ecublens, Suiza) o el JenaValve Plus (Munich, Alemania), que ya han sido aprobados para el abordaje transapical y que ahora se están probando clínicamente para el abordaje transfemoral. Presentan una técnica de anclaje alternativa, así como innovadores mecanismos de autocentrado y estabilización. Los mecanismos de anclaje que utilizan valvas nativas y bolsas valvulares evitan el contacto con la zona subvalvular y, por tanto, también minimizan el riesgo de alteraciones de la conducción eléctrica y la necesidad de implantar un marcapasos definitivo. Esto último debe mencionarse como una desventaja para los sistemas autoexpandibles que se sitúan parcialmente en el tracto de salida del ventrículo izquierdo.
El registro suizo de TAVI
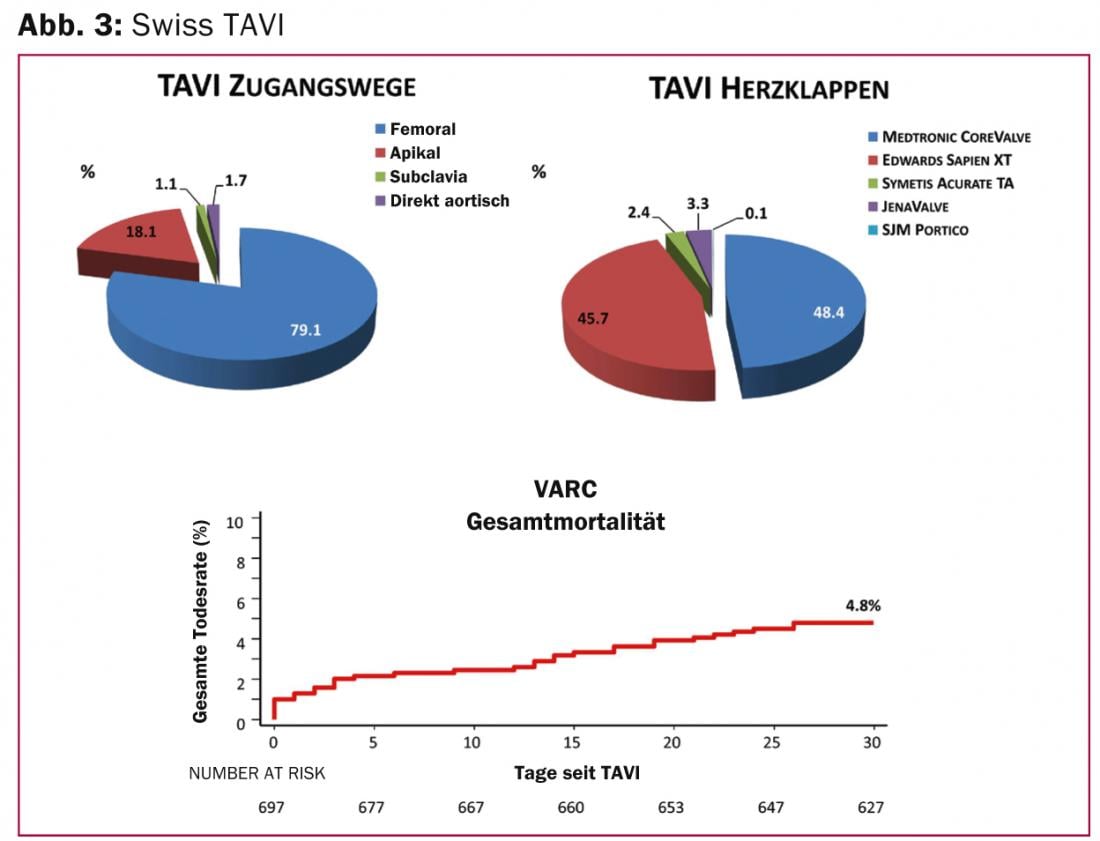
El Registro Suizo de TAVI es un proyecto nacional interdisciplinar del Grupo de Trabajo Suizo de Cardiología Intervencionista y la Sociedad Suiza de Cirugía Cardiaca, y se inició en 2011 con el fin de definir un estándar de calidad nacional correspondiente para la terapia TAVI y poder ofrecerla de manera uniforme en Suiza. En la actualidad, se realizan entre 50 y 60 intervenciones de TAVI al mes en Suiza. Los pacientes son de alto riesgo (riesgo de mortalidad a 30 días calculado según la puntuación STS del 8,2%), gravemente sintomáticos (73% NYHA III y IV) y tienen una edad media de 82 años. En la mayoría de los casos se utiliza una vía de implantación femoral (79%), menos frecuentemente la transapical, la aórtica directa o el acceso por la arteria subclavia (Fig. 3) . La tasa de mortalidad del 4,8% a los 30 días fue inferior a la esperada. Se produjeron acontecimientos cerebrovasculares en el 3,3% (2,5% con déficits permanentes) e infarto de miocardio en el 0,4% en los primeros 30 días tras la intervención. Las complicaciones más frecuentes fueron las vasculares (11,8%), así como las hemorragias locales (16,6%) y la implantación de marcapasos (20,5%).
Resumen
El tratamiento mínimamente invasivo con catéter de la estenosis grave de la válvula aórtica se ha aceptado como alternativa a la sustitución quirúrgica de la válvula aórtica y es ahora una terapia establecida para pacientes seleccionados. Las continuas innovaciones técnicas y los nuevos avances abordan o minimizan las limitaciones anteriores, como la insuficiencia aórtica paravalvular y las complicaciones del acceso. Así pues, la nueva generación de prótesis valvulares TAVI y sistemas de implantación promete una nueva mejora de los criterios de valoración clínicos gracias a una notable reducción de las complicaciones periprocedimiento. Los ensayos clínicos en curso demostrarán si estas grandes expectativas pueden cumplirse. Esto también determinará si las indicaciones para el uso de bioprótesis TAVI pueden ampliarse en el futuro.
Prof. Dr. med. Peter Wenaweser
Dr. Stefan Stortecky
Fuente: “New transfemoral TAVI systems and Swiss TAVI Registry”, presentación en el 4º Simposio de válvulas cardiacas de Berna, 13 de febrero de 2014, Berna.
Literatura:
- Wenaweser P, et al.: Resultados clínicos a corto plazo entre los pacientes sometidos a implantación de válvula aórtica transcatéter en Suiza: el registro TAVI suizo. EuroIntervention 2014 (marzo [epub ehead of print]).
- Blumenstein J, et al: Avances recientes en la implantación de válvulas aórticas transcatéter: dispositivos novedosos y posibles deficiencias. Revisiones actuales de cardiología 2013; 9: 274-280.
- Leon MB, et al: Implantación transcatéter de válvula aórtica para la estenosis aórtica en pacientes que no pueden someterse a cirugía. N Engl J Med 2010; 363(17): 1597-1607.
- Smith CR, et al: Sustitución transcatéter frente a sustitución quirúrgica de la válvula aórtica en pacientes de alto riesgo. N Engl J Med 2011; 364(23): 2187-2198.
- Wenaweser P, et al: Resultados clínicos de los pacientes con estenosis aórtica grave con mayor riesgo quirúrgico según la modalidad de tratamiento. J Am Coll Cardiol 2011; 58(21): 2151-2162.
CARDIOVASC 2014; 13(2): 39-42