La fibrilación auricular es la arritmia cardiaca más frecuente en el mundo occidental. El tratamiento intervencionista muestra resultados prometedores. El aislamiento de las venas pulmonares (PVI) desempeña un papel clave. Además, existen innovaciones como la llamada “cartografía de alta densidad” o la localización y visualización de rotores.
La FA es la arritmia cardiaca más frecuente en el mundo occidental, con una prevalencia del 1,5-2%, y afecta actualmente a unos 34 millones de personas en todo el mundo [1]. Se estudió la cohorte de Framingham en relación con el riesgo de FA a lo largo de la vida y se descubrió que el 25% de los hombres y mujeres >de 40 años desarrollarán FA a lo largo de su vida [2]. Debido al creciente envejecimiento de la sociedad, se prevé que la prevalencia de la FA se duplique en los próximos 50 años. La FA se asocia a un mayor riesgo de accidentes cerebrovasculares, insuficiencia cardiaca y hospitalizaciones, pero también a una mayor mortalidad, por lo que representa un reto médico, económico y social especialmente importante. Además de la terapia farmacológica, a menudo ineficaz y asociada a efectos secundarios indeseables, el tratamiento intervencionista con catéter de la FA se ha convertido en la terapia estándar para el control del ritmo en las directrices actuales debido a su eficacia [3]. La cuestión de si el tratamiento intervencionista de la FA conlleva una reducción de la mortalidad además de una mejora de la morbilidad es objeto de ensayos aleatorios multicéntricos en curso (CABANA, EAST) [3].
Ablación de la fibrilación auricular
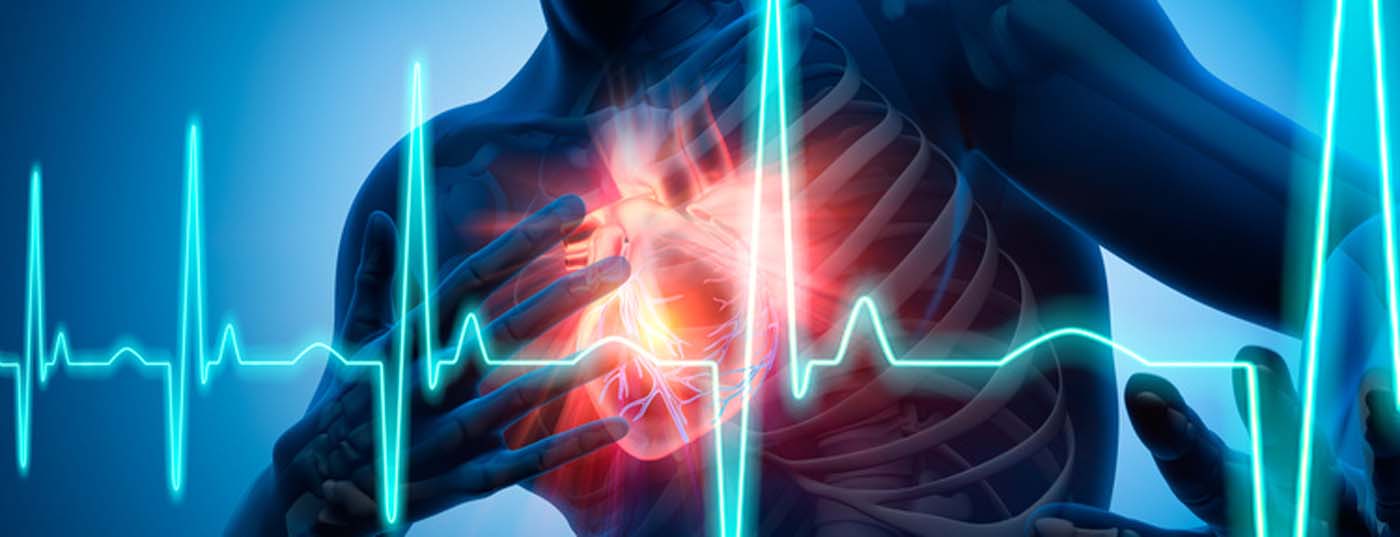
Tras las punciones venosas inguinales y una o dos punciones transeptales a través del tabique interauricular desde la derecha hasta la aurícula izquierda, actualmente se suele crear una reconstrucción electroanatómica tridimensional de la aurícula izquierda para la ablación por radiofrecuencia más utilizada (Fig. 1), lo que puede reducir significativamente el tiempo de fluoroscopia. En muchos centros, esta reconstrucción se apoya en una tomografía computerizada o una resonancia magnética realizadas previamente. Debe prestarse especial atención a la reconstrucción de las venas pulmonares (VP), la orejuela auricular izquierda (OI) y el anillo mitral (AM). La angiografía selectiva de la VP puede ser útil en este sentido. Los sistemas de cartografía tridimensional pueden utilizarse para generar mapas de voltaje eléctrico y de activación, que proporcionan información valiosa sobre la presencia de un sustrato patológico en la aurícula izquierda y sobre los mecanismos y el origen de las arritmias auriculares. Los catéteres de diagnóstico para derivar señales eléctricas y para la estimulación suelen colocarse en el seno coronario y en las VP. La ablación de la FA se realiza bajo heparinización terapéutica. Las complicaciones de la ablación de FA son raras en general, las más comunes incluyen complicaciones inguinales en alrededor del 2-4% (hemorragia, fístula arteriovenosa/aneurisma), seguidas de derrames pericárdicos/taponamientos pericárdicos (alrededor del 1-2%) y ataques isquémicos transitorios/ictus (<1%). La complicación más temida es una fístula iatrogénica entre el esófago y la aurícula izquierda (fístula atrioesofágica), que suele manifestarse sólo unas semanas después de la ablación, es muy rara en general (<0,5%), pero a menudo es letal [3].
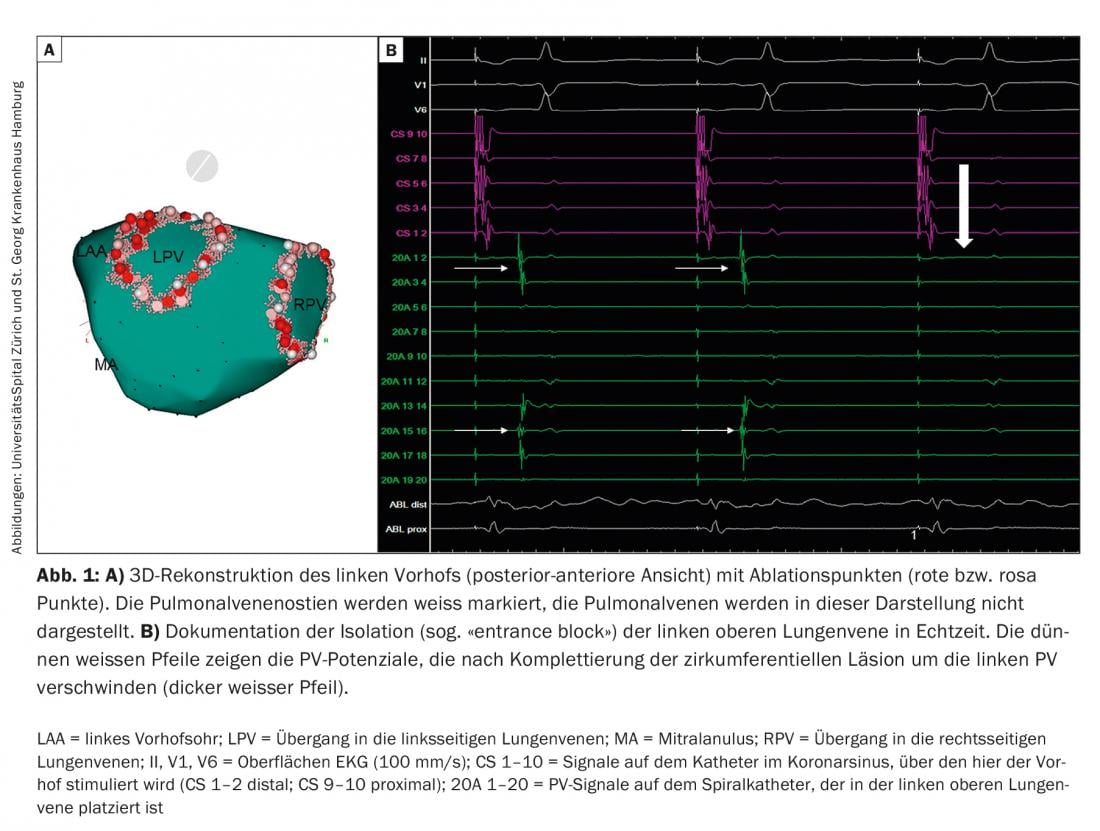
Fibrilación auricular paroxística (FAP): Los focos ectópicos son responsables del desencadenamiento de la FA [4]. Como las VP están conectadas a la aurícula izquierda a través de fibras musculares cardiacas, las acciones eléctricas pueden transmitirse a las aurículas a través de estas fibras y desencadenar aquí la FA. Esta constatación ha cambiado fundamentalmente nuestra comprensión y las estrategias de tratamiento de la FA. Mientras que la terapia quirúrgica cardiaca para la FA en el siglo XX tenía como objetivo eliminar o reducir el sustrato de la FA -es decir, el tejido auricular que mantiene la FA-, las estrategias terapéuticas actuales, especialmente para la FAP, se dirigen a eliminar los factores desencadenantes. Dado que estos desencadenantes surgen con mayor frecuencia en las VP, el aislamiento de las venas pulmonares (AVP) se ha erigido como la principal estrategia terapéutica invasiva para la FA en la actualidad. Hoy en día, la IVP circunferencial “de área amplia” eléctrica mediante corriente de radiofrecuencia (Fig. 1), alternativamente también el aislamiento eléctrico de la VP con el balón frío (criobalón; Fig. 2) o balón láser, es la piedra angular de la terapia intervencionista para la FA. Especialmente en pacientes con FAP, la IVP puede conducir a un ritmo sinusal estable en la mayoría de los pacientes durante varios años. Esto se aplica a los adultos más jóvenes <45 años [5], pero también a los pacientes >80 años. Sin embargo, para algunos pacientes se necesitan varios procedimientos. Nuestra experiencia ha demostrado que la ausencia a largo plazo de FA/taquicardia auricular (TA) durante un periodo de seguimiento medio de cinco años tras la intervención quirúrgica estuvo presente en el 47% de los pacientes. Sin embargo, tras varias intervenciones (mediana 1, intervalo 1-3), esta cifra pudo incrementarse hasta el 80% [6]. Tras un periodo de seguimiento medio de diez años, la ausencia de FA/TA tras múltiples ablaciones es de aproximadamente el 63%. Es importante destacar que la causa principal de la FA recurrente es la reconexión eléctrica de la VP a la aurícula izquierda, incluso cuando sólo una VP ha renovado la conducción eléctrica. Esta reconexión eléctrica de las VP se encuentra hasta en el 92% de los pacientes con FA que se someten a una IVP repetida. En estos casos, el reaislamiento de las VP puede conducir al control clínico de la FA en el 81% de los pacientes. Sin embargo, en el 14% de estos pacientes se identificaron desencadenantes adicionales de FA no VP.
En la actualidad, hay pocos datos que sugieran otros objetivos empíricos de ablación además de las VP en pacientes con FAP. Lo mismo se aplica a los reprocedimientos para el tratamiento de la FAP en los que se volvieron a aislar los PV. En ocasiones, sin embargo, la eliminación adicional de los desencadenantes fuera de la VP, como los procedentes de la vena cava superior, la pared posterior de la aurícula izquierda o la crista terminalis, puede conducir a un mejor resultado de la IVP en la FAP.
Fibrilación auricular persistente: Cuanto más tiempo persista la FA, más pronunciados serán los cambios estructurales (“remodelación”) de las aurículas. Esto conduce a un círculo vicioso: la FA provoca FA (“la fibrilación auricular engendra fibrilación auricular”) [7]. La excitación eléctrica caótica y las contracciones descoordinadas de las aurículas provocan cambios en las propiedades eléctricas del miocardio auricular, una contractilidad reducida, dilatación y fibrosis auricular. Esto favorece el mantenimiento de la AF. Mientras que la actividad focal de las VP tiene una importancia decisiva como desencadenante en la FAP, pasa a un segundo plano en la FA persistente. Por lo tanto, las tasas de éxito publicadas de la IVP para la FA persistente son, en general, inferiores a las de la FAP, pero siguen siendo significativamente mejores que la terapia basada únicamente en fármacos. Se han desarrollado nuevas estrategias terapéuticas para mejorar los resultados de la ablación con catéter de la FA persistente. Se basan en múltiples teorías sobre los mecanismos de formación de la FA (persistente). Una de las teorías más antiguas es la llamada hipótesis de las “ondículas múltiples”. Esto afirma que la FA es creada y mantenida por múltiples ondas de excitación independientes y caóticas que se mueven en ambas aurículas. Dado que debe existir un número mínimo de ondas concurrentes y una cierta masa crítica de tejido auricular excitable para mantener la FA, se han desarrollado diversas técnicas quirúrgicas (por ejemplo, la operación Cox-Maze) en las que se realizan múltiples incisiones transmurales en ambas aurículas, impidiendo así la reentrada intraauricular. Esta técnica se adaptó décadas más tarde para la ablación con catéter endocárdico de la FA persistente.
Otra hipótesis para el desarrollo de la FA persistente se basa en los llamados CFAE (electrogramas auriculares fraccionados complejos). Las CFAE representan regiones específicas de las aurículas en las que existe un retraso en la excitación eléctrica (“conducción lenta”), que puede dar lugar a una microrreentrada local. Por lo tanto, estas regiones también se prestan a la ablación con catéter.
El enfoque de ablación escalonada tiene como objetivo eliminar los factores desencadenantes en la VP y modificar el sustrato en la LA. En este procedimiento, primero se aíslan las VP mediante energía de radiofrecuencia, seguida de la ablación CFAE. A continuación, se aplican lesiones lineales en el techo de la AI y en la AM hasta que se alcanza el punto final de finalización de la FA o de transición a una TA y se ablaciona esta última y se convierte en ritmo sinusal. Es importante destacar que las brechas en las lesiones lineales pueden provocar un retraso en la conducción de la excitación en estas zonas y, por tanto, reentradas y TA iatrogénicas. Por lo tanto, la prueba de un bloqueo de la línea eléctrica a lo largo de la línea aplicada en ambas direcciones (el llamado bloqueo bidireccional) es muy importante. En dos estudios publicados recientemente en los que se utilizó este enfoque, la ausencia de FA/TA tras un procedimiento y una media de 2,1 procedimientos fue del 17/20% y del 56/63%, respectivamente, tras un seguimiento de cinco años. Los predictores significativos de FA/TA recurrente fueron la falta de conversión de la FA a ritmo sinusal durante la ablación, un diámetro auricular izquierdo ≥50 mm, una FA de larga duración >18 meses y una cardiopatía estructural [8].
Nuestra estrategia para la FA persistente consiste en realizar primero un IVP circunferencial de “área amplia”. La modificación adicional del sustrato sólo se realiza si no se puede convertir al paciente a ritmo sinusal (incluso mediante electrocardioversión). Tras un periodo de seguimiento de cinco años, la tasa de éxito con esta estrategia en pacientes con FA de larga duración tras la cirugía inicial fue del 20%, y del 45% tras una mediana de dos procedimientos. Es importante destacar que los pacientes con FA persistente <2 años en particular mostraron buenos resultados a largo plazo.
En el mayor ensayo multicéntrico aleatorizado de ablación de FA persistente (STAR AF 2), publicado recientemente, se compararon tres estrategias de ablación. 589 pacientes seleccionados para ablación por radiofrecuencia por primera vez debido a FA persistente (<3 años) refractaria a fármacos fueron aleatorizados en los siguientes brazos de tratamiento: IVP sola (grupo 1) frente a IVP + ablación CFAE (grupo 2) frente a IVP + ablación CFAE + lesiones lineales (grupo 3). Tras un periodo de observación de 18 meses, no se pudieron demostrar diferencias estadísticamente significativas entre los brazos terapéuticos.
¿Qué dicen las directrices?
Las actuales directrices europeas de 2016 sobre la FA enumeran la ablación con catéter de la FA sintomática en centros experimentados como un método clínicamente establecido que debe realizarse normalmente tras un intento infructuoso de tratamiento con fármacos antiarrítmicos (recomendación de clase IA para la FAP y IIa B para la FA persistente). El objetivo principal en este caso es la IVP, que puede lograrse utilizando corriente de radiofrecuencia o el criobalón (IIa B). En pacientes sintomáticos, principalmente aquellos con FAF sin cardiopatía estructural significativa o con FA persistente con sospecha de taquicardiomiopatía, también se recomienda la ablación con catéter como alternativa al tratamiento antiarrítmico farmacológico debido a las buenas tasas de éxito y las escasas complicaciones (IIa B). En las cardiopatías estructurales, se observa que puede ser necesaria una ablación más extensa de la AI. La ablación del istmo auricular derecho debe realizarse como parte de la ablación de la FA si se ha documentado un aleteo auricular dependiente del istmo antes o durante el procedimiento (IB). La ablación con catéter debe ir seguida de la administración de heparinas y anticoagulantes orales superpuestos durante al menos dos meses (IIa B). Periprocedimentalmente, también pueden utilizarse los nuevos anticoagulantes orales (NOAC). Después, los factores de riesgo de ictus deben ser la base para seguir decidiendo sobre la anticoagulación (IIa C). Debe considerarse la continuación de la anticoagulación en pacientes con un factor de riesgo mayor o dos factores de riesgo no mayores clínicamente relevantes para el ictus (por ejemplo. B. Puntuación CHA2DS2-VASc ≥2) (IIa B).
Las decisiones relativas a la cirugía cardiaca para tratar formas más complejas de FA tras múltiples tratamientos intervencionistas sin éxito deben tomarse por recomendación de un equipo cardiaco de FA. Un equipo cardiaco de FA debe estar formado al menos por un electrofisiólogo intervencionista, un cirujano cardiaco con experiencia en ablación quirúrgica de FA y un anestesista cardiaco [3].
Avances modernos en la terapia intervencionista
presión de contacto (“fuerza de contacto”): La reconducción de la FV tras un aislamiento satisfactorio (reconexión) es uno de los principales retos de la IVP. Esto se debe, entre otras cosas, a la insuficiencia de lesiones durante el procedimiento índice. Se sabe que la fuerza de contacto (FC) de la punta del catéter con el tejido que se va a esclerosar es muy importante para poder establecer lesiones transmurales. Los estudios iniciales en los que se investigaron estos novedosos catéteres con capacidad para medir la FC y una punta de catéter refrigerada demostraron su seguridad para la ablación de la FA. También se demostró que los resultados dependían del nivel de FC. Una FC media <10 g se asoció significativamente con mayor frecuencia a arritmias recurrentes, mientras que se obtuvieron resultados superiores a la media con una FC >20 g (sin embargo, el riesgo de complicaciones aumentó en >40 g). Durante un segundo procedimiento diagnóstico tras la ablación inicial con catéteres de FC, las lesiones tisulares incompletas se correlacionaron inversamente con la FC y el producto de la FC y la duración de la ablación (la denominada integral fuerza-tiempo, FTI). El estudio EFFICAS I condujo a un ajuste de las recomendaciones, que indican una FC óptima de 20 g y un mínimo de 400 gs (FTI) por lesión de ablación durante la ablación.
Criobalón: El criobalón (Fig. 2) se introdujo en 2006 y ha demostrado ser un sistema seguro y eficaz para la IVP. La IVP eléctrica se consigue colocando el catéter con globo en el ostium de la VP respectiva y enfriándola a -55 °C con nitrógeno líquido para que el tejido de la unión de la aurícula izquierda y la VP se congele (normalmente durante 180-240 s por VP). El catéter con balón se introduce en la AI a través de una vaina larga dirigible. Se inserta un catéter cartográfico circular multipolar a través del lumen del catéter balón para obtener señales de la VP. Con la introducción de la segunda generación, los resultados a largo plazo mejoraron significativamente con respecto a la primera generación hasta alcanzar una ausencia de FA/TA de >80% al año y de >70% a los dos años tras un procedimiento índice. Una complicación característica del criobalón es la paresia del nervio frénico derecho. La parálisis del nervio frénico suele ser reversible en un año, pero persiste en el 2,5% de los pacientes. La tasa de paresia del nervio frénico podría reducirse si la congelación se realizara con menos presión de contacto, el catéter balón se colocara más antralmente y se estimulara el nervio frénico durante la congelación del VP derecho para detectar a tiempo las alteraciones de la motilidad y una reducción de la actividad eléctrica del diafragma derecho. Varios estudios (incluido el mayor ensayo prospectivo aleatorizado multicéntrico de ablación de FA [9] publicado recientemente) han demostrado que el criobalón es equivalente al IVP en términos de eficacia y seguridad en comparación con la tecnología más antigua de ablación por radiofrecuencia.
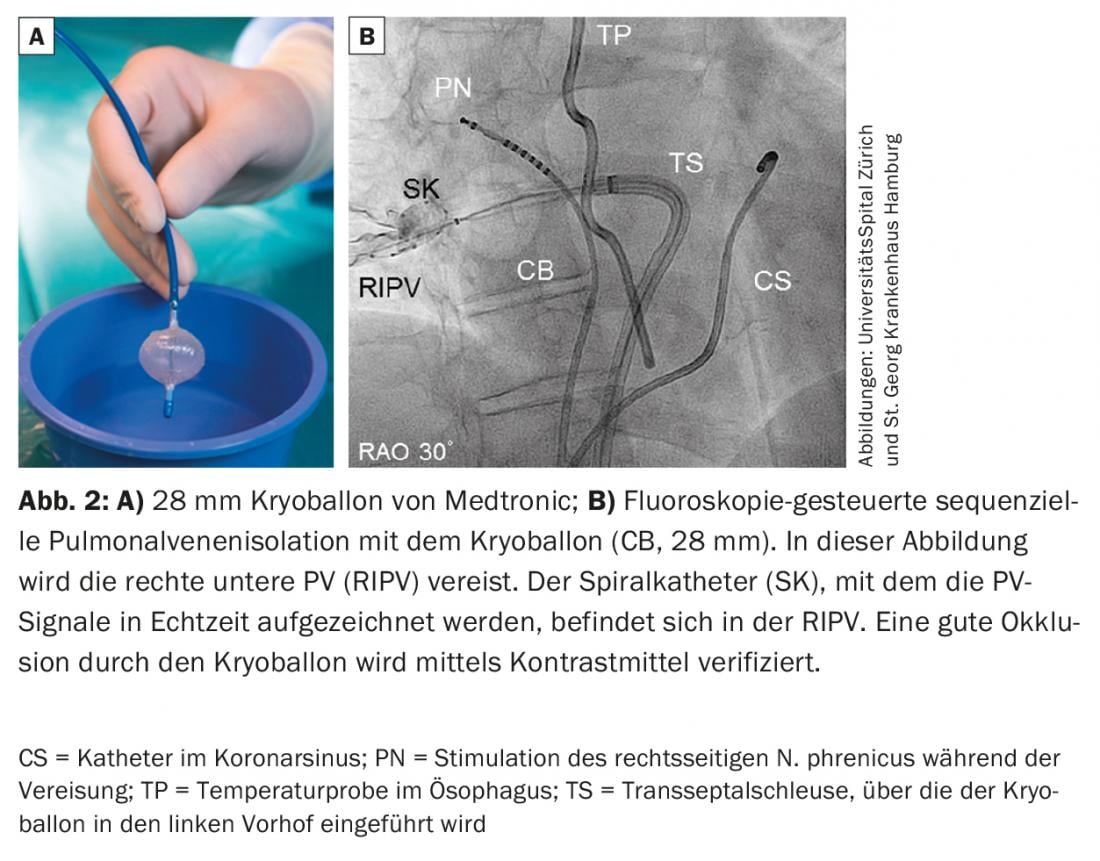
“Cartografía de alta densidad Con el llamado “mapeo de alta densidad”, recientemente se ha hecho posible diagnosticar el estado de un paciente en pocos minutos utilizando catéteres de diagnóstico multipolares (por ejemplo, Orion™ de Boston Scientific, o Pentaray® de Biosense Webster) para crear un mapa electroanatómico tridimensional de las aurículas con varios miles de puntos sin rayos X. (Fig.3). Estos mapas en 3D proporcionan información muy precisa sobre los potenciales de voltaje, así como sobre la activación eléctrica del miocardio, lo que puede resultar muy útil, especialmente para la ablación de la taquicardia reentrante auricular. [10].
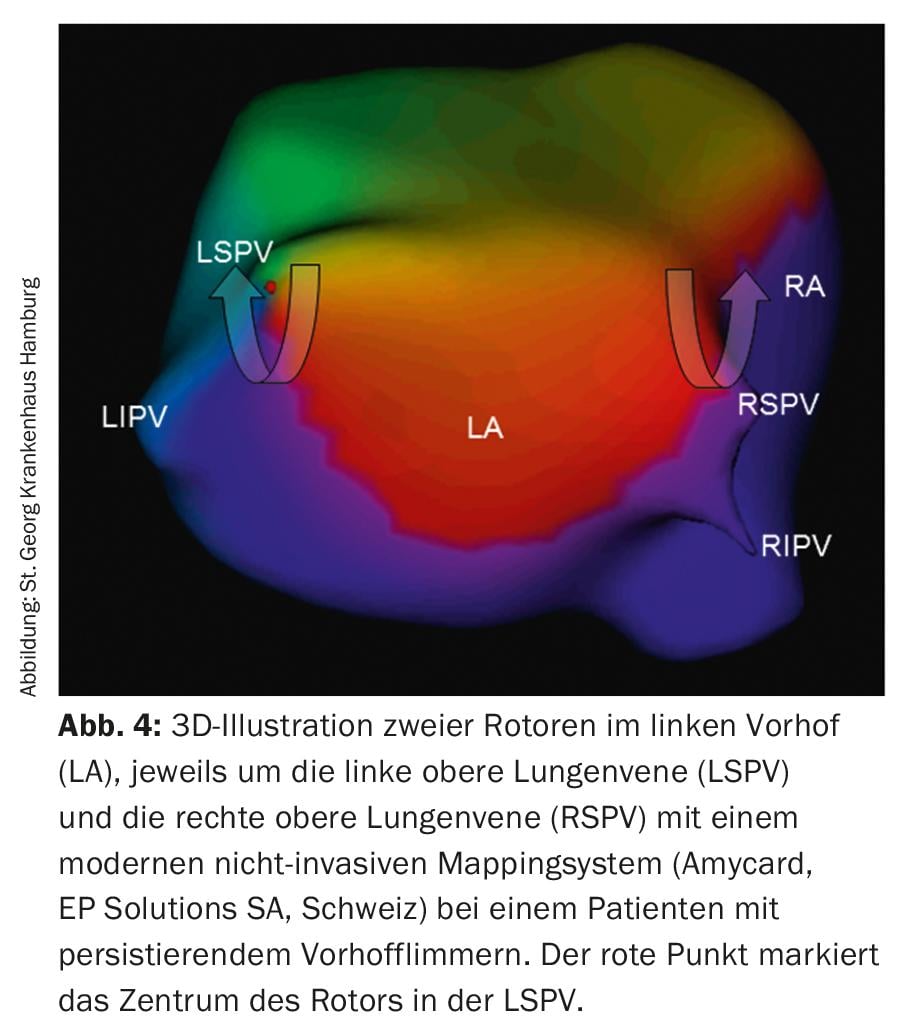
Ablación de los rotores: Un concepto más novedoso sobre las causas de la FA persistente son los llamados rotores (Fig. 4 ) en las aurículas, que inician y mantienen la FA -como un huracán- y que, por tanto, también pueden ser el objetivo de la ablación con catéter. En la actualidad, existen varios sistemas diseñados para permitir la localización y visualización de rotores. Sin embargo, hay que esperar los resultados a largo plazo de esta nueva tecnología.
Control de los factores de riesgo: El Aggressive Risk factor REduction STudy for Atrial Fibrillation (ARREST-AF) adoptó un enfoque completamente distinto para mejorar el pronóstico a largo plazo tras la ablación de FA. Aquí se ablacionaron 149 pacientes con FA y un índice de masa corporal de al menos 27 kg/m2 y al menos un factor de riesgo cardiaco adicional. 61 eligieron participar en la gestión rigurosa de los factores de riesgo bajo la supervisión de médicos de una clínica especializada, a los 88 sujetos restantes sólo se les enseñó la gestión rigurosa de los factores de riesgo. Durante el periodo de seguimiento de 3,5 años, estas medidas condujeron a una mejora significativa del perfil de riesgo en el grupo con gestión de factores de riesgo en comparación con el grupo de control, por un lado, y por otro, el éxito de la ablación duró más tiempo: 33 frente a 10% de libertad de arritmia tras una ablación, 87 frente a 18% tras múltiples ablaciones [11].
Mensajes para llevarse a casa
- La fibrilación auricular (FA) es la arritmia cardiaca más frecuente en el mundo occidental, con una prevalencia del 1,5-2%, y es por tanto un
- importante reto clínico y socioeconómico.
- El tratamiento intervencionista de la FA está mostrando resultados prometedores, y el aislamiento de la vena pulmonar (AVP) desempeña un papel clave.
- Un reto del tratamiento con catéter de la FA es la creación de lesiones permanentes transmurales. Nuevos procedimientos como el balón frío (crioablación) o los catéteres con sensor de contacto deberían mejorar esta situación.
- Especialmente en la FA paroxística (FAP) y la FA persistente corta (<3 meses), las posibilidades de éxito de la IVP son buenas, pero también la FA persistente más larga puede tratarse con éxito mediante ablación con catéter.
- Si la terapia intervencionista conlleva una menor mortalidad además de una mejora de la morbilidad es objeto de estudios en curso.
Conflictos de intereses: Ardan Saguner: Honorarios por conferencias de Boston Scientific; Subvenciones educativas de Biosense Webster, Biotronik, Boston Scientific y St. Jude Medical.
Literatura:
- Chugh SS, et al: Epidemiología mundial de la fibrilación auricular: estudio Global Burden of Disease 2010. Circulation 2014; 129(8): 837-847.
- Lloyd-Jones DM, et al: Riesgo vitalicio de desarrollo de fibrilación auricular: el estudio Framingham Heart Study. Circulation 2004; 110(9): 1042-1046.
- Kirchhof P, et al: 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016; 37(38): 2893-2962.
- Haissaguerre M, et al: Iniciación espontánea de la fibrilación auricular por latidos ectópicos originados en las venas pulmonares. N Engl J Med 1998; 339(10): 659-666.
- Saguner AM, et al: Ablación con catéter de la fibrilación auricular en adultos muy jóvenes: un estudio de seguimiento de 5 años. Europace 2016; euw378.
- Ouyang F, et al: Resultados a largo plazo de la ablación con catéter en la fibrilación auricular paroxística: lecciones de un seguimiento de 5 años. Circulation 2010; 122(23): 2368-2377.
- Wijffels MC, et al: La fibrilación auricular engendra fibrilación auricular. Un estudio en cabras despiertas crónicamente instrumentadas. Circulation 1995; 92(7): 1954-1968.
- Scherr D, et al.: Resultados a cinco años de la ablación con catéter de la fibrilación auricular persistente utilizando la terminación de la fibrilación auricular como criterio de valoración del procedimiento. Circ Arritmia Electrofisiol 2015; 8(1): 18-24.
- Kuck KH, et al: Ablación con criobalón o radiofrecuencia para la fibrilación auricular paroxística. N Engl J Med 2016; 374(23): 2235-2245.
- Saguner AM, et al.: Primera experiencia clínica con un novedoso sistema de cartografía electroanatómica de alta resolución para procedimientos de ablación de la aurícula izquierda. Clin Res Cardiol 2016; 105(12): 992-1002.
- Pathak RK, et al: Estudio de reducción agresiva de los factores de riesgo para la fibrilación auricular e implicaciones para el resultado de la ablación. Revista del Colegio Americano de Cardiología 2014; 64(21): 2222-2231.
CARDIOVASC 2017; 16(4): 24-29