La hemorragia subaracnoidea aneurismática (aSAB) se asocia a una elevada mortalidad y morbilidad. Tras la estabilización inicial del paciente, la fuente de la hemorragia debe eliminarse mediante formas de terapia neuroquirúrgica y/o endovascular. Los aneurismas candidatos a ambas opciones de tratamiento deben tratarse preferentemente por vía endovascular. Sin embargo, no todos los aneurismas son adecuados para la terapia endovascular y las opciones quirúrgicas siguen teniendo un lugar claro en la actualidad. No obstante, debido a su carácter mínimamente invasivo y al progresivo desarrollo del método endovascular, cabe esperar un aumento de esta forma de terapia. Este documento pretende presentar las posibilidades de ambas opciones terapéuticas.
La aparición repentina de una “cefalea de aniquilación” como principal síntoma patognomónico de una hemorragia subaracnoidea aneurismática (HSAa) debida a la rotura de un aneurisma de la base cerebral marca para la mayoría de los pacientes el comienzo de un acontecimiento drástico que, en el mejor de los casos, marcará las semanas venideras, pero a menudo el resto de sus vidas [1]. A menudo se ven afectados hombres y mujeres jóvenes (edad media de aparición: 40-60 años) y por lo demás sanos (proporción entre sexos: 1,6:1). La presentación clínica del aSAB puede variar mucho, pero a menudo incluye dolor de cabeza intenso, meningismo, náuseas/vómitos y disminución de la vigilancia. En el mejor de los casos, la constelación de síntomas conduce a una rápida hospitalización y diagnóstico mediante tomografía computarizada (TC) y, si es necesario, punción de líquido cefalorraquídeo. Si la sospecha diagnóstica se realiza y confirma con retraso, esto puede repercutir negativamente en la terapia posterior y en el resultado clínico-funcional, por lo que siempre se requiere un alto nivel de atención al evaluar a los pacientes con cefalea.
Gestión de la aSAB
Diagnóstico y clasificación: Cuando se remite a un paciente con sospecha de SAB, el diagnóstico debe confirmarse rápidamente mediante TC ( Fig. 1a y b ) tras asegurar las funciones vitales y un examen neurológico orientativo (Tab. 1 ), y el SAB puede clasificarse según la escala de Fisher (Tab. 2) [2].
La resonancia magnética puede ser útil si hay un intervalo largo entre el episodio hemorrágico y el diagnóstico inicial; la TC es preferible en los casos agudos. En ausencia de evidencia de hemorragia en la TC, es esencial realizar una punción del LCR para detectar eritrocitos (y posiblemente siderófagos/xantocromía) en casos de alta sospecha clínica. Si el SAB está presente, debe solicitarse una angiografía para diferenciar el SAB aneurismático del no aneurismático y para identificar el origen de la hemorragia. La angiografía por TC (TC-A) puede realizarse en la misma sesión que la TC nativa, y la TC-A moderna puede diagnosticar con fiabilidad el origen de la hemorragia en muchos casos. Sin embargo, sólo sirve como base para la toma de decisiones relativas a la terapia de oclusión posterior en pacientes con una afección aguda potencialmente mortal que requiera una intervención quirúrgica inmediata (por ejemplo, una hemorragia extraaxial o intracerebral que ocupe espacio). La mejor visualización del aneurisma hemorrágico-sintomático (y de la morfología del cuello del aneurisma), posiblemente de otros aneurismas asintomáticos y de la anatomía vascular específica del paciente se consigue con la angiografía convencional de 4 vasos.
Tratamiento perioperatorio: El objetivo preoperatorio es prevenir la hemorragia postoperatoria y tratar la hipertensión intracraneal sintomática. En pacientes con aSAB y vigilancia reducida, busque la presencia de hidrocefalia aguda y alíviela insertando un drenaje ventricular externo (DVE). La vigilancia posterior está indicada en una unidad de cuidados intensivos (neuro)quirúrgica especializada. Hasta que se elimine definitivamente el aneurisma, puede producirse una hemorragia postoperatoria (riesgo aproximado del 4% en 24 h y del 20% en 2 semanas), por lo que debe controlarse la tensión arterial y evitar los picos de tensión. Los pacientes tras una ASB pueden experimentar una serie de complicaciones agudas (como desequilibrios electrolíticos, ataques epilépticos y complicaciones pulmonares y cardiacas), cuyo tratamiento detallado queda fuera del alcance de este artículo y se ha descrito con detalle en otro lugar [3].
En la fase postoperatoria, la profilaxis, el diagnóstico y la terapia de las complicaciones específicas de la enfermedad asociadas a un mayor riesgo de infartos cerebrales secundarios son cruciales. El vasoespasmo cerebral (CVS) se produce en el 30-70% de los pacientes a partir del segundo día después de unABS, alcanza su máximo entre el sexto y el noveno día y se vuelve sintomático en cerca del 50% de los casos durante este periodo (ICD, “isquemia cerebral retardada”). La ICD es la causa más común de infarto cerebral secundario, morbilidad y mortalidad tras una BAEa. El antagonista del calcio nimodipino reduce el riesgo de muerte o de necesidad de cuidados a largo plazo (“riesgo relativo” 0,67; IC del 95%: 0,55-0,81), por lo que debería administrarse de forma profiláctica. Si las medidas medicinales hemodinámico-aumentativas son insuficientes para la terapia del CVS sintomático, puede ser necesario el tratamiento endovascular mediante angioplastia con balón y/o instilación superselectiva de vasodilatadores (papaverina, nimodipino) en casos seleccionados.
Terapia de oclusión
La oclusión del aneurisma sirve como profilaxis contra la hemorragia secundaria y debe intentarse lo antes posible, pero en cualquier caso dentro de las 72 horas siguientes al episodio hemorrágico [4]. Existen básicamente dos métodos para ello: la intervención microquirúrgica o la endovascular.
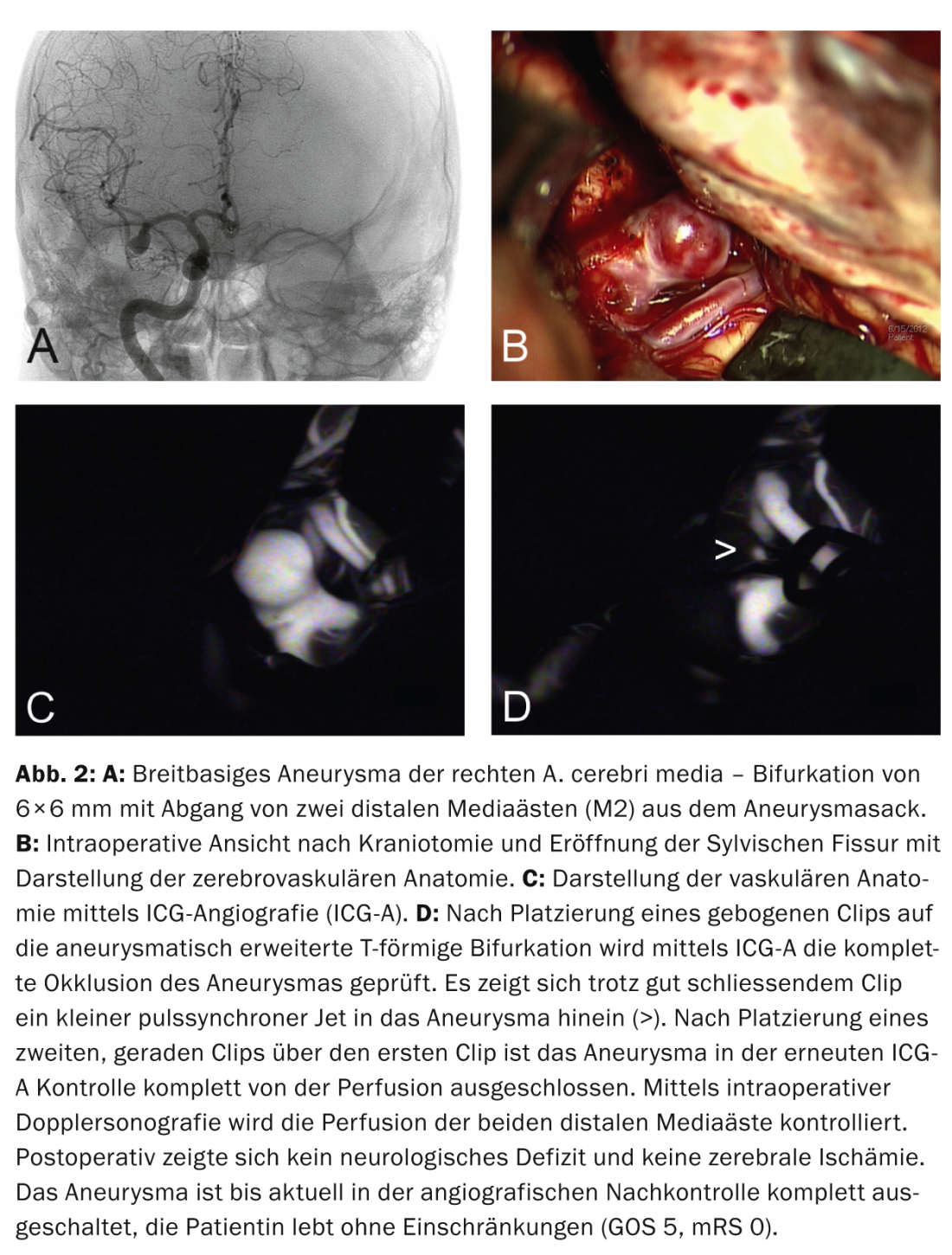
Recorte de aneurismas y otras formas de terapia quirúrgica: El tratamiento microquirúrgico de los aneurismas intracraneales mediante clipaje requiere la apertura de la cúpula craneal y las meninges, la visualización de la anatomía cerebrovascular (Fig. 2a y b) y la colocación de un clip en el cuello del aneurisma. La angiografía intraoperatoria con fluoresceína (angiografía ICG) puede utilizarse para comprobar la oclusión completa del aneurisma (Fig. 2c y d); la ecografía Doppler intraoperatoria puede detectar la oclusión accidental de vasos adyacentes, lo que requeriría la recolocación del clip. Otras alternativas de tratamiento microquirúrgico incluyen la envoltura y el atrapamiento del aneurisma.
En la envoltura, el saco del aneurisma se cubre con tejido (músculo, fascia) o tejido extraño no absorbible. Este método se utiliza para las vasodilataciones fusiformes o para los aneurismas de cuyo saco surgen vasos importantes. Así pues, la eliminación definitiva no siempre es posible, y el efecto protector es objeto de controversia.
El atrapamiento (normalmente para aneurismas fusiformes o gigantes) consiste en utilizar un clip para cerrar el vaso portador proximal y distalmente al aneurisma. Si el aporte colateral a la zona de suministro es insuficiente, deberá recurrirse a la cirugía de bypass extraintracraneal. La evaluación preoperatoria detallada del flujo sanguíneo cerebral y de su función es esencial para evitar daños cerebrales irreversibles.
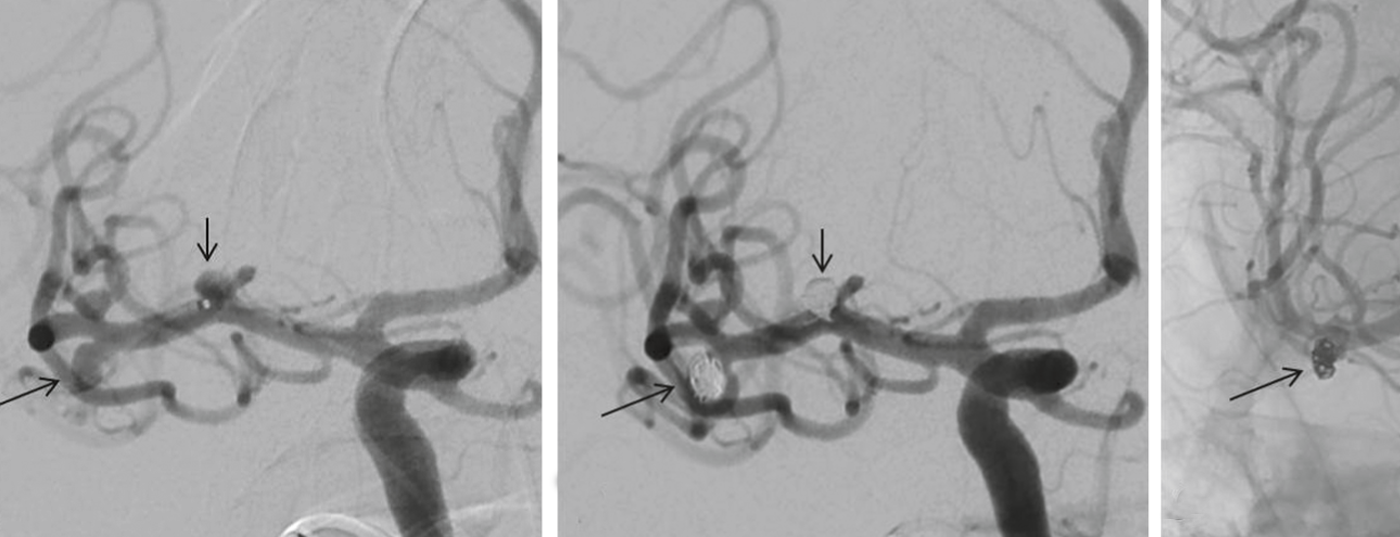
Espiralado de aneurismas y otros procedimientos endovasculares: El principio del espiralado endovascular del aneurisma, introducido por Guglielmi en 1991, se basa en la trombosis inducida en el aneurisma por espirales depositadas electrolíticamente después de haber introducido espirales de platino en el saco del aneurisma mediante un catéter avanzado endovascularmente en el aneurisma. El cierre completo del saco del aneurisma con espirales evita una nueva rotura del aneurisma (Fig. 3a a c) .
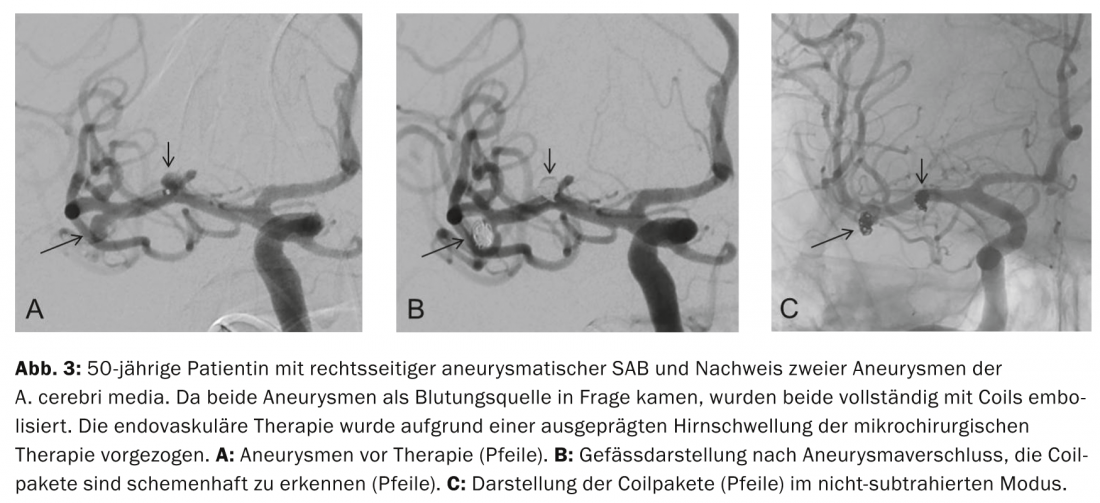
Un nuevo y prometedor enfoque terapéutico es el espiral asistido por balón y la combinación de implantación de endoprótesis y espiral para mejorar la tasa de oclusión en los aneurismas de cuello ancho. En los últimos años, las opciones de terapia endovascular se han ampliado gracias al desarrollo de desviadores de flujo y nuevos materiales de implantación (por ejemplo, WEB).
Selección de la opción terapéutica óptima: El método óptimo para la oclusión del aneurisma roto debe seleccionarse siempre de forma interdisciplinar por neurocirujanos vasculares y neurorradiólogos intervencionistas [4], siendo de gran importancia la experiencia local disponible en la selección de la forma de terapia. En la actualidad existen pruebas, entre otras del estudio ISAT (“International subarachnoid aneurysm trial”), de que el tratamiento endovascular (coiling sin balón o stent) conduce a un mejor resultado clínico-funcional al cabo de un año en comparación con el clipaje [5]. En el estudio ISAT, 2142/9559 pacientes con aneurismas que podrían haber sido tratados con cualquiera de los dos métodos fueron asignados aleatoriamente a un brazo de tratamiento (en el 77,6% de los pacientes evaluados, un método era a priori preferible – fueron excluidos del estudio). Además de un elevado sesgo de selección, el estudio ISAT fue criticado por la proporción desproporcionadamente grande (90%) de formas leves de SAB y una infrarrepresentación de los aneurismas de la arteria cerebral media. Sin embargo, para la subpoblación incluida, se demostró que el espiralado (23,7%) daba lugar a una reducción absoluta del riesgo del 6,9% de muerte y morbilidad grave un año después del tratamiento en comparación con el clipado (30,6%). Aunque el seguimiento más prolongado de los pacientes con ISAT también mostró una reducción de la mortalidad relativa a 5 años a favor del espiral, la tasa de pacientes que vivían de forma independiente fue la misma tras el clipaje (82%) y el espiralaje (83%) [6]. Tanto los datos iniciales como los posteriores del ISAT mostraron una mayor tasa de resangrado en los pacientes con espirales, en parte debido a una alta tasa de oclusiones incompletas del aneurisma [5, 6]. Como resultado, el 17,4% de los pacientes a los que se les colocó un espiral y el 3,8% de los que recibieron un clip recibieron un tratamiento de seguimiento (cociente de riesgos = 6,9) [7], lo que arroja una luz crítica sobre el beneficio a largo plazo del espiral solo, en particular en los pacientes más jóvenes <40 años [8]. Sin embargo, se espera que los futuros estudios comparativos que permitan el tratamiento endovascular con endoprótesis y/o con balón arrojen mejores resultados en cuanto a la oclusión del aneurisma a largo plazo tras el tratamiento endovascular. Aún no está claro cuál es la diferencia que condujo a un mejor resultado en los pacientes tras el espiralado en ISAT. Se discute la mayor invasividad de la craneotomía, con más complicaciones postoperatorias (“síndrome de respuesta inflamatoria sistémica”, anemia, etc.), así como una menor incidencia de CVS e ICD tras el tratamiento con espirales.
En un metaanálisis reciente, se analizaron ambos métodos con respecto a los criterios de valoración secundarios [9]. Se observó que el riesgo de CVS se reducía en los pacientes tratados endovascularmente (n=1267; 43,1% vs 48,8%; OR 1,43; IC 95% 1,07-1,91; p=0,02), con tasas similares de infarto isquémico tras la terapia endovascular o microquirúrgica (n=1123; 20,9% vs 16,1%; OR 0,74; IC 95% 0,52-1,06; p=0,10). Un número similar de pacientes requirió una derivación definitiva (n=1981; 19,3% frente a 16,4%; OR 0,84; IC 95% 0,66-1,07; p=0,16), y la tasa de complicaciones periprocedimiento fue comparable entre los dos métodos (n=866; 5,6% frente a 9,9%; OR 1,19; IC 95% 0,67-2,11; p=0,56) [9]. Está claro que los resultados del ISAT no pueden relacionarse con toda la población de pacientes con aSAB y que ambas formas de terapia seguirán coexistiendo, ya que en determinadas situaciones un método es claramente preferible al otro. No obstante, los resultados del ISAT desafían a los cirujanos neurovasculares a seguir perfeccionando su tratamiento y a seleccionar a los pacientes a los que les conviene más la terapia quirúrgica en el futuro. A continuación se esbozará el proceso de toma de decisiones para una u otra opción terapéutica.
Tratamiento endovascular preferido: El tratamiento endovascular suele preferirse en pacientes de edad avanzada (>70 años), pacientes con alto riesgo médico quirúrgico o con mal estado neurológico (WFNS grado 4 y 5) debido a su menor invasividad [4]. Además, los aneurismas en la zona de la fosa craneal posterior (zona estromal vertebrobasilar) o el seno cavernoso deben tratarse preferentemente por vía endovascular, ya que el tratamiento quirúrgico en estas localizaciones se asocia a una morbilidad y una mortalidad significativamente mayores y a veces ni siquiera es factible. Los aneurismas de cuello estrecho son especialmente adecuados para el tratamiento endovascular – en caso de que un cuello de aneurisma ancho requiera la combinación de espiral y colocación de endoprótesis, la tasa de complicaciones periprocedimiento aumenta algo. El clipaje sería preferible, también en el contexto de la necesidad de tomar aspirina y clopidogrel tras la colocación del stent y, por tanto, de las opciones de tratamiento neuroquirúrgico comprometidas (EVD, craniectomía).
Además, el coiling es preferible en pacientes que toman medicación para diluir la sangre (por ejemplo, aspirina, clopidogrel, Marcoumar) y en presencia de aneurismas bilaterales múltiples a los que no se puede llegar por una vía de acceso quirúrgica. En los pacientes que requieren tratamiento dentro de la fase de vasoespasmo, la terapia endovascular puede ser preferible, ya que la disección quirúrgica de la base del cerebro es significativamente más difícil en presencia de un hemisferio hinchado (“cerebro enfadado”) y cualquier manipulación de los vasos por parte del cirujano en esta fase vulnerable puede provocar un CVS. Por el contrario, el vasoespasmo visible angiográficamente durante el tratamiento endovascular puede tratarse eficazmente mediante una angioplastia inmediata o la aplicación intraarterial local de vasodilatadores. Apoyándose en los datos del ISAT, debería preferirse el espiral en los casos en que ambas opciones de tratamiento parezcan igual de eficaces [4].
Atención neuroquirúrgica preferente: La terapia quirúrgica se prefiere en situaciones de emergencia en las que debe realizarse una evacuación quirúrgica inmediata del hematoma debido a una hemorragia extraaxial o intracerebral que ocupa espacio adicional (Fig. 1). El clipaje puede realizarse en la misma sesión si la visualización angiográfica (TC) del aneurisma es de calidad suficiente. Además, se recomienda la terapia quirúrgica para los pacientes con aneurismas en la zona del A. cerebri medio o A. pericallosa (sin embargo, en el caso de un cuello estrecho, también puede tratarse bien por medios endovasculares), en el caso de aneurismas con un cuello ancho o vasos que salen del saco del aneurisma (riesgo de oclusión en el caso del coiling); Fig. 2) o en aneurismas que no son fácilmente accesibles por medios endovasculares (por ejemplo, “acodamiento” pronunciado de la arteria carótida interna, pacientes con displasia fibromuscular y riesgo de disección carotídea iatrogénica), merece la pena considerarlo en pacientes más jóvenes <40 años [4, 8]. En presencia de aneurismas unilaterales múltiples, se puede llegar a varios aneurismas durante una intervención quirúrgica a través del mismo acceso.
Resultados y perspectivas
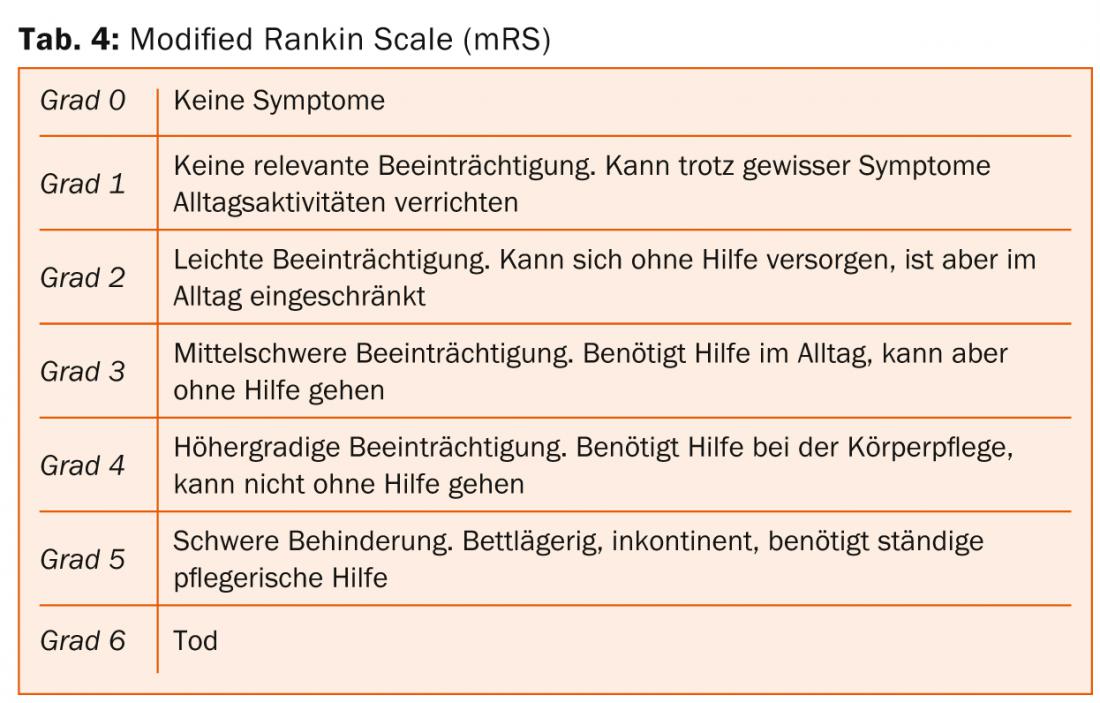
El resultado clínico-funcional después de unSAB depende principalmente de la edad y de la gravedad de la hemorragia inicial. En las últimas décadas, la mortalidad tras una aSAB pudo reducirse de cerca del 50% en los años setenta a aproximadamente el 30% en la actualidad. Hoy en día, la mayoría de los pacientes mueren antes de ingresar en el hospital. El porcentaje de pacientes con un SAB grave y un buen resultado clínico-funcional (“Glasgow Outcome Scale” [GOS] 4-5 [ Tab. 3] o “modified Rankin Scale” [mRS] 0-2 [Tab. 4]) es de aproximadamente el 40% en la actualidad, pero la incidencia y la relevancia cotidiana de los déficits neuropsicológicos tras unSAB son elevadas incluso en pacientes con un resultado neurológico óptimo [1].

La evolución en cuanto a la futura selección de la terapia de oclusión óptima depende en gran medida de nuevos avances técnicos y de los resultados a largo plazo de grandes estudios comparativos. En el Hospital Cantonal de St. Gallen, primero se llega a un consenso entre neurocirugía y neurorradiología sobre la forma óptima de terapia para cada paciente de aSAB, tras lo cual se informa conjuntamente al paciente y a sus familiares.
En consonancia con la tendencia en todos los ámbitos de la cirugía hacia métodos mínimamente invasivos, menos traumáticos y más inocuos cosméticamente, es probable que la proporción de pacientes tratados por medios endovasculares siga aumentando en el futuro. Otros aspectos más novedosos del tratamiento de aneurismas en los últimos años son el clipaje y el espiralado de aneurismas residuales (tras un espiralado/clipaje incompleto, compactación del espiral o aumento del tamaño del aneurisma a pesar del espiralado/clipaje), que pueden plantear nuevos retos al terapeuta.
En Suiza también se siguen con gran interés los acontecimientos mundiales y se abordan cuestiones insuficientemente aclaradas. En este país, los ocho grandes centros neurovasculares han unido sus fuerzas para documentar la atención a los pacientes con aSAB, recopilar parámetros cruciales en una base de datos nacional (“Estudio suizo sobre la hemorragia subaracnoidea por aneurisma”, Swiss SOS) y contribuir así a una mejor comprensión y pronóstico de esta compleja enfermedad. [10].
Dr. Martin N. Stienen
Agradecimientos: Los autores agradecen al Dr. Heiko Richter, Neurocirugía OAmbF (KSSG) su amabilidad al facilitarnos la figura 2.
Literatura:
- Stienen MN, et al: Acta Neurochir Vienna 2013; 155: 2045-2051.
- Fisher CM, Kistler JP, Davis JM: Neurocirugía 1980; 6: 1-9.
- Seule MA, et al: Anasthesiol Intensivmed Notfallmed Schmerzther 2010; 45: 8-17.
- Steiner T, et al: Cerebrovasc Dis 2013; 35: 93-112.
- Molyneux A, et al: Lancet 2002; 360: 1267-1274.
- Molyneux AJ, et al: Lancet Neurol 2009; 8: 427-433.
- Campi A, et al: Ictus 2007; 38: 1538-1544.
- Mitchell P, et al: J Neurosurg 2008; 108: 437-442.
- Li H, et al: Ictus 2013; 44: 29-37.
- Schatlo B, et al: Acta Neurochir Vienna 2012; 154: 2173-2178; discusión 2178.
InFo Neurología y Psiquiatría 2014; 12(1): 18-22