La histología (resección tumoral o biopsia) es esencial para diagnosticar los gliomas de grado superior y evaluar el pronóstico y la terapia. Los marcadores moleculares sirven de complemento a la clasificación de la OMS en cuanto a la evolución prevista de la enfermedad y la respuesta terapéutica a la quimioterapia alquilante. La terapia estándar para pacientes menores de 65 ó 70 años consiste en radioterapia y quimioterapia combinadas con temozolomida (TMZ) concomitante y adyuvante. Los pacientes mayores de 65 ó 70 años tienen una ventaja de supervivencia con la quimioterapia con TMZ en el caso de un promotor MGMT metilado; sin un promotor MGMT metilado, se recomienda únicamente la radioterapia. En los oligodendrogliomas anaplásicos y los oligoastrocitomas con codeleción 1p/19q, existe una ventaja de supervivencia en caso de quimioterapia alquilante precoz (PCV o TMZ).
Los gliomas anaplásicos y los glioblastomas se encuentran entre los tumores cerebrales malignos más frecuentes. Se caracterizan por un pronóstico desfavorable. La confirmación histológica mediante biopsia quirúrgica de tejido es necesaria para establecer el diagnóstico. En todos los gliomas malignos debe aspirarse a un alto grado de resección, en la medida de lo posible sin tener que aceptar un déficit neurológico permanente, debido al pronóstico más favorable. Los tumores cerebrales se clasifican en grados I a IV según la clasificación de la OMS (2007) basada en criterios anatomopatológicos. El objetivo de esta clasificación es orientar sobre el pronóstico, el curso clínico y las opciones de tratamiento basadas en pruebas según el grado de malignidad.
Marcadores moleculares
En los últimos años se han identificado marcadores moleculares que caracterizan subtipos de glioma con diferente pronóstico y respuesta a las terapias. Un marcador con valor pronóstico informa sobre el pronóstico de la enfermedad independientemente de la terapia realizada. Especialmente relevante para la toma de decisiones clínicas es un marcador con valor predictivo que prediga la respuesta a una terapia concreta.
- Codeleción 1p/19q: Un marcador molecular estrechamente asociado a los tumores oligodendrogliales es la pérdida combinada de los brazos cromosómicos 1p y 19q (“pérdida de heterocigosidad”, LOH-1p/19q, codeleción 1p/19q).
- Promotor MGMT: Otro marcador importante es el estado de metilación del promotor de la O6-metilguanina-ADN metiltransferasa (MGMT). La MGMT es una proteína reparadora del ADN que reduce los efectos de la quimioterapia alquilante. En el caso de la metilación del promotor, el gen MGMT se expresa a un nivel reducido, lo que mejora relativamente la eficacia de la quimioterapia alquilante. Un promotor MGMT metilado tiene un valor pronóstico favorable para los gliomas de los grados III y IV de la OMS y, dependiendo del subgrupo, también es predictivo en términos de una ventaja de supervivencia en caso de quimioterapia alquilante.
- Mutación IDH: Un marcador de pronóstico favorable en todas las gliomegalias es una mutación en el gen de la isocitrato deshigenasa (IDH)-1 o -2. Los pacientes con astrocitoma anaplásico sin mutación IDH (IDH de tipo salvaje) tienen un pronóstico menos favorable que los pacientes con glioblastoma con mutación IDH [1]. Se cree que los glioblastomas con mutación IDH han surgido de tumores de grado II o III en términos de progresión maligna (glioblastomas secundarios), en contraste con los glioblastomas primarios, que se caracterizan por ser IDH de tipo salvaje y probablemente representan una entidad biológicamente diferente.
A continuación, ofreceremos una visión general de las opciones de tratamiento actuales, teniendo en cuenta la clasificación de la OMS, los marcadores moleculares, así como la edad de los pacientes; en las figuras 1 y 2 se resume una vía de decisión clínica sugerida.


Oligodendrogliomas anaplásicos y oligoastrogliomas grado III de la OMS
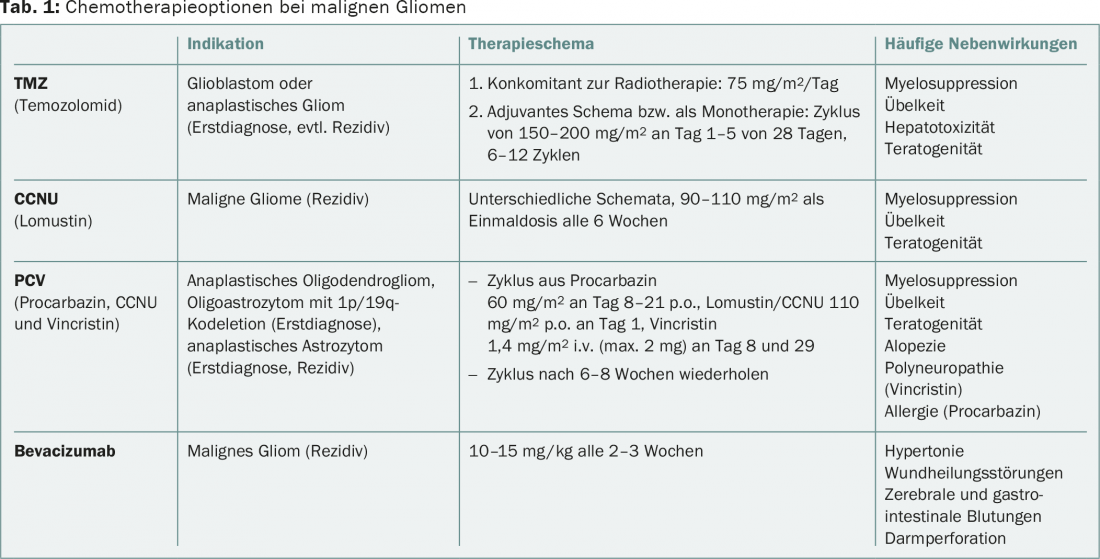
La presencia de una codeleción 1p/19q, estrictamente asociada a la mutación IDH, es crucial para la decisión terapéutica en los gliomas anaplásicos de origen oligodendroglial. Estos pacientes se benefician de una combinación de radioterapia y quimioterapia con procarbazina, lomustina (CCNU) y vincristina (régimen PCV) en el diagnóstico inicial en comparación con la radioterapia sola, según el seguimiento a largo plazo de los ensayos RTOG-9402 y EORTC-26951 [2,3]. Los datos del estudio NOA-04 muestran una eficacia igual de los regímenes con PCV resp. con temozolomida (TMZ) en gliomas anaplásicos en general. Debido a la toxicidad del régimen PCV, a menudo se prefiere la TMZ, mejor tolerada. Que la quimioterapia alquilante sola sea equivalente a la combinación directa de quimioterapia y radioterapia como terapia de primera línea es bastante improbable si se tienen en cuenta los datos disponibles. En caso de quimioterapia sola en el diagnóstico inicial, debe administrarse radioterapia en caso de progresión tumoral. Además, no existen recomendaciones terapéuticas estandarizadas para la recidiva tumoral. También pueden aplicarse las opciones para el glioblastoma (Tab. 1).
Astrocitomas anaplásicos, grado III de la OMS
Según el ensayo NOA-04, para la terapia de primera línea, la quimioterapia con TMZ o PCV seguida de radioterapia en la recaída es equivalente a la radioterapia primaria seguida de TMZ o PCV en la recaída. Para los pacientes con glioma anaplásico sin codeleción 1p/19q, el papel de la quimioterapia con TMZ además de la radioterapia en el tratamiento de primera línea se está investigando actualmente en un ensayo de fase III (ensayo CATNON). La codeleción 1p/19q, la metilación del promotor MGMT y la mutación IDH son biomarcadores pronósticos y pueden ser útiles para diferenciar los tumores oligodendrogliales (1p/19q) de los glioblastomas (IDH). Además, en los gliomas anaplásicos sin mutación IDH, un promotor MGMT metilado es predictivo de una supervivencia libre de progresión prolongada en caso de quimioterapia alquilante con o sin radioterapia. Para la recidiva tumoral tras radioterapia y quimioterapia con TMZ o PCV, no existen recomendaciones fiables; las opciones son análogas a las de la recidiva del glioblastoma.
Glioblastoma, grado IV de la OMS
Los factores pronósticos desfavorables en los glioblastomas son la edad avanzada, un mal estado Karnofsky-Perfomance-Status, un grado de resección bajo, la ausencia de mutación IDH y un promotor MGMT no metilado. La radioterapia con quimioterapia concomitante y adyuvante con TMZ, establecida desde el ensayo EORTC-NCIC, sigue considerándose como terapia de primera línea [4]. La metilación del promotor de MGMT también es predictiva de una buena respuesta a la radioquimioterapia. En el caso de los pacientes ancianos de más de 65 o 70 años sin estratificación según el perfil molecular, no se ha demostrado hasta ahora ninguna ventaja clínicamente relevante de la radioquimioterapia combinada en vista de la elevada toxicidad del régimen en los pacientes ancianos. En el caso de los pacientes ancianos con el promotor MGMT metilado, se ha demostrado un beneficio para la supervivencia con la monoterapia con TMZ en comparación con la radioterapia [5,6]. Sin conocer el estado de MGMT o en el caso de un promotor MGMT no metilado, la terapia de elección en pacientes de edad avanzada es la radioterapia sola con un protocolo hipofraccionado (10× 3,4 Gy), que es equivalente o posiblemente incluso superior a la radioterapia fraccionada convencional [6].
El bevacizumab, un anticuerpo contra el factor de crecimiento endotelial vascular (VEGF), no mostró ningún efecto sobre la supervivencia global en dos ensayos aleatorizados de fase III [7,8].
Los resultados del ensayo de fase III EF-14 se presentaron a finales de 2014. Demostró un beneficio de supervivencia de 19,6 frente a 16,6 meses con la adición de NovoTTF-100A (campos de tratamiento de tumores) a la terapia estándar [9]. La terapia consiste en la aplicación de campos eléctricos alternos en la cabeza a través de una mascarilla durante al menos 18 horas al día. El valor de NovoTTF para la terapia de primera línea del glioblastoma en la práctica clínica está siendo debatido actualmente en círculos de expertos, así como por las autoridades reguladoras.
En caso de progresión tumoral, las opciones de tratamiento son limitadas, no están estandarizadas y se basan poco en la evidencia. Una nueva resección puede ser útil en pacientes jóvenes con un buen estado general y una localización tumoral favorable. Las quimioterapias incluyen nitrosoureas como la lomustina/CCNU, TMZ de nuevo o bevacizumab (tab. 1). Encontrará más información en las directrices de la Asociación Europea de Neurooncología (EANO) [10].
Terapias de apoyo
Además de la terapia específica del tumor, el uso óptimo de corticosteroides, fármacos anticonvulsivantes y apoyo psicooncológico es muy importante para el tratamiento de los gliomas. Los esteroides (dexametasona hasta un máximo de 16 mg como dosis única por la mañana) pueden ser útiles en caso de deterioro clínico o presión intracraneal y durante la radioterapia. Para evitar efectos secundarios, debe procurarse un uso limitado en el tiempo en función de la clínica. Para la terapia anticonvulsiva, son preferibles las sustancias no inductoras de enzimas, como el levetiracetam o la lamotrigina. También es muy potente en la profilaxis de las convulsiones el ácido valproico, inhibidor enzimático, para el que también se están discutiendo efectos antitumorales directos.
Outlook
En los ensayos clínicos actuales, los enfoques inmunoterapéuticos son especialmente prometedores. Los estudios de vacunación utilizan vacunas con moléculas diana específicas del tumor, por ejemplo la variante del receptor EGFR EGFRvIII (estudio ACT-IV, fase III) o con combinaciones de antígenos asociados al tumor (estudio ICT-107 fase II), o enfoques basados en células, incluidas las células dendríticas activadas. Entre las terapias inmunomoduladoras destacan los inhibidores de la vía de señalización de la muerte programada-1 o su ligando. A pesar de los avances en la comprensión de la biología molecular del glioblastoma, es necesario seguir desarrollando terapias traslacionales de éxito para mejorar las aún limitadas opciones terapéuticas.
Literatura:
- Hartmann C, et al.: Supervivencia a largo plazo en el glioblastoma primario con y sin mutaciones de la isocitrato deshidrogenasa. Clin Cancer Res 2013; 19(18): 5146-5157.
- van den Bent MJ, et al: Quimioterapia adyuvante con procarbazina, lomustina y vincristina en oligodendroglioma anaplásico recién diagnosticado: seguimiento a largo plazo del estudio 26951 del Grupo de Tumores Cerebrales de la EORTC Journal of Clinical Oncology 2013; 31(3): 344-350.
- Cairncross G, et al: Ensayo de fase III de quimiorradioterapia para el oligodendroglioma anaplásico: resultados a largo plazo del RTOG 9402. J Clin Oncol 2013; 31(3): 337-343.
- Stupp R, et al: Radioterapia más temozolomida concomitante y adyuvante para el glioblastoma. N Engl J Med 2005; 352(10): 987-996.
- Wick W, et al: Quimioterapia con temozolomida sola frente a radioterapia sola para el astrocitoma maligno en ancianos: el ensayo aleatorizado de fase 3 NOA-08. Lancet Oncol 2012; 13(7): 707-715.
- Malmström A, et al: Temozolomida frente a radioterapia estándar de 6 semanas frente a radioterapia hipofraccionada en pacientes mayores de 60 años con glioblastoma: ensayo nórdico aleatorizado de fase 3. Lancet Oncol 2012; 13(9): 916-926.
- Chinot OL, et al: Bevacizumab más radioterapia-temozolomida para el glioblastoma de diagnóstico reciente. N Engl J Med 2014; 370(8): 709-722.
- Gilbert MR, et al: Un ensayo aleatorizado de bevacizumab para el glioblastoma recién diagnosticado. N Engl J Med 2014; 370(8): 699-708.
- Stupp R, et al: NT-40 Interim Analysis of the EF-14 Trial: A Prospective, Multi-center Trial of NovoTTF-100A Together With Temozolomide Compared to Temozolomide Alone in Patients with Newly Diagnosed GBM. Neuro-Oncología 2014; 16 (suppl 5): v167.
- Weller M, et al: Directriz de la EANO para el diagnóstico y tratamiento de los gliomas anaplásicos y el glioblastoma. Lancet Oncol 2014; 15(9): e395-403.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2015; 3(3-4): 24-27