Los sarcomas son tumores malignos poco frecuentes del tejido conjuntivo. La terapia es multidisciplinar y debe llevarse a cabo en centros de sarcoma. En Suiza, todas las disciplinas del sarcoma se han organizado a nivel nacional (www.sarcoma.ch). Aquí se publican directrices terapéuticas, se crea un registro, un estudio de cohortes y un banco de tejidos. La extirpación quirúrgica completa del tumor es la medida terapéutica más importante, tanto para los tumores óseos como para los de partes blandas. En general, la cirugía se realiza preservando la extremidad en la medida de lo posible; en el caso de los tumores óseos, la reconstrucción se realiza preferentemente con una endoprótesis (tumoral modular) o en combinación con un aloinjerto. La radioterapia se utiliza a menudo en los tumores de partes blandas, especialmente cuando el tumor es adyacente a estructuras neurovasculares para mejorar el control local. La quimioterapia sistémica aditiva, basada sobre todo en la doxorrubicina, se utiliza principalmente en el osteosarcoma, el sarcoma de Ewing, el rabdomiosarcoma y las metástasis para mejorar el pronóstico.
Los sarcomas son tumores malignos raros del tejido conjuntivo que representan el 6% de todos los cánceres infantiles [1]. Existen numerosos subtipos, más de 50 en total, que en general pueden dividirse en sarcomas óseos y de partes blandas. El osteosarcoma metafisario y el sarcoma de Ewing diafisario son los sarcomas óseos más frecuentes, mientras que el liposarcoma es uno de los sarcomas de partes blandas más comunes (Fig. 1 y 2) .
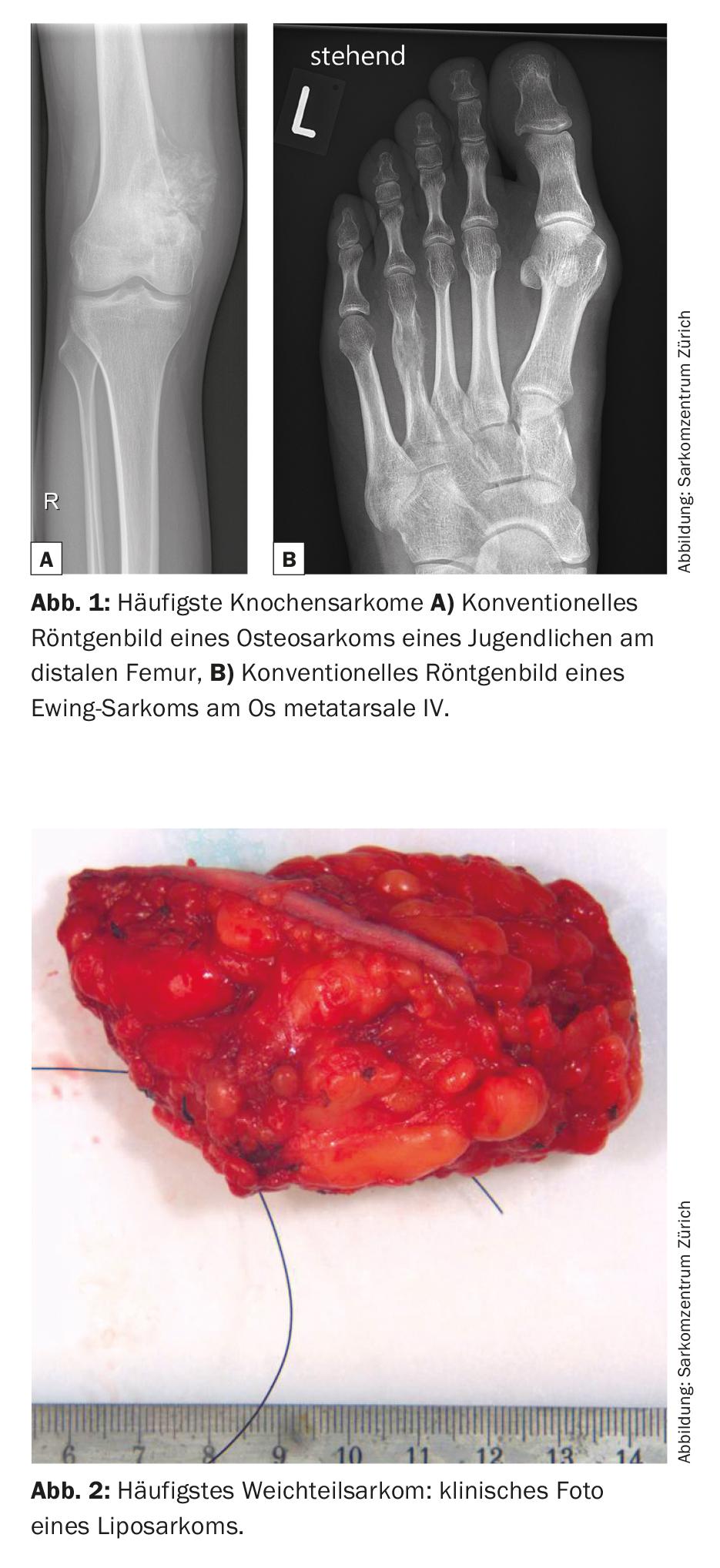
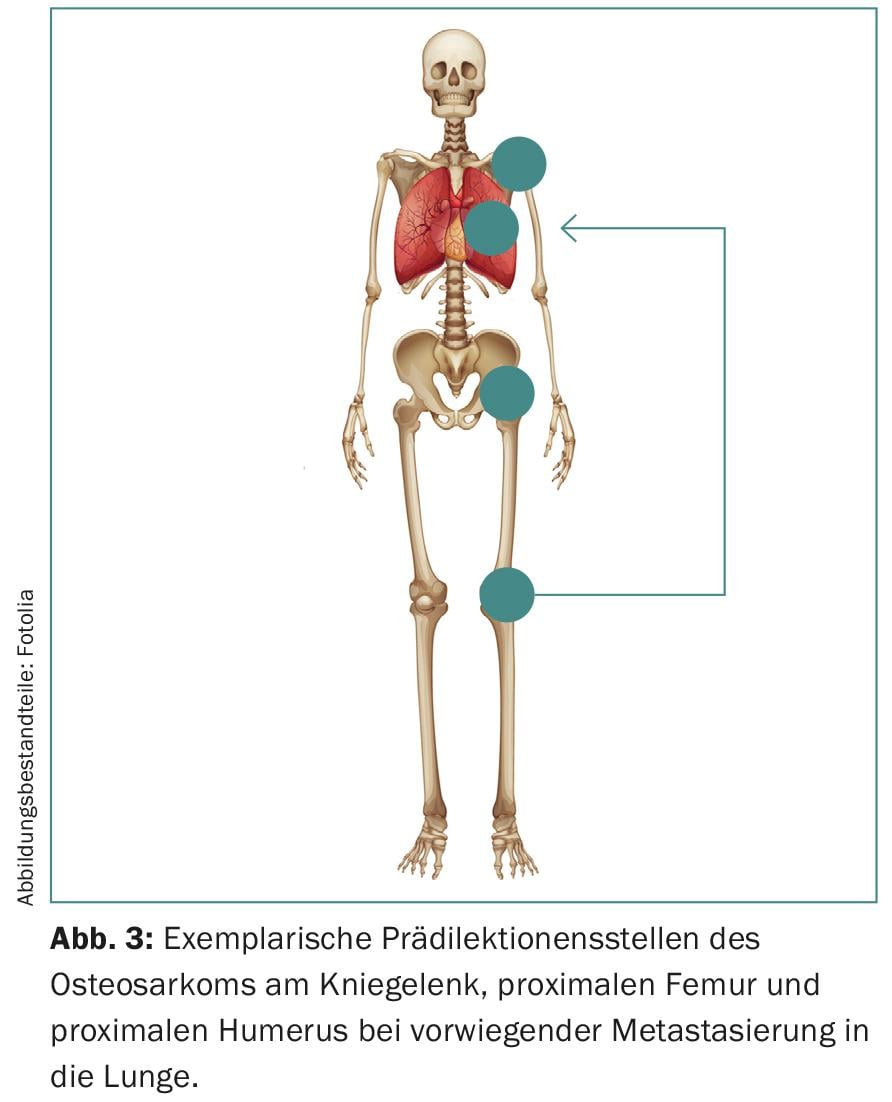
Además, los sarcomas muestran predilección por determinados grupos de edad y estructuras anatómicas (Fig. 3) . Se manifiestan con una distribución bimodal de la edad, especialmente en las extremidades y el esqueleto axial. La región de la rodilla de los adolescentes se ve particularmente afectada, aunque también pueden verse afectados la cabeza, el cuello y el abdomen.
Diagnóstico
En la mayoría de los casos, el diagnóstico se realiza a partir de un hallazgo incidental, aunque ocasionalmente puede haber inflamación y dolor. Estas últimas tienen clásicamente un carácter local y progresivo que se produce predominantemente por la noche y no pueden verse influidas por los AINE (antiinflamatorios no esteroideos) [2]. En el examen clínico, primero debe inspeccionarse y palparse localmente el tejido tumoral con la piel suprayacente y los ganglios linfáticos adyacentes. Posteriormente, la búsqueda de metástasis puede extenderse al tiroides, el abdomen, la próstata o la mama. La sintomatología B sistémica es muy rara.
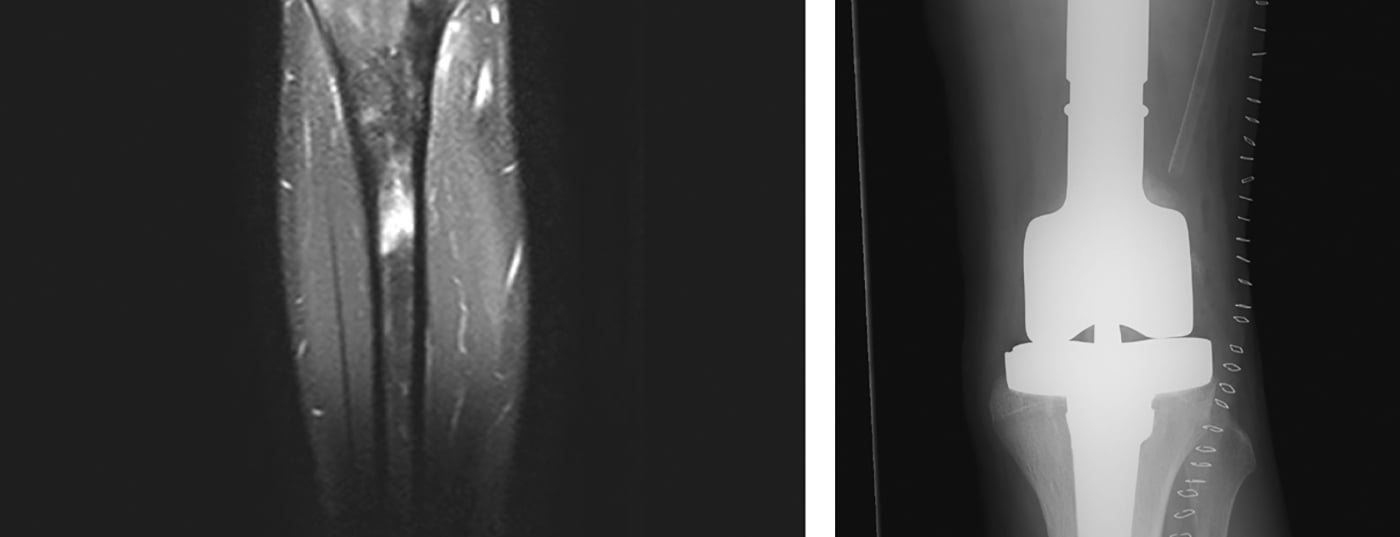
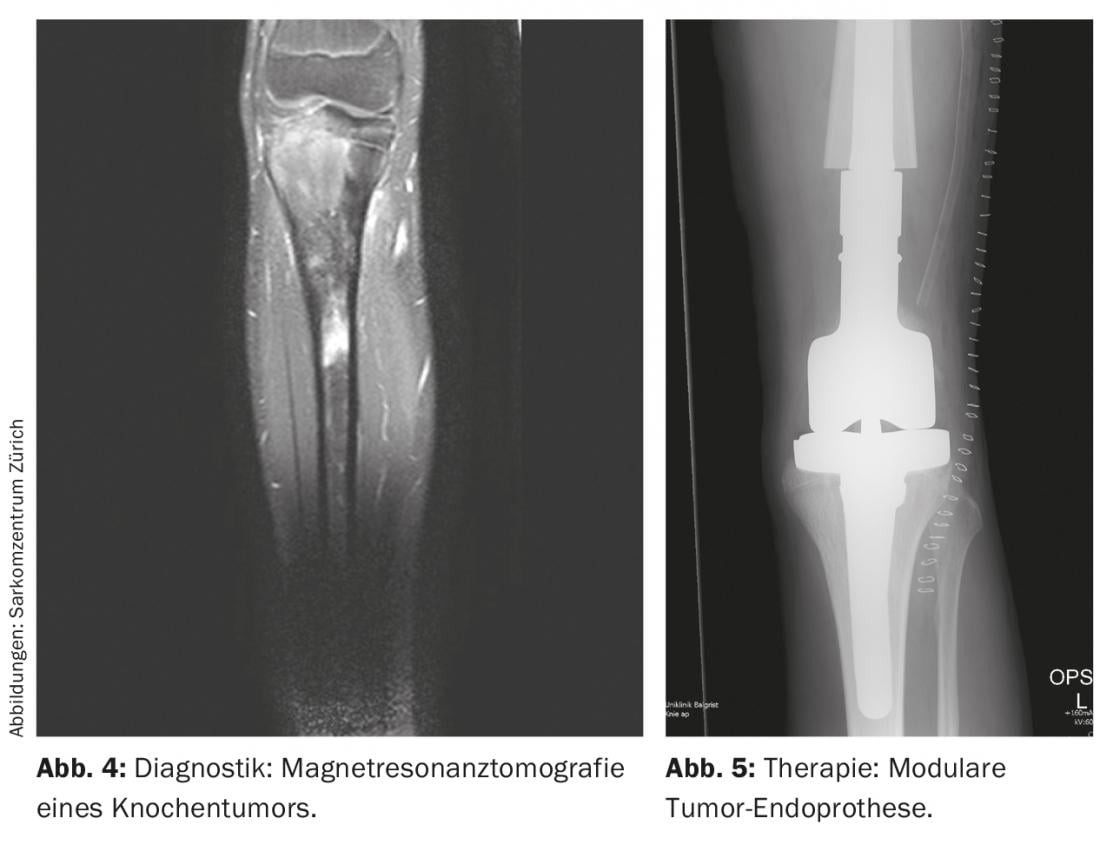
Para localizar el tumor se utilizan imágenes radiológicas, que incluyen radiografías locales y torácicas en dos planos y, si es necesario, TC (tomografía computarizada), RMN (resonancia magnética) local (Fig. 4 ) y gammagrafía esquelética sistémica con Tc (tecnecio) o, alternativamente, PET-TC. En general, debe tenerse en cuenta que las radiografías convencionales de huesos largos siempre deben mostrar las dos articulaciones adyacentes. Además, también se examinan los pulmones porque son los más frecuentemente afectados por las metástasis, en alrededor del 10% de los casos. En el momento del diagnóstico, los osteosarcomas y los sarcomas de Ewing presentan clásicamente un espolón perióstico conocido como triángulo de Codman y calcificaciones periósticas en forma de piel de cebolla. Básicamente, debe registrarse el tamaño (≤ o >10 cm), la localización (epi- o subfascial) y el estado metastásico del tumor. Además, las pruebas químicas de laboratorio rutinarias y la determinación de la deshidrogenasa láctica, así como de la fosfatasa alcalina, son útiles para excluir enfermedades generalizadas y estimar la carga de la enfermedad, aunque sean relativamente inespecíficas.
Por último, una biopsia guiada por TC o US, hoy en día a menudo mínimamente invasiva, puede proporcionar información sobre el subtipo específico de sarcoma mediante exámenes microscópicos, inmunológicos y de genética molecular. Se tiene cuidado de seleccionar el tracto de la biopsia para que pueda extirparse in toto en cualquier intervención quirúrgica posterior. Si una biopsia en sacabocados da resultados equivalentes, se realiza una biopsia abierta. Se trata de evitar los hematomas debidos al riesgo de diseminación utilizando un cierre de fascia muscular o una inserción de redón. Siempre se preparan pruebas frescas en hielo. Además, debe realizarse un examen bacteriológico para estar seguros. Por lo tanto, la administración preintervencionista de antibióticos no es aconsejable para no complicar los resultados del examen y el tratamiento orientado a la resistencia.
El bloque de tejido embebido en parafina se utiliza para la clasificación histológica, para la que existen varias posibilidades. En función de la clasificación, a continuación se realizan exámenes biológicos moleculares específicos. La estadificación en seis estadios (IA-IIIB) según Enneking (Sociedad de Tumores Musculoesqueléticos) tiene en cuenta las metástasis (no vs. sí), el grado histológico (bajo vs. alto) y el tamaño anatómico del tumor (intra vs. extracompartimental). En la estadificación algo más detallada de siete estadios (IA-IVB) de la AJCC (American Joint Commission on Cancer), se indica además la afectación de los ganglios linfáticos.
Terapia
Las terapias elaboradas en centros altamente especializados en sarcomas dan resultados relativamente buenos en el tratamiento a largo plazo de los sarcomas localizados, con tasas de supervivencia a 5 años de hasta el 75% [3]. Por el contrario, las tasas de supervivencia de los sarcomas metastásicos sólo rondan el 25%. Dado que estos resultados se han estancado desde hace más de una década, los sarcomas siguen siendo objeto de diversos proyectos internacionales de investigación para obtener una mejor comprensión genética molecular y definir así nuevas opciones terapéuticas.
La terapia requiere un equipo interdisciplinar de cirujanos ortopédicos especializados en tumores, radiooncólogos, oncólogos, radiólogos y patólogos. En función de sus entidades demográficas, cada paciente y también cada subtipo de sarcoma, de forma similar a las neoplasias hematopoyéticas, debe recibir una terapia única, multidisciplinar, a menudo multimodal, adaptada a los cambios biológicos. En general, el objetivo terapéutico curativo para los tumores localizados es la escisión quirúrgica completa del tumor. En los sarcomas óseos en particular, la quimioterapia y la radioterapia se utilizan además para reducir las (micro)metástasis y las recidivas locales. Los sarcomas de partes blandas se tratan muy a menudo con terapia combinada, con radioterapia antes o después de la cirugía. Debe considerarse un enfoque paliativo tan pronto como haya metástasis en el momento del diagnóstico, lo que afecta a alrededor del 10% de los pacientes. Las directrices para la evaluación, el diagnóstico, las opciones de tratamiento y el seguimiento han sido establecidas por la Junta Consultiva Nacional Suiza sobre Sarcomas y publicadas en el sitio web www.sarcoma.ch.
Operación
Desde su introducción hace más de 30 años, la extirpación quirúrgica completa del tumor se ha erigido como la opción terapéutica más importante (Fig. 2), y presenta la mejor “respuesta terapéutica” de todas las modalidades de tratamiento. En particular, puede utilizarse como terapia singular para tumores pequeños (<5 cm), completamente extirpados y de bajo grado de los tejidos blandos [4]. La naturaleza del margen de resección es fundamental para la tasa de recidiva, que es del 100% para un margen intralesional, <50% para un margen marginal y <10% para un margen amplio (>1 cm). Si no se consigue la extirpación completa del tejido tumoral en la cirugía primaria, debe considerarse la cirugía secundaria en términos de posresección en lugar de sustituirla por otras opciones terapéuticas. Además, la metastasectomía curativa sigue siendo controvertida.
La elección del método quirúrgico más adecuado se basa principalmente en la clasificación y la localización del tumor. Por regla general, siempre que sea posible, se prefieren las técnicas quirúrgicas de conservación del miembro. Estos incluyen la resección tumoral inicial en bloque y la reconstrucción posterior. El objetivo es lograr una resección tumoral equivalente a la amputación clásica, preservando al mismo tiempo la función de la forma más fisiológica posible. En cuanto a las localizaciones tumorales axiales, la navegación guiada por TC puede ser útil para preservar estructuras neurovasculares importantes, especialmente en operaciones pélvicas difíciles. Sin embargo, el pronóstico de los tumores axiales es peor que el de los de las extremidades debido a su difícil resecabilidad [5].
Normalmente, se utilizan aloinjertos y/o endoprótesis modulares (tumorales) (Fig. 5) [6]. En los últimos años, los aloinjertos están más disponibles a través de los bancos de hueso, proporcionan un manto de tejido blando adecuado y conducen a la osteointegración en el organismo al cabo de varios años. Sin embargo, no sólo existe un mayor riesgo de fractura, sino también de pseudoartrosis debido a la osificación de la zona injerto-huésped, que dura hasta un año. Las endoprótesis se utilizan principalmente para los tumores metafisarios con resección articular y/o epifisaria necesaria para preservar la amplitud de movimiento y compensar las diferencias de longitud de las piernas. Ofrecen la ventaja de un soporte de peso completo postoperatorio relativamente rápido con una buena amplitud de movimiento. Sin embargo, existen las desventajas habituales de las dentaduras postizas, que pueden aflojarse en aproximadamente el 5-10% de los pacientes. En este sentido, muestran unas tasas de supervivencia a 5 y 10 años de aproximadamente el 80% y el 70%, respectivamente. Un compuesto protésico de aloinjerto ofrece la ventaja de un mejor anclaje de los tejidos blandos con menos riesgo de aflojamiento en comparación con la implantación de prótesis sola y, por lo demás, es capaz de combinar las demás ventajas e inconvenientes de ambos métodos.
La amputación se realiza en menos del 10% de los casos y hoy en día se utiliza como último recurso, ya que no conlleva mejores tasas de supervivencia que la cirugía conservadora de extremidades realizada adecuadamente [7]. Es una opción terapéutica válida especialmente para las recidivas no reconstruibles que afectan a las estructuras neurovasculares y, por tanto, limitan la función. A este respecto, la protetización actual ofrece buenas y diversas posibilidades, sobre todo para los muñones de amputación lo más distales posible. Además, una plastia inversa Van Ness es una amputación intercalar de acortamiento de extremidad en la que la parte inferior de la pierna, incluido el pie, se fija a la extremidad proximal. Esto permite que la articulación superior del tobillo asuma la función de la articulación de la rodilla y controle mejor una prótesis.
Quimioterapia
La quimioterapia sistémica puede administrarse de forma concomitante con la cirugía, en el preoperatorio, en el postoperatorio o en ambos, dependiendo del tipo de tumor. Suele consistir en una combinación basada en la doxorrubicina [8], mediante la cual la doxorrubicina interfiere en la síntesis del ADN como intercalante y provoca la apoptosis a través de la formación de radicales libres. En el caso del osteosarcoma, suele consistir en varios ciclos de doxorrubicina, metotrexato y cisplatino. Además de los osteosarcomas, los sarcomas de Ewing, los rabdomiosarcomas y las metástasis suelen tratarse con quimioterapia. Sin embargo, su efecto terapéutico y, por tanto, pronóstico es controvertido, especialmente en los sarcomas de tejidos blandos. Debido a los efectos secundarios no despreciables, como la nefro o la cardiotoxicidad, debe realizarse un análisis beneficio-riesgo en cada caso individual. Además, la aplicación se realiza mejor en el contexto de los ensayos clínicos.
Puede administrarse de forma preoperatoria, neoadyuvante, o postoperatoria, adyuvante, durante unos siete meses. La ventaja del uso neoadyuvante es la reducción de la masa tumoral, el tratamiento de micrometástasis radiológicamente invisibles y la relevancia pronóstica. Las micrometástasis se encuentran hasta en el 80% de los casos, especialmente en los osteosarcomas. El pronóstico depende crucialmente de la respuesta a la quimioterapia y se refleja en la tasa de necrosis histológica (≥90% = buena frente a <90% = mala) según Salzer-Kuntschik.
Radioterapia
La radioterapia es otra opción de tratamiento, especialmente para los sarcomas de tejidos blandos. Puede reducir la tasa de recurrencia, que es inferior al 10%. Aún no está claro si esto también influye en la formación de metástasis y en el pronóstico. Se utiliza principalmente para sarcomas grandes, profundos, de alto grado, incompletamente extirpados, neurovasculares, de tejidos blandos y metastásicos [9]. Generalmente, provoca roturas tóxicas de la doble cadena del ADN celular (ácido desoxirribonucleico) a través de los radicales libres y, por tanto, la apoptosis. A menudo se prefiere el uso preoperatorio. Por un lado, esto permite una dosis terapéutica más baja, de unos 50 Gy (Gray), debido al contorno más detallado y al menor volumen, y por otro, se puede conseguir un mejor resultado funcional a largo plazo. Sin embargo, también existe un mayor riesgo de trastornos postoperatorios reversibles en la cicatrización de las heridas. El uso de adyuvantes, por otro lado, conduce más a menudo a complicaciones tardías irreversibles como linfoedema, fibrosis, rigidez articular, fracturas por estrés y sarcomas post-radiación, por lo que es mejor evitarlos.
Otras opciones de tratamiento
Además de las terapias estándar establecidas ya mencionadas, existen otras opciones terapéuticas cuya eficacia o superioridad aún no se ha demostrado suficientemente en ensayos controlados aleatorios. Entre ellos se incluyen la hipertermia regional local, la perfusión de extremidades hipertérmica aislada, la infusión de extremidades aislada y la braquiterapia local basada en catéter, y sistémicamente los anticuerpos monoclonales, los bifosfonatos, la terapia con células madre y la nanotecnología (fotodinámica) [10].
Controles de seguimiento
Además del seguimiento clínico inicial, que difiere según el procedimiento, el primer seguimiento clínico-radiológico, que incluye un examen radiológico, tiene lugar tres meses después de la operación. Radiografía convencional local y examen por resonancia magnética de la zona tumoral, así como un TAC torácico para excluir metástasis (véase también www.sarcoma.ch). Dado que la mayoría de las recidivas o metástasis tardías se producen en los dos o tres primeros años, en este momento se realizan visitas de seguimiento cada tres meses, antes de que tengan lugar consultas semestrales hasta los cinco años de seguimiento. Posteriormente, el esquema se adapta a controles de uno a dos años.
Conflicto de intereses: Los autores declaran que no existe ningún conflicto de intereses.
Literatura:
- HaDuong JH, et al: Sarcomas. Pediatr Clin North Am 2015; 62: 179-200
- Miller MD, et al. Revisión de ortopedia.6ª ed. Filadelfia, PA: Elsevier Saunders 2012; 623-674.
- Kager L, et al: Osteosarcoma metastásico primario: presentación y resultados de pacientes tratados con protocolos neoadyuvantes del Cooperative Osteosarcoma Study Group. J Clin Oncol 2003; 21: 2011-2018.
- Ferrone ML, Raut CP: Terapia quirúrgica moderna: salvamento de la extremidad y papel de la amputación en los sarcomas de tejidos blandos de las extremidades. Surg Oncol Clin N Am 2012; 21: 201-213.
- Jentzsch T, et al.: Expresión de MSH2 y MSH6 en una micromatriz tisular en pacientes con osteosarcoma. Anticancer Res 2014; 34: 6961-6972.
- Moore DD, Luu HH: Osteosarcoma. Cancer Treat Res 2014; 162: 65-92.
- Grimer RJ, et al: Resultados quirúrgicos en el osteosarcoma. J Bone Joint Surg Br 2002; 84: 395-400.
- Whelan JS, et al: EURAMOS-1, un estudio internacional aleatorizado para el osteosarcoma: resultados del tratamiento previo a la aleatorización. Ann Oncol 2015 feb; 26(2): 407-414.
- Yang JC, et al: Estudio prospectivo aleatorizado del beneficio de la radioterapia adyuvante en el tratamiento de los sarcomas de partes blandas de la extremidad. J Clin Oncol 1998; 16: 197-203.
- Wunder JS, et al: Oportunidades para mejorar la relación terapéutica de los pacientes con sarcoma. Lancet Oncol 2007; 8: 513-524
InFo ONCOLOGÍA Y HEMATOLOGÍA 2015; 3(5): 18-21