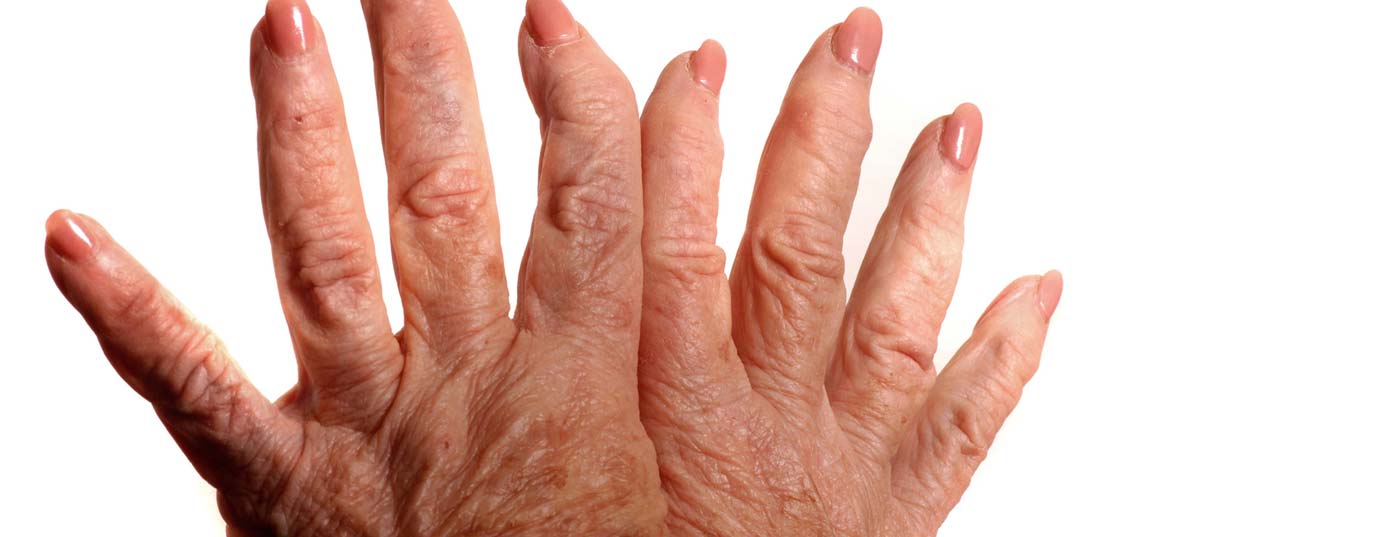
El Prof. Dr. med. Paul Hasler, Jefe de Reumatología del Hospital Cantonal de Aarau, habló sobre la nueva aprobación de baricitinib en la indicación de AR activa de moderada a grave con HAUSARZT PRAXIS. ¿Dónde encaja el nuevo principio activo en el ya amplio espectro de terapias? Además, se debatieron las novedades del congreso EULAR de este año y las investigaciones que probablemente ocuparán al mundo profesional en el futuro.
Profesor Hasler, ¿cuál es el tratamiento estándar actual para la artritis reumatoide (AR)? ¿Cómo encaja en el espectro terapéutico el baricitinib, un inhibidor de la cinasa Janus aprobado recientemente en esta indicación, y con qué régimen terapéutico se utiliza?
Prof. Dr. Hasler:
Para el diagnóstico y la clasificación se utilizan los criterios ACR/EULAR revisados de 2010 [1]. Éstas pretenden ofrecer una sensibilidad y una especificidad relativamente altas incluso en las primeras fases de la artritis; sin embargo, la precisión diagnóstica disminuye de forma natural en las primeras fases en comparación con las últimas. Básicamente, cuanto antes empiece el tratamiento, mejor. Así que el objetivo es detectar, diagnosticar y tratar la enfermedad lo antes posible.
Según el algoritmo EULAR [2], se empieza primero con el preparado estándar metotrexato (MTX) o con terapias básicas comparables como la leflunomida, menos sulfasalazina o hidroxicloroquina. Existen diferentes preferencias entre los reumatólogos en cuanto a la combinación de estos agentes; en la AR grave, por ejemplo, es posible una combinación triple de MTX, sulfasalazina e hidroxicloroquina (si es necesario, combinada con prednisona).
Sin embargo, uno procede: después de tres meses de terapia inicial, ya debería haber una buena respuesta. La consecución del objetivo terapéutico real, es decir, la “ausencia de actividad de la enfermedad” (es decir, la “remisión”) debe comprobarse al cabo de seis meses. Según el caso, el objetivo también puede ser la máxima mejoría de acuerdo con el paciente, es decir, la menor actividad posible de la enfermedad con una terapia tolerable (si la remisión parece improbable).
Si no se alcanza el objetivo de la terapia, hay que buscar una alternativa. Si la primera terapia básica no ha funcionado lo suficiente o no se ha tolerado, puede realizarse una combinación o un cambio. También existe la opción de utilizar un biológico o un inhibidor de JAK [2].
Siempre que sea posible, el MTX sigue utilizándose de forma concomitante, ya que potencia significativamente el efecto de los inhibidores del TNF, la inhibición de la coestimulación con abatacept y la terapia contra las células B con rituximab en particular. Aunque esto es menos pronunciado con los inhibidores de JAK y con la inhibición de IL con tocilizumab, en este caso también se recomienda la combinación con MTX. Los pacientes que antes toleraban bien el MTX pero para los que éste tenía un efecto insuficiente pueden beneficiarse de dicha combinación. Si no se tolera el MTX, por ejemplo, puede utilizarse tocilizumab o baricitinib como monoterapia. En este caso, los datos son significativamente mejores que con la monoterapia con los inhibidores del TNF tradicionales (aunque los registros muestran que un porcentaje considerable de pacientes también responden bien con la monoterapia con inhibidores del TNF).
¿Qué pacientes se beneficiarán más de la nueva aprobación?
Por un lado, los pacientes que no desean ninguna inyección o no desean ninguna inyección además del MTX, es decir, prefieren una terapia oral (una vez al día en el caso del baricitinib). Por otro lado, aquellos que no mejoraron lo suficiente con MTX o que no respondieron a los biológicos (o al inhibidor de JAK tofacitinib, aprobado desde hace tiempo).
La dosis habitual de baricitinib es de 4 mg/día. En caso de insuficiencia renal con un aclaramiento entre 30 y 60 ml/min/1,73 m2 o si el paciente presenta riesgo de infección (infecciones crónicas o recurrentes), se recomienda la dosis reducida de 2 mg/día. Además, también se puede considerar bajar la dosis a 2 mg/día a modo de prueba si hay una remisión más prolongada con la dosis más alta (más quizás MTX concomitante). Porque en última instancia, como en todas partes en medicina, el cumplimiento del paciente es un factor muy decisivo para el éxito de la terapia.
¿Cuál es el principio de acción y la situación de los estudios clínicos en el campo de los inhibidores de la Janus quinasa (o qué otros representantes de esta clase de agentes activos existen)?
El efecto sobre la hematopoyesis, la inflamación y la función inmunitaria se debe a la inhibición de las Janus quinasas (son cuatro, JAK 1, 2, 3 y TYK 2). Además de la AR, los inhibidores de JAK también se están investigando en otras enfermedades que responden a estos mecanismos de acción, desde la psoriasis y la artritis psoriásica hasta la espondiloartritis seronegativa y las colagenosis.
Otro inhibidor de la quinasa Janus es el tofacitinib. El baricitinib y el tofacitinib se excretan por vía renal, el tofacitinib también se metaboliza hepáticamente. Personalmente, comprobaría la formación de sangre y los valores hepáticos en ambos representantes (entre otras cosas, para comprobar si los granulocitos neutrófilos están reducidos). Se ha informado de que los dolores de cabeza son menos frecuentes con baricitinib que con tofacitinib. La situación del estudio del baricitinib también parece muy prometedora en lo que respecta a los efectos secundarios hepáticos.
Existen varios ensayos de fase III de baricitinib que abarcan poblaciones clave de AR. Entre ellos se incluyen los pacientes sin MTX o con sólo dosis bajas de MTX o terapéutica básica convencional [3], y los que no respondieron o no toleraron los biológicos además del MTX [4,5].
¿Contra qué agentes se comparó el baricitinib y en qué criterios de valoración clínicos demostró su éxito?
El baricitinib se comparó con placebo, MTX, el inhibidor del TNF adalimumab y tras el fracaso de varios biológicos de diferentes mecanismos de acción [3–5]. El criterio de valoración primario en cada caso fue la respuesta ACR20. Algunos datos: Por ejemplo, el baricitinib de 4 mg fue superior a la monoterapia con MTX después de 24 semanas (77 frente a 62%; p≤0,01) [3]. Con los DMARD convencionales de fondo, funcionó mejor que el placebo (en la dosis de 4 mg, 55 frente a 27%, p<0,001 y 70 frente a 40%, p<0,001) [4,5] y el adalimumab (70 frente a 61%, p=0,014) [4] tras 12 semanas. Además, se encontraron beneficios en varios criterios de valoración secundarios, por ejemplo, DAS28-CRP.
¿Cómo evalúa el perfil de seguridad?
Considero que el perfil de seguridad es bueno; no hay señales de seguridad decisivas que hagan que la gente se siente y tome nota. Por supuesto, habrá que hacer un seguimiento de los datos a largo plazo de los estudios de extensión actualmente en curso. Se aplica a todos los preparados: Especialmente con respecto a las infecciones, que pueden brotar de repente y agravarse, hay que estar muy atento. Pueden producirse diverticulitis y perforaciones, sobre todo en la población anciana con AR. Las vacunas deben mantenerse al día, se recomienda la vacunación anual contra la gripe. En caso de zoster, la terapia antiviral debe iniciarse inmediatamente (es decir, los pacientes deben ser informados convenientemente para poder reaccionar con rapidez incluso en caso de pródromos).
Hasta el momento, no existen pruebas de que los aumentos de los parámetros lipídicos observados con otros agentes para la AR, como el tofacitinib y los anti-TNF, cursen con un aumento de los acontecimientos adversos cardiacos mayores (MACE). Los parámetros lipídicos deben determinarse en consecuencia y los pacientes deben ser tratados según las directrices para la hiperlipidemia.
¿Hubo algún otro hallazgo importante en el campo de la artritis reumatoide en el Congreso EULAR 2017, que tuvo lugar en Madrid en junio?
Por ejemplo, se debatió el estado de la investigación en el campo de los biosimilares, que, al igual que los biológicos, han experimentado entretanto un gran desarrollo. Sin embargo, su introducción es todavía bastante tímida; primero deben demostrar su valía en la práctica clínica diaria y en estudios posteriores a la comercialización. Hasta ahora, los datos sobre el cambio de un preparado original a un biosimilar correspondiente son limitados – el llamado estudio NOR-SWITCH [6] fue el tema de debate en el congreso, y habrá más. El margen de no inferioridad se definió como el 15% en NOR-SWITCH. La pregunta ahora es: si la enfermedad apenas se controla con el fármaco originario, ¿perderemos el control con el biosimilar a la misma dosis?
Además, hay otros inhibidores de JAK en desarrollo, espero que en unos años dispongamos de una amplia gama de estos agentes.
¿Dónde ve los futuros campos de investigación?
Desde el punto de vista epidemiológico, el profesor Axel Finckh de Ginebra, entre otros, está llevando a cabo interesantes enfoques que investigan la influencia del tabaquismo, la contaminación atmosférica y las infecciones víricas/bacterianas en el desarrollo y la evolución de la enfermedad.
En el futuro, puede que también sea posible conseguir buenos resultados en el tratamiento influyendo en los granulocitos neutrófilos. Un pionero en este campo de investigación es el profesor Gerd Burmester, de Berlín. Actualmente se están probando anticuerpos apropiados contra el GM-CSF y el G-CSF (factores estimulantes de colonias de granulocitos [macrófagos]). El GM-CSF y el G-CSF desempeñan un papel clave en la activación de los neutrófilos. La cuestión aquí será cómo pueden combinarse estos anticuerpos con otros agentes como el MTX o la leflunomida sin poner en riesgo a los pacientes, y cómo pueden detectarse con antelación los cursos graves para justificar dicha terapia.
Entrevista: Andreas Grossmann
Literatura:
- Aletaha D, et al: 2010 rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis 2010; 69(9): 1580-1588.
- Smolen JS, et al: Recomendaciones de la EULAR para el tratamiento de la artritis reumatoide con fármacos antirreumáticos modificadores de la enfermedad sintéticos y biológicos: actualización de 2016. Ann Rheum Dis 2017; 76(6): 960-977.
- Fleischmann R, et al: Baricitinib, metotrexato o combinación en pacientes con artritis reumatoide y tratamiento previo nulo o limitado con fármacos antirreumáticos modificadores de la enfermedad. Artritis y Reumatología 2017; 69(3): 506-517.
- Taylor PC, et al: Baricitinib frente a placebo o adalimumab en la artritis reumatoide. N Engl J Med 2017; 376: 652-662.
- Genovese MC, et al: Baricitinib en pacientes con artritis reumatoide refractaria. N Engl J Med 2016; 374: 1243-1252.
- Jørgensen KK, et al: Cambio del infliximab originario al biosimilar CT-P13 en comparación con el tratamiento mantenido con infliximab originario (NOR-SWITCH): un ensayo aleatorizado, doble ciego y de no inferioridad de 52 semanas de duración. Lancet 2017; 389(10086): 2304-2316.
PRÁCTICA GP 2017; 12(8): 8-9