La enfermedad de Hodgkin pertenece al grupo de los linfomas malignos y se manifiesta por una inflamación indolora de los ganglios linfáticos, que muy a menudo se encuentran primero en el cuello o detrás del esternón. Incluso en fases avanzadas, el tratamiento puede seguir siendo eficaz.
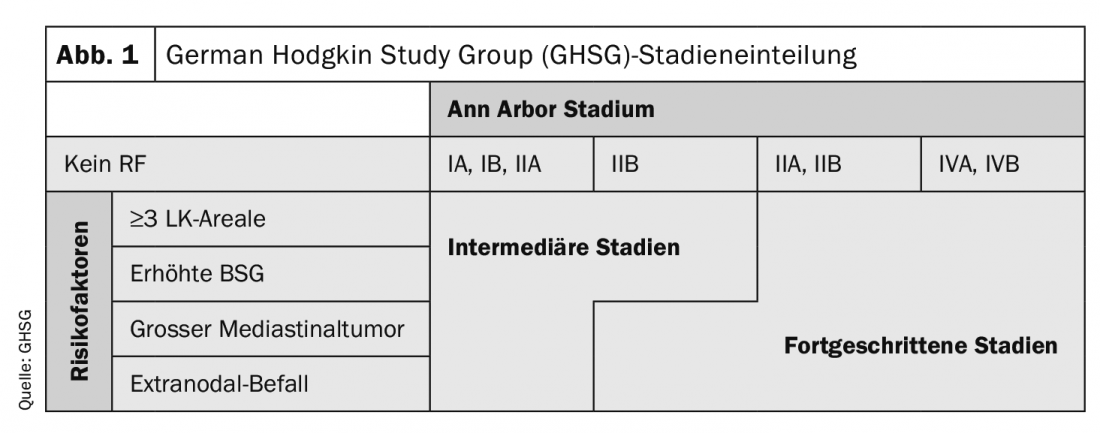
Además de los estadios de Ann Arbor, los pacientes con linfoma de Hodgkin (LH) también se clasifican en función de sus factores de riesgo en estadios iniciales, intermedios y avanzados (Fig. 1). El tipo y la intensidad de la terapia dependen del estadio presente. En la actualidad, la PET también puede utilizarse para la estadificación inicial, lo que supone una ventaja muy clara sobre la tomografía computarizada con contraste en cuanto a la sensibilidad para detectar la afectación de la médula ósea.
Estrategia CMT en una fase temprana
La terapia estándar para el LH en fase inicial es la estrategia de tratamiento de modalidad combinada (TMC). La quimioterapia se administra en 2-4 ciclos y la dosis de radiación oscila entre 20 Gy y 30 Gy en función del estadio exacto. En la actualidad, se recomienda la terapia in situ (IS-RT), aunque todavía no se dispone de datos de estudios prospectivos. Aquí los campos están claramente más circunscritos. Por regla general (>90%), el LH se manifiesta de forma supradiafragmática, por lo que los campos de radiación suelen incluir el corazón, los grandes vasos, la glándula tiroides o el tejido pulmonar y mamario. “Debido a los posibles efectos secundarios a largo plazo de la radioterapia, incluidos los cardiovasculares (cardiopatía coronaria e infarto de miocardio, insuficiencia cardiaca) y oncológicos (carcinoma de mama, cáncer de pulmón), esta modalidad de terapia está siendo cuestionada, especialmente por los hematólogos”, opinó Borchmann. Por otro lado, la radioterapia de consolidación permite, por ejemplo en las fases iniciales, reducir la quimioterapia a sólo 2 ciclos de ABVD, con lo que se requiere un mínimo de intensidad de ambas modalidades para un control óptimo del linfoma. Los datos a largo plazo publicados en 2017 de los estudios del GHSG en estadios tempranos con un seguimiento de unos 10 años no han mostrado un aumento relevante de la incidencia de neoplasia secundaria, por lo que con las pruebas disponibles no hay motivo para desviarse del concepto de “modalidad combinada”.
Otra opción es mejorar el régimen ABVD añadiendo nuevas sustancias. “En este sentido, el brentuximab vedotin ha sido la sustancia más prometedora con una buena relación beneficio-riesgo como monoterapéutico en los últimos años”, informó el experto. Como la bleomicina se incluye en el régimen ABVD más por razones históricas y tiene una eficacia baja con una toxicidad relevante, esta sustancia se sustituyó por brentuximab vedotin (BV+AVD). En el estudio participaron 170 pacientes con una edad media de 29 años. El criterio de valoración primario fue la tasa de pacientes con PET-2 negativo, que es del 75% con ABVD solo y debería ser del 85% con el nuevo régimen, excluyendo una tasa de PET-2 negativo de <75%. Tras 2 ciclos de tratamiento, 93/113 pacientes (82,3%, IC del 95%: 75,3-88,0) y 43/57 (75,4%, IC del 95%: 64,3-84,5) obtuvieron un TEP negativo basado en la revisión central en los brazos experimental y estándar, respectivamente. Con un límite inferior del intervalo de confianza del 95% superior al 75% (en realidad fue del 75,4%) en el brazo experimental, el objetivo principal puede considerarse cumplido. Sin embargo, durante los dos primeros ciclos, se documentaron acontecimientos de grado 3 o 4 en el 74% de los pacientes del brazo BV-AVD y en el 56% del brazo ABVD. Los autores concluyen que la tasa de negatividad de la PET-2 con BV-AVD está dentro del rango objetivo, pero esto se asocia a una toxicidad significativamente mayor con el tratamiento con BV-AVD en comparación con ABVD incluso durante los dos primeros ciclos de tratamiento.
¿Los anticuerpos PD1 también son adecuados en primera línea?
El anticuerpo PD1 nivolumab está aprobado para el linfoma de Hodgkin clásico (LHc) recidivante o refractario y presenta una elevada tasa de respuesta global (TRO) y un perfil de seguridad favorable. Para evaluar la eficacia del nivolumab en combinación con doxorrubicina, vinblastina y dacarbazina (AVD) como tratamiento de primera línea para el LH clásico intermedio (LHc), se llevó a cabo un estudio prospectivo y aleatorizado de fase II. El tratamiento incluyó a pacientes con LHc en estadios intermedios sin tratamiento previo. Los pacientes del brazo A recibieron 240 mg de nivolumab y AVD en dosis estándar los días 1 y 15 de cada ciclo de 28 días durante un total de cuatro ciclos (4× NivoAVD). En el brazo B, se administró el mismo tratamiento de forma secuencial, comenzando con 4× nivolumab con 2 semanas de intervalo, seguido de 2× NivoAVD y 2× AVD. Ambos grupos recibieron 30 Gy de radioterapia in situ comprometida (IS-RT). El criterio de valoración primario fue la tasa de RC basada en PET/TC tras la finalización de la terapia del protocolo, incluida la IS-RT.
Los resultados mostraron que se registraron acontecimientos adversos (AA) en el 98% de los pacientes. Se produjeron acontecimientos adversos de grado 3 ó 4 en el 73% y el 78% de los casos, respectivamente, y se observaron EA graves en el 38% y el 28% de los pacientes, respectivamente. Tras completar la terapia sistémica, la ORR fue del 100% (54/54) y del 98% (50/51) con tasas de RC del 81% y el 86%, respectivamente. “El estudio muestra una tasa de RC inesperadamente alta tras la monoterapia con nivolumab en el LHc de primera línea en estadio intermedio”, afirmó Borchmann. “La elevada y muy rápida tasa de RC alcanzada tras la terapia combinada de nivolumab y AVD sugiere un sinergismo de los diferentes principios terapéuticos”. Los autores del estudio creen que en estadios intermedios, la terapia concurrente o secuencial con nivolumab y AVD es posible con una toxicidad aceptable.
Tratar eficazmente los estadios avanzados
La afectación diseminada de los ganglios linfáticos o la afectación de órganos, es decir, los estadios III o IV según Ann-Arbor, se consideran estadios avanzados del linfoma de Hodgkin. La norma internacional es de seis a ocho ciclos de ABVD seguidos de radioterapia consolidativa en tumores iniciales masivos o residuales de más de 1,5 cm de diámetro, aunque la radioterapia guiada por PET también se utiliza con frecuencia en este caso en la práctica clínica sin pruebas procedentes de estudios prospectivos. “Sin embargo, desde la publicación del GHSG HD15, seis ciclos de BEACOPPescalada seguidos de radioterapia han sido estándar en el GHSG para pacientes con tumores residuales positivos para PET de más de 2,5 cm”, señaló el experto. Con este enfoque se consigue una supervivencia global del 95% a los cinco años, lo que no se había descrito antes en ningún otro estudio en todo el mundo. Pero también hay críticas: el régimen BEACOPPescalado conduce al sobretratamiento de todos aquellos pacientes que también podrían haberse curado con una terapia menos intensiva como la ABVD. Esto supone aproximadamente 2/3 de todos los pacientes. “Sin embargo, un metaanálisis ha vuelto a confirmar ahora que una gran diferencia de SLP se traduce en una diferencia de supervivencia al cabo de sólo 4-5 años, que a su vez se hace mayor al aumentar el tiempo de seguimiento. El beneficio para la supervivencia (10%) de 6 ciclos de BEACOPPescalada a 5 años en comparación con ABVD hallado en el metaanálisis en red no sólo está respaldado por las mejores pruebas posibles, sino que también es muy relevante desde el punto de vista clínico”, concluyó el ponente.
Fuente: “LLC y linfoma de Hodgkin”, presentación en OnkoUpdate 2020, 29-30.01.2020 Berlín (D)
InFo ONCOLOGY & HEMATOLOGY 2020; 8(1): 26-27 (publicado el 25.2.20, antes de impresión).