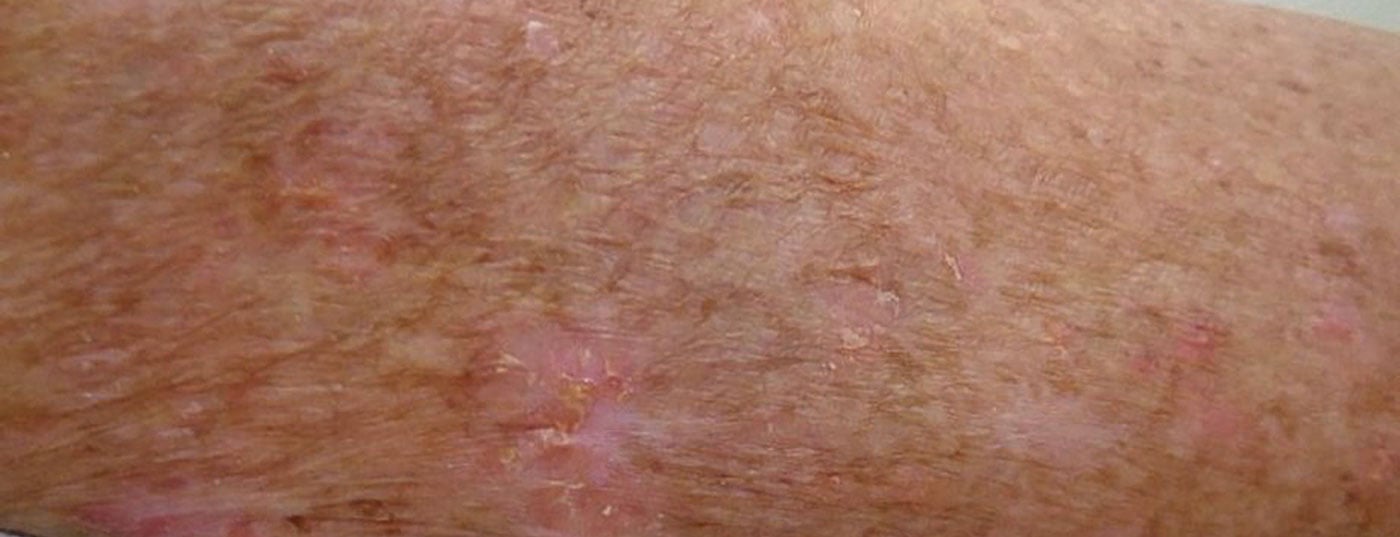
La prevalencia de los enfermos actuales de queratosis actínica (QA) en la población aumenta con la edad. Dependiendo de la exposición a los rayos UV, el desarrollo de la QA es relevante a partir de los 40 años. En Australia, hasta el 60% de este grupo de edad está afectado; en latitudes europeas, puede suponerse entre el 15 y el 30%. Cabe esperar un número del 70% de pacientes de 70 años afectados por una QA, desde una QA aislada hasta una cancerización de campo.
La prevalencia, como tasa de enfermos actuales en la población, aumenta con la edad. Dependiendo de la exposición a los rayos UV, el desarrollo de queratosis actínicas (QA) es relevante a partir de los 40 años. En Australia, hasta el 60% de este grupo de edad está afectado, en Europa se estima que es del 15-30% [1]. Cabe esperar un número del 70% de pacientes de 70 años afectados por una QA, desde una QA aislada hasta una cancerización de campo.
La incidencia, como medida de nuevos casos en un año, es dada por el Instituto Robert Koch como 229.750 nuevos casos para 2016. La incidencia de la enfermedad en 2844 pacientes consecutivos atendidos en consultas generales suizas fue del 25% [2]. Así pues, la QA es uno de los diagnósticos más frecuentes en dermatología y vincula a pacientes y médicos en una asociación para el tratamiento. En este contexto, son necesarias la educación, la prevención y las terapias específicas.
Patogénesis
La causa básica es el daño inducido por los rayos UV en los queratinocitos de la epidermis. Constitucionalmente, los tipos de piel I y II favorecen el desarrollo de la QA. Otras predisposiciones adquiridas son las quemaduras solares en la infancia y la exposición acumulativa a los rayos UV. Los posibles daños moleculares relacionados con los rayos UV se explican en una revisión reciente [1].
Hasta ahora, se han identificado como causas genéticas las mutaciones de p53 y las mutaciones del oncogén ras. El p53 interviene en el control del ciclo celular. Las mutaciones de p53 impiden una apoptosis necesaria. Se asume la implicación de p53 en la génesis de la QA hasta en un 80% de los casos. La inmunosupresión, inducida o no por fármacos, también contribuye a aumentar el desarrollo de la QA.
En un estudio reciente en el que se utilizó la secuenciación de próxima generación, los virus del papiloma humano (VPH) beta, que anteriormente se habían destacado como prominentes, no mostraron ser significativamente importantes en la QA en comparación con la piel normal, pero los tipos gamma1-HPV4 se enriquecieron significativamente en la QA. Las afirmaciones sobre la persistencia del virus, las variaciones incluso de nuevos tipos de VPH, etc. en función de la localización siguen siendo insuficientes.
Se ha demostrado que tomar hidroclorotiazida multiplica por 1,2 el riesgo de carcinoma de células basales (CCB) y por 4 el de carcinoma de células escamosas (CEC). En un estudio de casos y controles de 400 pacientes con enfermedades cardiovasculares, no hubo correlación de la QA con los diuréticos tiazídicos [3].
Clasificaciones
La clasificación clínica generalmente utilizada según Olsen existe desde 1991. Se utiliza en los estudios y también en la directriz.
- Grado I de Olsen: leve – AK apenas visible y débilmente palpable,
- Grado II de Olsen: moderado – AK bien visible y palpable,
- Grado III de Olsen: grave – QA claramente visible y gravemente hiperqueratósica [4].
También merece la pena conocer la clasificación clínico-histológica e histológica de Cockerell et al. 2000 y por Röwert-Huber et al. 2007 [5,6].
Sin embargo, la falta de una clasificación aplicable se refleja en las variaciones específicas de cada país, como la clasificación AK de la Asociación Británica de Dermatólogos:
- AK grado 1 leve – mínimo parche de descamación,
- Grado 2 moderado – parche escamoso moderado,
- Grado 3 grave: lesión hiperqueratósica.
Es esencial darse cuenta de que los hallazgos clínicos y la histología correspondiente no están necesariamente correlacionados, es decir, un hallazgo clínico creciente no tiene por qué corresponderse con un potencial maligno creciente, por ejemplo en términos de invasividad. Y hay otro punto importante sobre la clínica y la histología: en caso de cancerización de campo, la biopsia de un AK incluido no debe considerarse representativa de la zona circundante. Por lo tanto, los trabajos actuales se orientan cada vez más hacia un estudio histológico de los posibles criterios relevantes para el pronóstico. El trabajo de Dirschka et al. sobre el patrón de crecimiento de los queratinocitos atípicos confirman un potencial invasivo incluso de la QA inicial (grado I según Olsen) [9].
¿Qué significa esto para el médico tratante? Actualmente, la evaluación clínica primaria sigue siendo la misma. Las biopsias deben realizarse con urgencia si una lesión no está clara o progresa rápidamente. En este momento, está indicada una terapia precoz y de amplia aplicación para todas las QA. Sólo una mejor evaluación y un pronóstico con base científica pueden permitir una intervención terapéutica más específica. En la QA existente, el objetivo principal es evitar la progresión a una QEP invasiva.
Prevención
La prevención primaria tiene como objetivo evitar el desarrollo de la QA. En el comportamiento individual, esto significa evitar los riesgos personales. Pero también es necesario abordar los cambios en el entorno, que pueden estar implicados en el desarrollo de la enfermedad. Entre las acciones relacionadas se incluyen, por ejemplo, la protección solar en los jardines de infancia o la prohibición del uso de solarium a los menores de 18 años (el 01.06.19 entró en vigor la SR 814.711 “Ordenanza de la Ley Federal de Protección contra los Peligros de las Radiaciones No Ionizantes y el Sonido”).
La prevención secundaria se centra en el diagnóstico precoz de la AK. El asesoramiento al paciente y las terapias rápidas pretenden curar o mitigar el curso de la enfermedad. Una posibilidad son los exámenes de detección. En Suiza, se ofrece un cribado bienal gratuito del cáncer de piel a las personas aseguradas a partir de los 35 años. Aunque las AK no sean un componente definido del cribado del cáncer de piel, se observan elevadas tasas de acierto, especialmente en las subpoblaciones de mayor edad.
Con respecto al posible desarrollo de PEK, debe mencionarse la prevención terciaria como pilar diagnóstico y terapia para evitar daños consecuentes. En la AK múltiple, el riesgo de por vida de desarrollar un carcinoma de células escamosas (PEK) se evalúa en un 6-10% en un periodo de 10 años.
En cuanto a la patogénesis, la protección solar precoz y constante debe anteponerse a todo lo demás. Es necesaria la protección solar textil (casco, gafas, ropa) y el uso adecuado de preparados de protección UV, que deben incluir protección UVA y UVB. La ropa más densa puede proporcionar un factor de protección UV de 50, lo que significa que pasa <1/50 de la radiación UV, un 2% como máximo. Para la correcta aplicación de los agentes protectores contra los rayos UV, debe prestarse atención a la aplicación oportuna y a una aplicación suficientemente gruesa, uniforme y repetida. Por tanto, la duración de la estancia permitida calculable en función del tipo de piel no es ampliable.
Aunque la aceptación de la protección solar aumenta con la edad y sobre todo después de que se hayan detectado los primeros daños causados por los rayos UV, puede mejorarse en general y especialmente entre los jóvenes. La Liga contra el Cáncer pone en marcha en Suiza campañas regulares de protección solar. Folletos y vídeos cortos informan sobre los peligros de la sobreexposición al sol y las recomendaciones de protección solar. Además, la Campaña Nacional contra el Cáncer de Piel, organizada por la Sociedad Suiza de Dermatología y Venereología (SGDV), se celebra anualmente desde 2006. Entre otras cosas, promueve la concienciación de la población para una protección solar constante, así como exámenes de detección precoz.
Si existe un riesgo elevado de cáncer de piel, por ejemplo en pacientes trasplantados, debe determinarse el nivel de vitamina D y, si es necesario, aumentarlo. ser sustituido. La producción suficiente de vitamina D se produce con una exposición solar diaria moderada de alrededor del 20-25% del cuerpo (por ejemplo, cara, manos y brazos) durante al menos 5 minutos unas 2-3×/semana [7].
La prevención con otros agentes como el selenio, la vitamina A y el betacaroteno no se recomiendan como medidas de prevención del cáncer de piel. La nicotinamida puede utilizarse para la prevención, especialmente en lo que respecta al CCB y el PEK, en pacientes que hayan padecido previamente cáncer de piel no melanoma (CPNM) y en pacientes con trasplantes de órganos. Los estudios sobre la cafeína, como factor protector, y la nicotina y el alcohol como negativos no son convincentes.
Clínica
El espectro de lesiones va desde una pequeña mácula roja, una queratosis sésil de baja a clara superposición, lesiones pigmentadas, costrosas o atróficas hasta la carcinomatización del campo (Fig. 1) . Se caracteriza por múltiples QA rodeadas de lesiones cutáneas visibles relacionadas con los rayos UV, que incluyen una piel con manchas rojas-marrón-blanquecinas y proporcionalmente atrófica. Sin embargo, no existe una definición uniforme de la cancerización del campo.
La QA se produce principalmente en las zonas de la piel expuestas a los rayos UV, como la parte superior sin pelo de la cabeza, la frente, la mejilla, la nariz o las orejas (“terrazas solares”). Pero la AK también puede encontrarse en el escote, en el cuello y en las extremidades.
Diagnóstico
La QA se diagnostica principalmente de forma clínica mediante un examen visual y palpatorio. Los rasgos característicos pueden detectarse mediante dermatoscopia. Los puntos blancos dispuestos en forma de trébol perifolicularmente se describen como “marcas de roseta”. Típico de la QA no pigmentada es el patrón en “fresa”, caracterizado por aberturas foliculares con tapones queratósicos rodeados de una pseudorred rojiza. En la QA pigmentada aparece una pseudorred de color marrón a gris, compuesta por múltiples puntos o glóbulos de color marrón a gris dispuestos alrededor de las aberturas foliculares. La progresión hacia una PEK puede ser visible a través de queratosis gruesas y las más pequeñas inclusiones costrosas.
La microscopía confocal de barrido láser es una técnica de diagnóstico por imagen no invasiva que utiliza una fuente de luz puntual monocromática para la evaluación microscópica de las capas superiores de la piel con una profundidad de penetración de aproximadamente 300 µm. La QA se caracteriza por una pérdida de la estructura alveolar normal con atipia y pleomorfismo de los queratinocitos epidérmicos, paraqueratosis y dilataciones de los vasos sanguíneos. La hiperqueratosis compacta suprayacente puede, en algunos casos, complicar significativamente el análisis de las estructuras más profundas, lo que puede limitar el diagnóstico del carcinoma escamoso invasivo.
Otro método de obtención de imágenes es la tomografía de coherencia óptica, que funciona con rayos electromagnéticos en la gama del infrarrojo cercano (700-1300 nm). Aquí se crean al mismo tiempo imágenes de sección en profundidad con una profundidad de penetración de aproximadamente 1,5-2,6 mm e imágenes horizontales. Las AK muestran acantosis con una zona de unión bien conservada. En los carcinomas escamosos invasivos, la estratificación regular de la epidermis está abolida y la zona de unión ya no puede delimitarse con claridad. La hiperqueratosis grave también puede conllevar limitaciones diagnósticas. Se han publicado los primeros intentos de consulta virtual sobre AK. Tras el asesoramiento crítico y la instrucción del paciente sobre la AK, las imágenes generales y de primer plano periódicas constituyen una base para los posibles cuidados [8].
Terapia
La indicación de la terapia de la QA debe hacerse en sinopsis del cuadro clínico, los factores de riesgo, las comorbilidades, la esperanza de vida y los deseos del paciente, así como su cumplimiento. La puntuación AKASI puede utilizarse para clasificar la gravedad clínica y objetivar el éxito terapéutico de la QA en la cabeza [9].
La actual “S3 Guideline Actinic Keratosis and Squamous Cell Carcinoma of the Skin” ofrece una visión general de las opciones de tratamiento aprobadas, las indicaciones y los parámetros de aplicación [10]. Hay que considerar dos grandes bloques: los procedimientos no invasivos y los procedimientos invasivos / mecánico-destructivos. En lo que respecta a los pacientes inmunodeprimidos trasplantados y a los enfermos profesionales, existen criterios de tratamiento modificados que no se presentan aquí con más detalle [10].
Procedimientos no invasivos
Procedimientos tópicos asistidos por fármacos
Para una consideración individual, a continuación se exponen brevemente los posibles criterios de decisión y las recomendaciones de la directriz. En cuanto a los mecanismos de acción y los efectos secundarios, nos remitimos a la bibliografía actual disponible en Internet (Tab. 1) [11].
El diclofenaco al 3% en ácido hialurónico al 2,5% puede utilizarse en zonas más extensas de todo el cuerpo. La ventaja de esta opción de tratamiento es un bajo espectro de efectos secundarios. Es posible una aplicación 2× diaria durante 60-90 días hasta una cantidad máxima de 8g al día. Según la directriz, debe ofrecerse diclofenaco al 3% en ácido hialurónico al 2,5% para las QA de Olsen únicas o múltiples de grado I-II en pacientes inmunocompetentes o con cancerización de campo [10]. La tasa de respuesta oscila entre el 25% y el 89%, dependiendo en gran medida de los hallazgos clínicos. Esta opción de tratamiento se ha utilizado a menudo durante años, por lo que es necesario considerar otras opciones.
La crema de 5-fluorouracilo al 5% debe ofrecerse para el tratamiento de las QA únicas y múltiples de grado I-II según la directriz de Olsen. La terapia dirigida al campo con crema de 5-fluorouracilo al 5% puede utilizarse para la cancerización del campo [10]. El 5-FU al 5% aplicado 2× al día durante 2-4 semanas puede causar efectos secundarios como enrojecimiento, picor, quemazón, erosión, ulceración y costras. Es más probable encontrar reacciones locales más fuertes en la piel atrófica de los ancianos o cuando se toman anticoagulantes. Los estudios han demostrado una tasa de respuesta muy buena y un éxito a largo plazo, también en lo que respecta a las recidivas [12]. Las tasas de respuesta muestran un amplio abanico y se sitúan entre el 38% y el 96%.
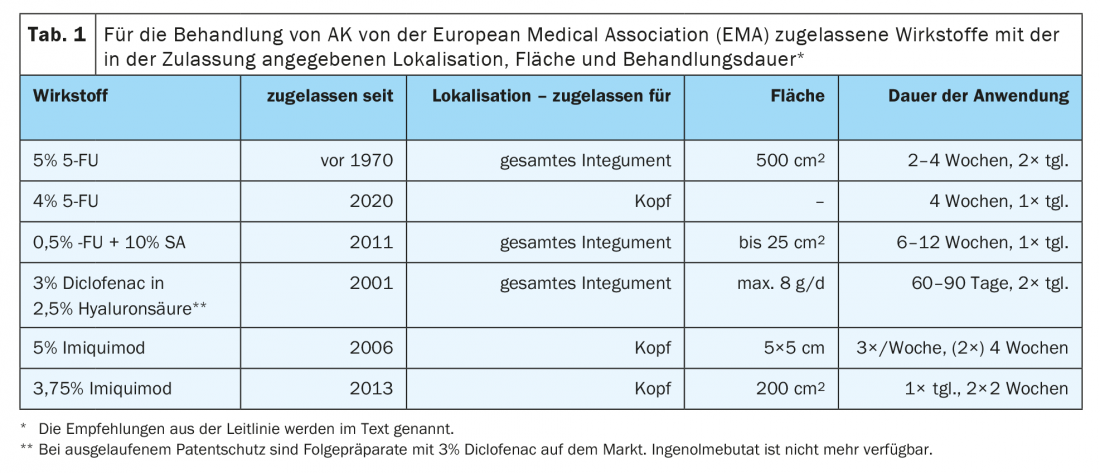
El 5-FU al 4% también está aprobado para la zona de la cabeza y se utiliza para las QA de grado I-II. Con una eficacia comparable a la del 5-FU al 5%, se utiliza sólo 1× diario y promete efectos secundarios menos pronunciados, lo que conduce a una mejor adherencia del paciente a la terapia [13]. El 5-FU al 0,5% con un 10% de SA se aprobó principalmente para la terapia dirigida a la lesión de la QA. En el estudio posterior al ingreso, las QA de grado I y II mostraron una curación completa del 75% de las lesiones y una curación completa en el 50% de los casos tras 8 semanas en comparación con el tratamiento placebo en las terapias dirigidas al campo. La duración del tratamiento suele ser de 6 a 12 semanas. El 0,5% de FU con un 10% de SA debe aplicarse diariamente con un pincel. Forma una película apenas visible y se tolera bien.
El imiquimod está aprobado para su uso en la zona de la cabeza. 3,75% Imiquimod muestra aquí una respuesta fiable y a más largo plazo, especialmente en el caso de una reacción claramente inflamatoria. Los efectos secundarios típicos son prurito, dolor local y formación de costras. Por lo tanto, se establecieron intervalos de terapia más cortos con un ritmo de “2 encendido – 2 apagado – 2 encendido”. Esto significa una aplicación 1× diaria durante 2 semanas y tras un descanso de 2 semanas otra aplicación durante 2 semanas. Esto conduce a una buena adherencia terapéutica en los pacientes cuando se utiliza de forma adaptada a los efectos secundarios. De acuerdo con la directriz, debe ofrecerse Imiquimod 3,75% crema de campo para las QA múltiples de grado I-II según Olsen y para la cancerización de campo en individuos inmunocompetentes en la cara o el capilicio sin pelo [10]. Los índices de respuesta oscilan entre el 34% y el 82%.
El tratamiento de la QA con imiquimod al 5% es posible, pero ha quedado rezagado con respecto a la concentración de imiquimod al 3,75% en frecuencia de tratamiento debido a sus efectos secundarios más graves. Queda por considerar su uso como parte de un tratamiento combinado del CBC superficial, para el que está aprobado el imiquimod al 5%, y la QA existente.
La TFD se basa en la conversión del ácido 5-aminolevulínico (5-ALA) y el ácido metilhlaminolevulínico (MAL) en el metabolito fotoactivo protoporfirina IX, que se acumula en las células neoplásicas y se activa con la luz. Esto forma especies ácidas reactivas que inducen la apoptosis, entre otras cosas. Para la PDT se dispone de varios exteriores y fuentes de luz. La directriz resume: La terapia fotodinámica convencional con ácido 5-aminolevulínico o su éster metílico (5-ALA o MAL) debe ofrecerse de forma dirigida al campo para las QA únicas o múltiples de grado I-II según Olsen y para la carcinogénesis de campo [10].
La crema que contiene MAL puede utilizarse como medicamento listo para usar y se aplica en la zona de tratamiento con un grosor de 1 mm. Tras 3 horas de oclusión, puede realizarse una irradiación con 570-670 nm (75 J/cm2) o, alternativamente, con 630 nm (37 J/cm2). Si la AK no cicatriza por completo, puede volver a aplicarse al cabo de 12 semanas. El ALA está disponible en forma de parche y de gel con una nanoemulsión de ALA (BF-200 ALA). Pueden utilizarse al mismo tiempo hasta 6 parches de ALA con un tamaño de 4 cm2. Pueden utilizarse tanto para AK individuales como múltiples. Cuatro horas después de la incubación, exposición con una lámpara de luz roja de espectro estrecho (630 nm).
El gel BF-200 ALA está aprobado para lesiones y sobre el terreno. El tubo de 2 g es suficiente para una superficie de 20 cm2 con una aplicación de 1 mm de espesor. Tras 3 horas de oclusión, sigue la irradiación con una lámpara de luz roja de amplio espectro o de espectro estrecho. BF-200 ALA también está aprobado para su uso en las extremidades, el tronco y el cuello desde el 03/2020. Según la formulación de Swiss medic 2018, se aplica lo siguiente al uso de BF-200 ALA: “Tratamiento de queratosis actínicas (QA) de intensidad leve a moderada en la cara y el cuero cabelludo (grado I-II según Olsen) y cánceres de campo en adultos.” Una combinación de TFD con terapias locales, por un lado en el sentido de descamación y queratolisis o también terapéuticamente con imiquimod o 5-FU, puede mejorar la eficacia.
La TFD diurna puede utilizarse tanto con la crema que contiene MAL como con el gel BF-200 ALA. El menor dolor con este tratamiento se debe a la aparición más lenta de la protoporfirina IX con un tiempo de incubación más corto (<30 minutos) y una exposición posterior (2 horas). La MAL en combinación con la luz diurna (luz diurna-MAL-PDT) debe ofrecerse dirigida al campo para las QA no pigmentadas, únicas o múltiples de grado I-II según Olsen, y para la carcinogénesis de campo de la cara y el capilicio en individuos inmunocompetentes [10]. Lo nuevo es la TFD con luz diurna domiciliaria, en la que los propios pacientes se aplican el fotosensibilizante y luego se exponen a la luz del día.
Los metaanálisis sirven para clasificar las terapias, por así decirlo: Los éxitos terapéuticos mostraron la mayor tasa de curación para el ALA BF-200 con un 75,8%, seguido del 5-FU al 5% con un 59,9%, los parches de ALA con un 56,8%, el imiquimod al 5% con un 56,3%, el imiquimod al 3,75% con un 39,9% y el diclofenaco al 3% en ácido hialurónico al 2,5% con un 24,7% [14]. En otro metaanálisis, la TFD también mostró el mayor éxito en la cicatrización, seguida de 5-FU al 5%, imiquimod al 5% y diclofenaco al 3% en ácido hialurónico al 2,5% [8].
Procedimientos mecánicos invasivos
La criocirugía es un procedimiento muy utilizado, a menudo combinado con la terapéutica local o la TFD. Utilizando nitrógeno líquido de -196 ˚C, se consigue una temperatura de -25˚C en la zona de la piel tratada mediante estampación por contacto o pulverización. Esto se consigue normalmente con una aplicación de 15-60 segundos y 2 tiempos de glaseado. Sin embargo, no se han establecido normas claras. Se recomienda para las QA únicas o múltiples de grado I-III según Olsen en individuos inmunocompetentes [10]. A menudo deja tras de sí zonas cutáneas hipopigmentadas, por lo que también pueden aparecer aspectos estéticos en función de la edad y la evolución de la enfermedad.
El dominio de los procedimientos quirúrgicos es más el diseminado, especialmente la AK más pronunciada. La directriz recomienda la extirpación quirúrgica de las QA de grado I-III según Olsen para lesiones individuales tanto en pacientes inmunocompetentes como inmunodeprimidos, por ejemplo mediante curetaje, ablación superficial o escisión completa [10]. Una ventaja de este método es la confirmación simultánea del diagnóstico. Existe una advertencia contra la escisión por rasurado y la cobertura insuficiente de las estructuras más profundas. En comparación con los procedimientos no invasivos, estos enfoques obtienen una puntuación más baja en la evaluación cosmética simplemente por la formación de cicatrices.
Los procedimientos con láser son populares debido a su buena viabilidad y, según la directriz, deberían ofrecerse para las QA únicas o múltiples de grado I-III según Olsen, así como para la cancerización de campo en pacientes inmunocompetentes. Con elláser Er:YAG oCO2, la AK puede eliminarse de forma rápida y específica. Se recomienda una copia de seguridad histológica suplementaria, así como documentación fotográfica. La terapia láser seguida de un tratamiento local, por ejemplo con 5-FU al 5%, permite una mejor administración del fármaco [15].
Un interesante resumen de Steeb et al. aborda la pregunta “¿cuantos más, mejor?”. Podría demostrarse que una terapia combinada puede aumentar la eficacia del éxito terapéutico. En particular, puede resultar útil una combinación de terapia dirigida a la lesión y terapia dirigida al campo. Todavía se cuestiona críticamente un aumento significativo del éxito sin más estudios [16].
Desarrollos
La tirbanibulina es un nuevo principio activo producido sintéticamente que cuenta con la aprobación de la FDA para la AK en la cabeza desde diciembre de 2020. Se inhibe la polimerización de la tubulina. A continuación se produce la detención del ciclo celular (fase G2/M) y la apoptosis. Dos ensayos pivotales de fase III controlados con placebo informan de tasas de respuesta completa del 44% y el 54% en el día 57, significativamente mejores que el efecto placebo (5%, 13%) [17]. La tirbanibulina al 1% se aplica localmente en unos 25 cm2 una vez al día durante 5 días. El día 8 muestra eritema, descamación, prurito y dolor, de gravedad leve a moderada y que remite rápidamente.
Del grupo de los flavonoides, subgrupo de los polifenoles y perteneciente a las catequinas, se está avanzando en el desarrollo de una sinecatequina (extracto de té verde) para el tratamiento de la QA. Como enfoque terapéutico causal, cabe mencionar los efectos antioxidantes, antiinflamatorios y anticancerígenos de las catequinas. Se ha demostrado el efecto antiproliferativo sobre los queratinocitos también en el contexto de la fotocarcinogénesis [18]. Aún deben generarse más datos sobre el tratamiento de la QA basados en pruebas.
Se nombran cuatro compuestos adicionales en un posible desarrollo para el tratamiento de la QA [19]: El dobesilato de potasio tiene efectos antiinflamatorios, antiangiogénicos y antitumorales como inhibidor de la señalización del FGF y de la síntesis de prostaglandinas. Se han publicado tasas de respuesta de alrededor del 60% para la QA en un estudio de fase II más antiguo. El tuvatexib es un modulador de la hexoquinasa 2 Comp-1. La apoptosis se produce a través de una interacción con la hexoquinasa en la mitocondria. De forma análoga al 5-FU, se aconsejó el paclitaxel como agente quimioterapéutico de aplicación local. Se une a la β-tubulina e inhibe el citoesqueleto. Existe una “prueba de principio” para el paclitaxel, como partículas submicrónicas de aplicación local, así como para la “furosemida más digoxina”, pero sin que se hayan realizado más estudios en la AK.
Resumen
Las queratosis actínicas (QA) siguen siendo un tema de futuro debido a que su incidencia sigue aumentando. Teniendo en cuenta el curso crónico de la enfermedad, el envejecimiento del paciente que requiere un tratamiento terapéutico a largo plazo, la educación precoz y la prevención tanto primaria como secundaria cobran cada vez más importancia.
Se esbozan los avances actuales en patogénesis, evaluación de riesgos, evaluación crítica de las clasificaciones, medidas preventivas y diagnósticos. Se esbozan las opciones terapéuticas y los conceptos basados en la directriz S3 “Queratosis actínica y carcinoma de células escamosas” de la piel. Se presenta el estado actual así como las posibles terapias futuras.
Mensajes para llevarse a casa
- La QA se diagnostica principalmente de forma clínica.
- El término cancerización del campo no se basa actualmente en una definición clara.
- Las clasificaciones anteriores de AK no se correlacionan de forma fiable con el riesgo de invasividad.
- La indicación del tratamiento se basa en numerosos criterios individuales y, además de la remisión, sirve para prevenir la progresión así como el desarrollo de la PEK.
- La prevención y las terapias se establecen sobre una base amplia, como directrices y medidas de política sanitaria.
Literatura:
- Reinehr CPH, Bakos RM: Queratosis actínicas: revisión de los aspectos clínicos, dermatoscópicos y terapéuticos. An Bras Dermatol 2019 nov-dic; 94(6): 637-657; doi: 10.1016/j.abd.2019.10.004.
- Dziunycz PJ, Schuller E, Hofbauer GFL: Prevalencia de la queratosis actínica en pacientes que acuden al médico general en Suiza. Dermatología 2018; 234(5-6): 214-219; doi: 10.1159/000491820.
- Warszawik-Hendzel O, Olszewska M, Rakowska A, et al: Consumo de fármacos cardiovasculares y riesgo de queratosis actínica: un estudio de casos y controles. Dermatol Ther 2020; 10: 735-743; doi: 10.1007/s13555-020-00405-8.
- Olsen EA, Abernethy ML, Kulp-Shorten C, et al: Estudio doble ciego controlado con vehículo que evalúa la crema de masoprocol en el tratamiento de las queratosis actínicas de la cabeza y el cuello. J Am Acad Dermatol 1991 mayo; 24(5 Pt 1): 738-743; doi: 10.1016/0190-9622(91)70113-g.
- Cockerell CJ.: Histopatología del carcinoma intraepidérmico incipiente de células escamosas (“queratosis actínica”). J Am Acad Dermatol 2000 Jan; 42(1 Pt 2): 11-17; doi: 10.1067/mjd.2000.103344.
- Röwert-Huber J, Patel MJ, Forschner T, et al: La queratosis actínica es un carcinoma precoz de células escamosas in situ: una propuesta de reclasificación. Br J Dermatol 2007 mayo; 156 Suppl 3: 8-12; doi: 10.1111/j.1365-2133.2007.07860.x. Fe de erratas en: Br J Dermatol 2007 Ago; 157(2): 431.
- Holick MF: Vitamina D: una perspectiva de salud D-Lightful. Nutr Rev 2008 oct; 66(10 Suppl 2): S182-194; doi: 10.1111/j.1753-4887.2008.00104.x.
- Dhariwal S, Hari T, Kaur K, et al: Consulta virtual para la queratosis actínica. BJGP Open 2020 Oct 27; 4(4): bjgpopen20X101126; doi: 10.3399/bjgpopen20X101126.
- Dirschka T, Pellacani G, Micali G, et al: Una propuesta de sistema de puntuación para evaluar la gravedad de la queratosis actínica en la cabeza: índice de área y gravedad de la queratosis actínica. J Eur Acad Dermatol Venereol 2017 ago; 31(8): 1295-1302; doi: 10.1111/jdv.14267.
- Programa de directrices oncológicas. Directriz S3 Queratosis actínica y carcinoma de células escamosas de la piel 2019. Número de registro AWMF:032/0220L, www.leitlinienprogramm-onkologie.de/leitlinien/aktinische-keratosen-und-plattenepithelkarzinom-der-haut.
- Nashan D, Hüning S, Heppt MV, et al: Queratosis actínicas: directriz actual y recomendaciones basadas en la práctica. Dermatólogo 2020; 71: 463-475.
- Walker JL, Siegel JA, Sachar M, et al: 5-Fluorouracil for Actinic Keratosis Treatment and Chemoprevention: A Randomized Controlled Trial. J Invest Dermatol 2017 Jun; 137(6): 1367-1370; doi: 10.1016/j.jid.2016.12.029.
- Dohil MA: Eficacia, seguridad y tolerabilidad de la crema de 5-fluorouracilo al 4% en una novedosa crema acuosa patentada que contiene aceite de cacahuete una vez al día en comparación con la crema de 5-fluorouracilo al 5% dos veces al día: superando el reto en el tratamiento de la queratosis actínica. J Drugs Dermatol 2016 Oct 1; 15(10): 1218-1224.
- Vegter S, Tolley K: Un metaanálisis en red de la eficacia relativa de los tratamientos para la queratosis actínica de la cara o el cuero cabelludo en Europa. PLoS One 2014 Jun 3; 9(6): e96829; doi: 10.1371/journal.pone.0096829.
- Nguyen BT, Gan SD, Konnikov N, Liang CA: Tratamiento del carcinoma basocelular superficial y del carcinoma de células escamosas in situ en el tronco y las extremidades con la administración ablativa asistida por láser fraccional de fluorouracilo tópico. J Am Acad Dermatol 2015 Mar; 72(3): 558-560; doi: 10.1016/j.jaad.2014.11.033.
- Steeb T, Wessely A, Leiter U, et al: ¿Cuanto más, mejor? Una valoración de las terapias combinadas para la queratosis actínica. J Eur Acad Dermatol Venereol 2020 Abr; 34(4): 727-732; doi: 10.1111/jdv.15998.
- Kempers S, DuBois J, Forman S, et al: Tirbanibulin Ointment 1% as a Novel Treatment for Actinic Keratosis: Phase 1 and 2 Results. J Drugs Dermatol 2020 Nov 1; 19(11): 1093-1100.
- Zink A, Traidl-Hoffmann C, et al.: El té verde en dermatología: mitos y realidades. J Dtsch Dermatol Ges 2015 Ago; 13(8): 768-775.
- Cramer P, Stockfleth E, et al: Queratosis actínica: ¿dónde estamos y adónde nos llevará el futuro? Expert Opin Emerg Drugs 2020 Mar; 25(1): 49-58.
DERMATOLOGIE PRAXIS 2021; 31(2): xx-xx