El uso moderado y selectivo de los antibióticos ayuda a minimizar el riesgo de resistencia a los mismos. Cada administración de antibióticos también deja daños colaterales en nuestro microbioma. En general, la terapia debe ser tan corta como sea necesaria y con la dosis más alta posible.
Los antibióticos contribuyeron a hacer tratables enfermedades infecciosas que solían ser graves y a menudo mortales, por lo que perdieron su antiguo horror. Por ejemplo, en comparación con la era anterior a los antibióticos, la mortalidad de la neumonía se redujo del 23% al 7% aproximadamente, la de la endocarditis del 100% al 25% y la de la meningitis bacteriana del >80% al <20% [1]. La introducción de los antibióticos supuso un impulso al desarrollo de la medicina moderna de alto rendimiento. Sin antibióticos eficaces, la medicina intensiva, la cirugía, especialmente las endoprótesis y los trasplantes, así como las quimioterapias son inconcebibles [2].
Resistencia a los antibióticos
Tras la introducción de un nuevo antibiótico, las bacterias suelen tardar sólo unos años en hacerse resistentes a él. Los antibióticos ejercen una presión de selección sobre las variantes bacterianas resistentes preexistentes, que tienen así una ventaja de supervivencia sobre las bacterias sensibles y se enriquecen.
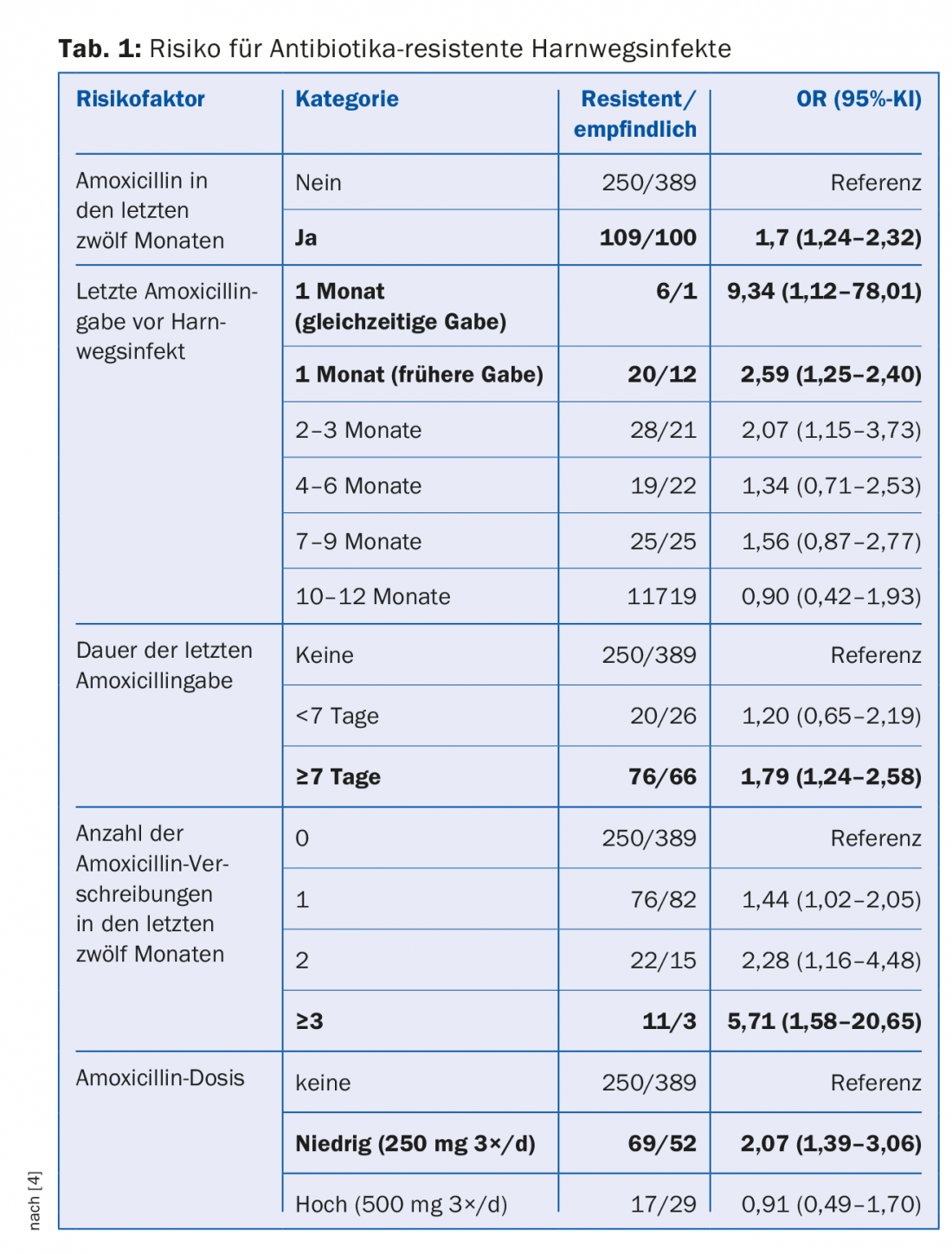
La resistencia a los antibióticos ha estado presente en la naturaleza durante millones de años, pero es claramente el uso de antibióticos en la agricultura y la medicina, en última instancia en los seres humanos, la fuerza impulsora. Cuantos más antibióticos se receten en una población, mayor será el riesgo de que aparezcan bacterias resistentes a los antibióticos [3]. En un estudio de casos y controles de pacientes con infecciones del tracto urinario, se encontraron varios factores de riesgo: administración frecuente de antibióticos, larga duración de la terapia, dosis bajas (Tab. 1) [4]. El riesgo de colonización por neumococos resistentes a la penicilina aumentó un 4% en los niños australianos por cada día que habían recibido antibióticos β-lactámicos en los seis meses anteriores [5]. Aproximadamente el 60-90% de los antibióticos humanos se prescriben en el sector ambulatorio y de ellos, aproximadamente el 75-85% se prescriben para infecciones respiratorias comúnmente víricas. Sin embargo, a nivel mundial, cerca del 80% de todos los antibióticos se utilizan en la ganadería, principalmente como “promotores del crecimiento” para el engorde del ganado.
La resistencia a los antibióticos puede surgir y propagarse de diferentes maneras. Pueden ser intrínsecas (es decir, una bacteria siempre es resistente a ese antibiótico), surgir de novo por mutación espontánea y seleccionarse debido a la presión de selección ejercida por el antibiótico, transferirse de una bacteria a otra por transferencia horizontal de genes (por ejemplo, mediante plásmidos, que a menudo contienen diferentes genes de resistencia al mismo tiempo) y también transmitirse entre pacientes por una higiene deficiente (de las manos).
La resistencia a los antibióticos tiene consecuencias relevantes como el aumento de la mortalidad, estancias hospitalarias más largas y costes más elevados (resumen 1) . Las sombrías previsiones predicen un aumento de aproximadamente 25.000 muertes en la UE y unas 700.000 en todo el mundo debido a infecciones por patógenos resistentes a los antibióticos en 2014 a hasta 390.000 y 10 millones respectivamente en 2050. Se teme que esto suponga un retroceso a una era anterior a los antibióticos, con infecciones intratables -que ya son una realidad en muchos países- y unos costes indirectos de la inimaginable cifra de 100 billones de dólares (amr-review.org).

En Suiza, los datos sobre la resistencia a los antibióticos se recogen con la vigilancia nacional y se puede acceder a ellos en www.anresis.ch en una base de datos interactiva. Aquí se observan éxitos considerables en la contención del Staphylococcus aureus resistente a la meticilina (SARM). Menos del 3% de los neumococos son resistentes a la penicilina, en parte debido a la vacunación antineumocócica infantil. Por desgracia, la resistencia a los antibióticos se está extendiendo de forma constante entre los patógenos gramnegativos, especialmente a través de las betalactamasas de espectro extendido (BLEE), cada vez más responsables de infecciones abdominales y del tracto urinario. Por ejemplo, alrededor del 10% de todas las Escherichia coli de Suiza son formadoras de BLEE y cerca del 20% son resistentes a la ciprofloxacina.
Efectos de los antibióticos en el microbioma
Aparte de la selección de resistencias, los efectos secundarios indeseables, las reacciones alérgicas y el coste de los medicamentos, todo uso de antibióticos tiene un impacto relevante en nuestra microbiota (conjunto de todos los organismos de nuestro cuerpo) y nuestro microbioma (microbiota además de su genoma) que dura hasta varios años [6]. El más conocido es la predisposición tras los antibióticos a ladiarrea asociada a Clostridium difficile, pero los antibióticos también aumentan el riesgo, entre otras cosas, de sepsis en el curso, el desarrollo de obesidad, diabetes mellitus, asma y alergias [7]. La mayor influencia se ejerce sobre la microbiota en desarrollo del niño, por lo que debe prestarse atención a un uso lo más restrictivo posible de los antibióticos, sobre todo en mujeres embarazadas y niños (especialmente en los dos primeros años de vida) [8].
Sobre todo, las bacterias anaerobias de la flora de sitio en el colon contribuyen a una resistencia a la colonización por agentes patógenos, razón por la cual la terapia antibiótica dirigida contra los anaerobios predispone a otras infecciones. Es interesante observar que tras un viaje a una zona endémica, el riesgo de nueva colonización con Enterobacteriaceae multirresistentes en comparación con los viajeros sanos era dos veces mayor en las personas que habían tenido diarrea durante el viaje y más de cuatro veces mayor en las personas que habían tomado un antibiótico β-lactámico durante el viaje (disbiosis de la flora intestinal) [9]. Este es un argumento importante contra una profilaxis antibiótica demasiado generosa contra la diarrea del viajero.
Reglas básicas para el uso de antibióticos
Los siguientes aspectos deben tenerse en cuenta con cualquier terapia antibiótica:
Indicación: Cualquier administración de antibióticos sólo debe realizarse tras una indicación estricta. El uso de biomarcadores puede ser útil para ello. Dado que el riesgo de infección bacteriana se correlaciona con el nivel de procalcitonina (PCT), sin un mayor riesgo de complicaciones, el uso de algoritmos de PCT puede reducir el consumo de antibióticos en un 35-45% en pacientes con una exacerbación de la enfermedad pulmonar obstructiva crónica (EPOC) y en aproximadamente un 65% en aquellos con infecciones del tracto respiratorio superior [10]. En pacientes con síntomas víricos típicos de las infecciones de las vías respiratorias superiores o la bronquitis aguda (conjuntivitis, rinitis, artralgia, exantema), deben evitarse los antibióticos. Un estudio británico demostró que el uso restrictivo de antibióticos para las infecciones del tracto respiratorio superior podría ahorrar más de 2.000 recetas de antibióticos en diez años en una consulta con 7.000 pacientes al año [11]. En consecuencia, se producen complicaciones temibles en muy raras ocasiones (unos diez episodios de neumonía y menos de un absceso periamigdalino a lo largo de diez años). Debe tenerse en cuenta que las vías respiratorias superiores e inferiores no son estériles y, por lo tanto, la detección de bacterias no indica automáticamente una terapia antibiótica.
La bacteriuria asintomática sólo debe buscarse en el embarazo y antes de procedimientos urológicos que impliquen lesiones de la mucosa, y sólo entonces debe tratarse con antibióticos. Por lo demás, la terapia antibiótica en la bacteriuria asintomática se asocia a un mayor riesgo de desarrollar pielonefritis (presumiblemente, de nuevo a través de la disbiosis de la microbiota) y a un mayor desarrollo de resistencias [12,13]. Lo mismo se aplica a los usuarios asintomáticos de catéteres permanentes, que tienen una tasa de colonización de alrededor del 8%/día, lo que no debería conducir a una terapia antibiótica en ausencia de síntomas claros.
La sinusitis aguda suele tener una etiología vírica. Sólo entre el 0,5 y el 2% de los adultos y hasta el 5% de los niños desarrollan una sobreinfección bacteriana. Los antibióticos sólo se recomiendan en caso de persistencia de los síntomas o falta de mejoría después de al menos diez días, síntomas graves (fiebre ≥39°C o esputo purulento) durante al menos tres o cuatro días o empeoramiento o curso bifásico después de al menos tres o cuatro días. El tratamiento de elección es amoxicilina 1 g cada ocho horas durante cinco a siete días; en casos graves o con factores de riesgo, amoxicilina/ácido clavulánico 1 g cada doce horas durante cinco a siete días.
La terapia antibiótica inmediata sólo está indicada en caso de otitis media aguda (OMA) bilateral en niños menores de dos años o de OMA perforada. De lo contrario, se recomienda una “espera vigilante” durante 24-48 horas en niños menores de dos años o 48-72 horas en mayores de dos años, ya que la terapia antibiótica tiene poco efecto sobre la duración de los síntomas o la tasa de complicaciones en la OMA inicialmente vírica en su mayoría. La terapia de elección es la amoxicilina, en caso de recaída o falta de respuesta tras 72 horas amoxicilina/ácido clavulánico.
En pacientes mayores de tres años, debe calcularse la puntuación Centor (un punto por cada exudado en las amígdalas; fiebre >38°C; ganglios linfáticos cervicales anteriores dolorosos e inflamados; ausencia de tos) si se sospecha una faringitis no vírica. Sólo si el resultado es ≥3 puntos debe realizarse una prueba rápida para Streptococcus pyogenes. Y sólo si es positivo, debe iniciarse la terapia antibiótica en un plazo de nueve días para minimizar el riesgo de fiebre reumática aguda. La terapia de elección es la amoxicilina 1 g cada doce horas durante seis días (hasta ahora, el S. pyogenes es siempre sensible a la penicilina, pero la amoxicilina tiene una biodisponibilidad mayor que la penicilina).
Varios estudios recientes han demostrado que en la diverticulitis aguda no complicada, la terapia antibiótica no es mejor que el placebo en cuanto al alivio de los síntomas, la tasa de complicaciones, la necesidad de cirugía y la tasa de recidiva [14].
En la gastroenteritis aguda (diarrea con vómitos/diarrea acuosa) sin fiebre con/sin antecedentes de viaje, el tratamiento sintomático suele ser suficiente. Los antibióticos sólo deben utilizarse en caso de diarrea sanguinolenta o febril o de toxicidad sistémica.
Espectro patógeno: Toda terapia antibiótica empírica debe tener en cuenta el espectro patógeno esperado. Deben tratarse tanto los patógenos más comunes como algunos patógenos raros asociados a un curso particularmente grave. Dependiendo de la infección, está indicado un diagnóstico microbiológico del patógeno. Si se detecta un patógeno, la terapia debe reducirse (desescalada). Esto se hace en particular para minimizar los posibles daños colaterales al microbioma y la selección de resistencias a los antibióticos. Por ejemplo, se ha demostrado que los pacientes con neumonía neumocócica bacteriémica presentaban una menor mortalidad cuando se desescalaba a monoterapia con penicilina o amoxicilina durante el curso [15].
Modo de administración: Los antibióticos con alta biodisponibilidad oral deben administrarse principalmente por vía oral, por ejemplo, trimetoprim-sulfametoxazol, metronidazol, clindamicina, quinolonas. Las excepciones son los pacientes en los que la absorción enteral está alterada o las infecciones que requieren niveles muy elevados en el lugar de acción (por ejemplo, infecciones muy graves, infecciones endovasculares, infecciones óseas iniciales, infecciones del SNC).
Dosis: La dosis depende de la concentración inhibitoria mínima (CIM) del patógeno, la carga germinal, la gravedad de la infección, los niveles tisulares que cabe esperar (sobre todo bajos en próstata, SNC) y el rango terapéutico del antibiótico (alto para los antibióticos β-lactámicos, bajo para los aminoglucósidos). La dosis inicial debe elegirse lo más alta posible, ya que aquí se presenta la mayor carga de gérmenes y a menudo también se requiere una dosis de carga para alcanzar niveles activos suficientes lo antes posible. Las dosis óptimas suelen ser superiores a las recomendadas en el compendio (véase, por ejemplo, www.guidelines.ch). En caso de insuficiencia hepática o renal, puede ser necesario prolongar el intervalo, pero la dosis de carga sigue siendo la misma. Los antibióticos β-lactámicos (penicilinas, cefalosporinas) tienen un efecto dependiente del tiempo en el que el nivel activo debe permanecer por encima de la CMI del patógeno durante el mayor tiempo posible mediante una dosificación lo más frecuente posible (intervalos cortos). Por el contrario, los macrólidos, los aminoglucósidos o las quinolonas tienen un efecto dependiente de la concentración y alcanzan un efecto óptimo a concentraciones máximas elevadas. Para estos antibióticos, debe administrarse una dosis lo más alta posible con un intervalo de dosis largo.
Duración: La duración de la terapia debe ser tan larga como sea necesario y tan corta como sea posible. El trasfondo es que debe ejercerse la menor presión de selección posible para la aparición y propagación de la resistencia a los antibióticos. Este concepto también está ganando cada vez más atención a nivel internacional, y en la mayoría de las infecciones relevantes para la práctica general, las terapias de corta duración están ahora bien establecidas. Cabe hacer referencia aquí a dos muy buenos artículos panorámicos [16,17]. Visión general 2 ofrece una visión general.

Antecedentes de alergia: De todas las alergias a los antibióticos, la alergia a la penicilina es la más frecuente en los pacientes. Sin embargo, probablemente menos del 10% de estos pacientes tienen una verdadera alergia a la penicilina y en menos del 2% los pacientes verdaderamente alérgicos a la penicilina tienen una alergia cruzada a las cefalosporinas de tercera generación [18]. Debe tenerse en cuenta que las penicilinas y otros antibióticos β-lactámicos suelen ser la clase de sustancias más eficaces y que retenerlos debido a una supuesta alergia conlleva un aumento de la morbilidad y la mortalidad en los pacientes “etiquetados” de este modo. Por lo tanto, las alergias deben diferenciarse siempre de las reacciones adversas y la sospecha de una alergia a los antibióticos debe aclararse alergológicamente.
Reparación de la microbiota dañada: Al igual que un cirujano es responsable de su herida, las consecuencias (especialmente la selección de resistencias y los daños colaterales con respecto al microbioma) también deben tenerse en cuenta con cada prescripción de antibióticos. El objetivo debe ser minimizarlos o “compensarlos”. Sin embargo, los estudios futuros deberán aportar primero las pruebas sobre qué probiótico es mejor en cada situación. Diversas especies de Lactobacillus y Bifidobacillus, que se encuentran en varios yogures bebibles o complementos alimenticios disponibles en el mercado, se recomiendan para restaurar la microbiota dañada por los antibióticos [6].
Mensajes para llevarse a casa
- En la consulta se prescriben entre el 60 y el 90% de los antibióticos y, de ellos, alrededor del 75-85% son para infecciones respiratorias, en su mayoría víricas.
- En toda terapia antibiótica deben tenerse en cuenta los siguientes aspectos: Indicación, espectro patógeno esperado, modo de aplicación, dosis, duración.
- Utilizar los antibióticos de la forma más moderada y selectiva posible ayuda a minimizar el riesgo de desarrollar resistencia a los antibióticos, los efectos secundarios, las alergias y los costes.
- Toda administración de antibióticos deja daños colaterales en nuestro microbioma con efectos múltiples y aún poco conocidos sobre el riesgo de diversas enfermedades (diarrea asociada a Clostridium difficile, sepsis, obesidad y síndrome metabólico, alergias, etc.).
- Regla general para la terapia antibiótica: Tan corta como sea necesaria y tan alta como sea posible la dosis.
Literatura:
- Spellberg B, et al: Lucha contra la resistencia a los antimicrobianos: recomendaciones políticas para salvar vidas. Clin Infect Dis 2011; 52(Suppl 5): S397-428.
- Marston HD, et al: Resistencia a los antimicrobianos. JAMA 2016; 316(11): 1193-1204.
- Albrich WC, Monnet DL, Harbarth S: Presión de selección antibiótica y resistencia en Streptococcus pneumoniae y Streptococcus pyogenes. Emerg Infect Dis 2004; 10(3): 514-517.
- Hillier S, et al: Antibióticos previos y riesgo de infección del tracto urinario adquirida en la comunidad resistente a los antibióticos: un estudio de casos y controles. J Antimicrob Chemother 2007; 60(1): 92-99.
- Nasrin D, et al: Efecto del uso de antibióticos betalactámicos en niños sobre la resistencia neumocócica a la penicilina: estudio prospectivo de cohortes. BMJ 2002; 324(7328): 28-30.
- Kahlert C, Müller P: Microbioma: el descubrimiento de un órgano. Swiss Med Forum 2014; 14(16-17): 342-344.
- Willing BP, Russell SL, Finlay BB: Cambiando el equilibrio: efectos de los antibióticos en el mutualismo huésped-microbiota. Nat Rev Microbiol 2011; 9(4): 233-243.
- Blaser MJ: La teoría de la desaparición de la microbiota y las epidemias de enfermedades crónicas. Nature reviews Immunology 2017; 17(8): 461-463.
- Ruppe E, et al.: Alta tasa de adquisición pero corta duración de la portación de enterobacteriáceas multirresistentes tras viajar a los trópicos. Clin Infect Dis 2015; 61(4): 593-600.
- Schuetz P, et al.: Menos es más: terapia antibiótica individualizada mediante la medición de la procalcitonina. Swiss Med Forum 2012; 12(46): 887-892.
- Gulliford MC, et al: Seguridad de la prescripción reducida de antibióticos para las infecciones autolimitadas de las vías respiratorias en atención primaria: estudio de cohortes mediante registros sanitarios electrónicos. BMJ 2016; 354: i3410.
- Cai T, et al: El papel de la bacteriuria asintomática en mujeres jóvenes con infecciones urinarias recurrentes: ¿tratar o no tratar? Clin Infect Dis 2012; 55(6): 771-777.
- Cai T, et al: El tratamiento de la bacteriuria asintomática se asocia a una mayor prevalencia de cepas resistentes a los antibióticos en mujeres con infecciones urinarias. Clin Infect Dis 2015; 61(11): 1655-1661.
- Chabok A, et al: Ensayo clínico aleatorizado de antibióticos en la diverticulitis aguda no complicada. The British journal of surgery 2012; 99(4): 532-539.
- Cremers AJ, et al: Efecto de la racionalización de los antibióticos en el resultado de los pacientes con bacteriemia neumocócica. J Antimicrob Chemother 2014; 69(8): 2258-2264.
- Llewelyn MJ, et al: El curso antibiótico ha tenido su día. BMJ 2017; 358: j3418.
- Dawson-Hahn EE, et al: Tratamiento antibiótico oral de corta duración frente al de larga duración para las infecciones tratadas en pacientes ambulatorios: una revisión de las revisiones sistemáticas. Práctica familiar 2017; 34(5): 511-519.
- Trubiano JA, Adkinson NF, Phillips EJ: La alergia a la penicilina no es necesariamente para siempre. JAMA 2017; 318(1): 82-83.
PRÁCTICA GP 2018; 13(4): 11-14