Se ha calculado que se pierden aproximadamente 1,8 millones de neuronas por minuto en el curso de un daño isquémico causado por una reducción del riego sanguíneo. Así que en el caso de un ictus agudo, hay que actuar con rapidez. El diagnóstico por imagen de urgencia permite un diagnóstico precoz y tiene una influencia decisiva en la terapia.
Cada 30 minutos, alguien sufre un derrame cerebral en Suiza. Aproximadamente el 25% de los afectados muere a causa de las consecuencias inmediatas, y alrededor de un tercio permanece discapacitado en diversos grados a lo largo de su vida [1]. En el 87% de los casos, un ictus es el resultado de una reducción aguda del riego sanguíneo en el contexto de una oclusión tromboembólica de un vaso o una estenosis de un vaso hemodinámicamente relevante, y en el 13% el resultado de una hemorragia intracraneal o subaracnoidea [2]. Se ha calculado que se pierden aproximadamente 1,8 millones de neuronas por minuto en el curso de un daño isquémico causado por una reducción del riego sanguíneo [3]. En el caso de un ictus agudo, hay que actuar con rapidez y se requiere una aclaración diagnóstica y una terapia inmediatas. El diagnóstico por imagen de urgencia permite un diagnóstico precoz y tiene una influencia decisiva en la terapia.
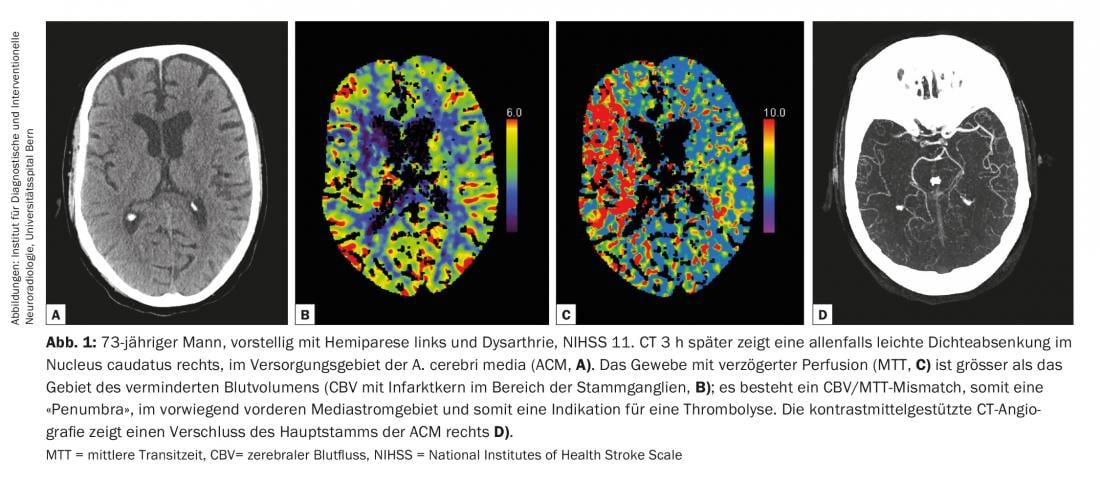
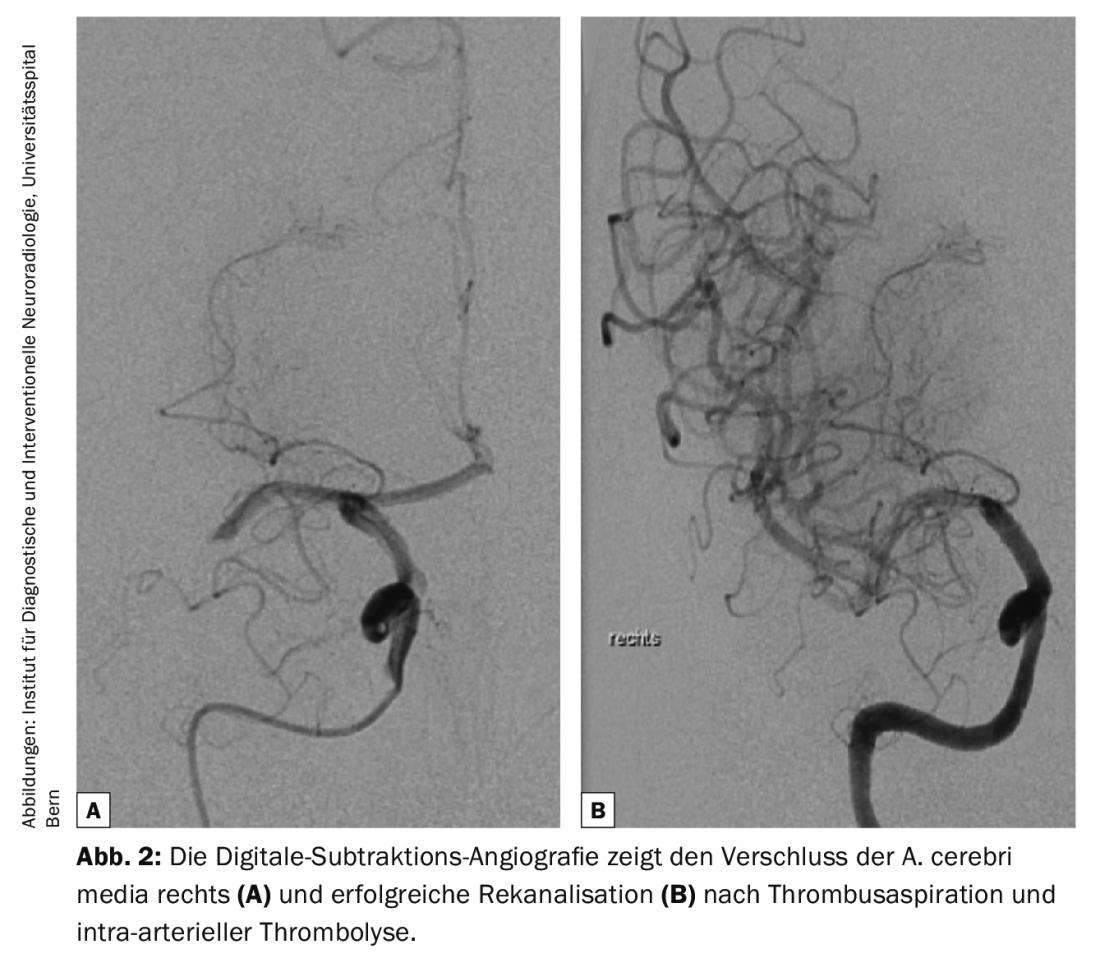
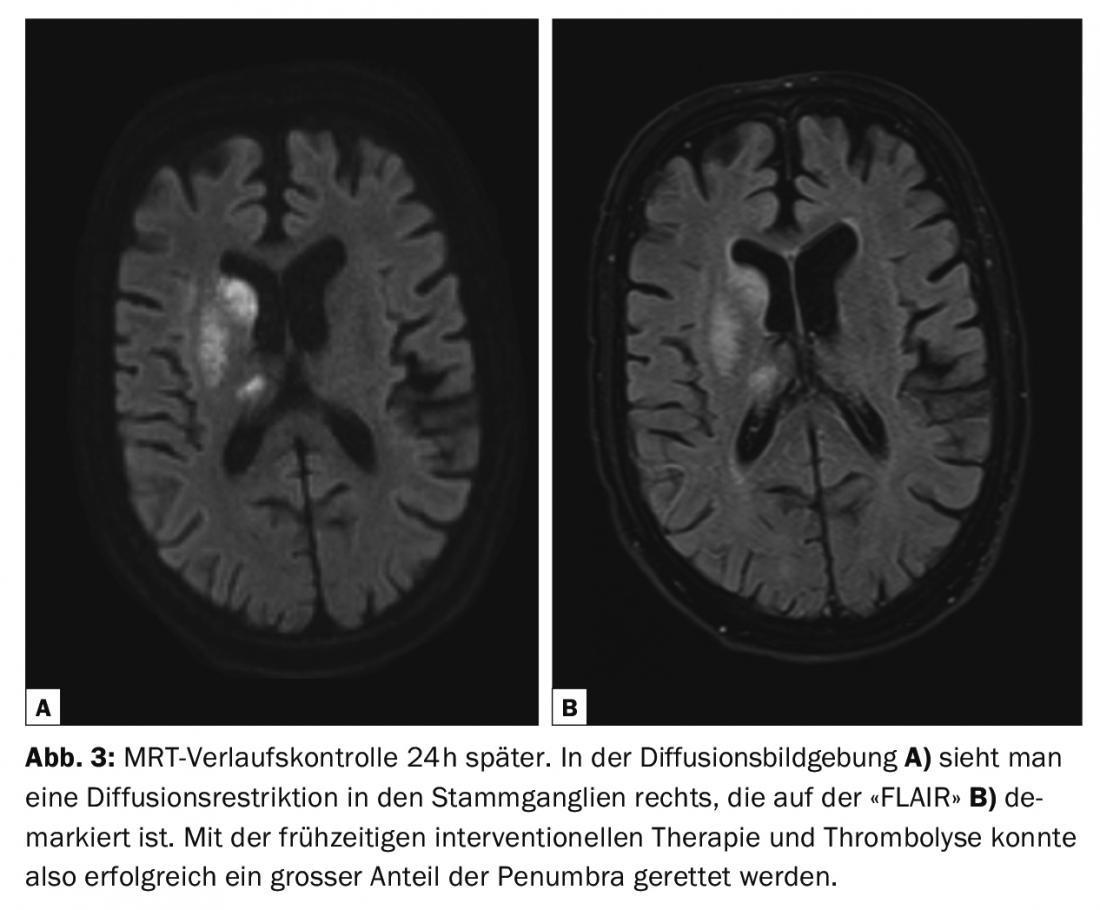
Las directrices de diagnóstico de la enfermedad cerebrovascular son actualizadas continuamente por el Colegio Americano de Radiología (ACR) y la Asociación Americana del Corazón/Asociación Americana del Ictus (AHA/ASA) [2,4]. Todas las modalidades, desde la tomografía computarizada (TC) y la resonancia magnética (RM) hasta la ecografía (US) y la angiografía por sustracción digital (ASD), tienen su lugar en el diagnóstico de las enfermedades cerebrovasculares [2] (Fig. 1-3). La TC y la RM se utilizan predominantemente en el diagnóstico del ictus agudo. Las siguientes preguntas deben responderse de forma fiable y rápida:
- ¿Hemorragia intracraneal?
- ¿Cierre del vaso?
- ¿Núcleo del infarto?
- ¿Parénquima cerebral potencialmente salvable (“penumbra isquémica” o “tejido en riesgo”)?
- ¿”Imitador de golpes”?
La indicación de trombólisis o terapia intervencionista se realiza conociendo la ventana temporal desde el inicio de los síntomas y los síntomas actuales, incluida la escala de ictus de los Institutos Nacionales de Salud (NIHSS), así como los diagnósticos secundarios relevantes, como los factores de riesgo cardiovascular.
Tomografía computarizada (TC)
El TAC está disponible las 24 horas del día en la mayoría de los hospitales y permite descartar una hemorragia intracraneal aguda de forma rápida y sencilla. La hemorragia intracraneal aguda ya es hiperdensa en la imagen nativa (60-90 UH, por tanto más brillante o densa que el tejido cerebral sano) y es una contraindicación absoluta para la trombólisis intravenosa [4].
En caso de isquemia causada por un aporte sanguíneo reducido (definido como flujo sanguíneo cerebral [CBF] <10 ml/100 g/min), el transporte de iones falla por falta de energía, lo que provoca la entrada de agua en las células (edema citotóxico) [5]. El aumento del contenido de agua en el tejido isquémico provoca una reducción de la densidad de la zona afectada y se hace visible como una diferenciación medular-cortical abolida (sobre todo en el córtex insular como “signo de la cinta insular”) o como hipodensidad en los ganglios basales y el campo medular. Esta reducción de la densidad debe interpretarse como un núcleo de infarto en el sentido de daño parenquimatoso irreversible. Sin embargo, la detección de cambios tan tempranos y a menudo sutiles requiere mucha experiencia y tiene una sensibilidad media del 66% (rango, 20% a 87%) en las tres primeras horas tras el inicio de los síntomas [2].
Un trombo intravascular, que se muestra hiperdenso, también puede ser visible en la imagen nativa. Este denominado “signo de la arteria hiperdensa” es muy específico pero poco sensible para una oclusión vascular y, al igual que otras estenosis u oclusiones vasculares, puede visualizarse con más detalle con ayuda de una angiografía por TC con contraste. La angiografía por TC permite evaluar todas las arterias aferentes cerebrales desde el arco aórtico hasta el vértice y, por tanto, también permite evaluar la circulación colateral o las anomalías vasculares que pueden complicar la intervención endovascular.
El parénquima cerebral potencialmente salvable, también llamado “penumbra” o “tejido en riesgo”, es la zona de hipoperfusión crítica (CBF 10-20 ml/100 g/min) [5]. Las neuronas de la “penumbra” son disfuncionales, aunque la disfunción es reversible con una reperfusión a tiempo. Con la oclusión persistente, se produce una pérdida gradual de la “penumbra”. Las imágenes de perfusión son necesarias para visualizar el núcleo del infarto, la “penumbra” (“tejido en riesgo”) y la oligemia benigna adyacente (“tejido sin riesgo”, CBF >20 ml/100 g/min, norma 60-80 ml/100 g/min). La perfusión por TC es una técnica de imagen dinámica mejorada con contraste que proporciona información sobre parámetros temporales como el tiempo medio de tránsito (TMT), el tiempo hasta el pico de la curva señal-intensidad-tiempo (TTP) y el tiempo de máximo de la llamada función residual (Tmáx), o sobre parámetros semicuantitativos como el flujo sanguíneo cerebral (FSC) y el volumen sanguíneo cerebral (VSC). La perfusión retardada se manifiesta por parámetros de perfusión temporal prolongados. La reducción del CBF en la “penumbra” conduce a una autorregulación vasogénica dependiente de la energía; el MTT y el TTP se prolongan, el CBV es normal o incluso aumenta ligeramente. Estos mecanismos compensatorios no están presentes en el núcleo del infarto, donde se produce un descenso del VSC [6]. En TC, la penumbra potencialmente salvable se estima tradicionalmente mediante el llamado “desajuste CBV/MTT”.
Imágenes por resonancia magnética (IRM)
En los centros de ictus, la RM está disponible las 24 horas del día y a menudo se prefiere a la TC porque proporciona más información adicional. El protocolo rutinario de examen por RM incluye imágenes de difusión (DWI), secuencia “FLAIR” o eco de espín ponderada en T2, “angiografía por RM con tiempo de vuelo” arterial (TOF-MRA), secuencia ponderada en susceptibilidad (SWI) o secuencia de eco de gradiente en T2* (T2*GRE), RM de perfusión, angiografía con contraste de los vasos que alimentan el cerebro y una secuencia ponderada en T1 tras la administración de contraste.
Las secuencias sensibles a los productos de degradación de la sangre (SWI o T2*GRE) también permiten visualizar un posible trombo intravascular. La longitud del trombo, medida en IRM o TC, tiene relevancia pronóstica, ya que una longitud superior a 8 mm se asocia a una mala recanalización tras la lisis i.v. [7].
Una mayor cantidad de desoxihemoglobina conduce a una depresión más prominente de la señal de RM de las arterias corticales, leptomeníngeas (“signo del vaso cortical”) y medulares profundas (“signo del cepillo”) en la secuencia ponderada de susceptibilidad y, por tanto, permite estimar la zona hipoperfundida [8].
En el ictus agudo y el ictus de despertar (momento de aparición de los síntomas desconocido), la comparación de las imágenes ponderadas por difusión y FLAIR permite la clasificación temporal. El edema citotóxico, que corresponde en gran parte al núcleo del infarto pero que también contiene algunas partes reversibles de la “penumbra”, puede delimitarse ya después de unos minutos en las imágenes de difusión (sensibilidad 88-100%, especificidad 95-100%) pero sólo después de unas 6 h post-ictus como realce de la señal en el “FLAIR”/T2 [2,9]. La secuencia ponderada en T1 tras la administración de contraste permite una clasificación temporal más detallada; cabe esperar una hiperemia meníngea en el periodo comprendido entre las 24 h y los 3-4 días, una disrupción de barrera del parénquima cerebral infartado en el periodo comprendido entre las 24 h y varias semanas o incluso meses [9].
Con la angiografía TOF, la IRM ofrece la posibilidad de obtener imágenes vasculares sensibles al flujo sin necesidad de administrar un medio de contraste y con una alta resolución espacial, además de la angiografía con medio de contraste. La perfusión por RM, al igual que la perfusión por TC, también proporciona información sobre parámetros temporales (MTT, TTP, Tmax) y semicuantitativos (CBV, CBF) tras la administración de un bolo de contraste. En la RM, la “penumbra” isquémica se define por una diferencia entre la alteración de la perfusión en los mapas MTT o TTP y la alteración de la difusión, como el llamado “desajuste difusión-perfusión” [2].
¿Qué diagnóstico por imagen es el adecuado?
En las directrices actuales de 2018 [4], las Asociaciones Estadounidenses del Corazón y el Ictus (AHA/ASA) recomiendan que todo paciente con sospecha de ictus agudo debe someterse en primer lugar a un TAC de cráneo nativo para descartar una hemorragia intracraneal. La obtención de imágenes de las arterias carótidas y vertebrales extra e intracraneales es apropiada en los posibles candidatos a la trombectomía mecánica para planificar el procedimiento, pero no debe retrasar la administración de alteplasa intravenosa si está indicada.

Además, en pacientes con grandes oclusiones proximales en la circulación anterior y en la ventana de tiempo comprendida entre las 6-24 h desde el inicio de los síntomas, se recomienda la obtención de imágenes de perfusión mediante TC o RM para la indicación de una posible trombectomía mecánica. Hoy en día, la obtención de imágenes puede realizarse a gran velocidad. Además, los candidatos a la trombectomía no pueden identificarse con suficiente fiabilidad clínica. Por lo tanto, utilizamos un protocolo de IRM en el paciente con ictus agudo con imágenes de perfusión y difusión, así como imágenes de los vasos que irrigan el cerebro. Para administrar el bolo de lisis i.v., se puede interrumpir brevemente el examen de RMN una vez descartada la hemorragia. En la práctica clínica diaria, la elección del diagnóstico por imagen depende principalmente de la infraestructura disponible y de la experiencia del centro correspondiente.
Sin embargo, la evaluación inicial mediante resonancia magnética ofrece algunas ventajas: Con la DWI, la RM ofrece una visualización sensible muy temprana del parénquima cerebral isquémico y es claramente superior a la TC en este aspecto. La IRM también es claramente superior a la TC para la sospecha clínica de infartos infratentoriales en el tronco encefálico y el cerebelo [10]. Así, los pacientes con déficits neurológicos difíciles de clasificar clínicamente pueden diferenciarse de forma fiable en pacientes con isquemia aguda o con un “imitador de ictus” como la migraña hemipléjica, la parálisis de Todd o una enfermedad de los nervios craneales [11]. Para la detección de otras causas raras de ictus, como la disección vascular, la displasia fibromuscular o la trombosis venosa sinusal o cerebral, se prefiere la IRM. La clasificación temporal superior del infarto en la RM permite una decisión más diferenciada en cuanto a la terapia intervencionista. Los efectos potencialmente perjudiciales de las radiaciones ionizantes y de los agentes de contraste de la TC que contienen yodo son otro factor importante en la elección adecuada de la toma de imágenes. Las principales desventajas de la RM son el mayor tiempo de examen, de unos 15 min, en comparación con la TC multimodal, con unos 5 min, así como la mayor dificultad de viabilidad con pacientes que requieren monitorización y pacientes inquietos. Si la idoneidad de la RM del paciente es cuestionable, debe realizarse un TC en esta situación aguda.
Mensajes para llevarse a casa
- La información de las imágenes relevante para la terapia es: Exclusión de la hemorragia, detección de la isquemia o del núcleo del infarto, “penumbra” en caso necesario, oclusión del vaso y longitud del trombo. La TC y la RM responden a estas preguntas y se utilizan en la práctica clínica diaria dependiendo principalmente de la infraestructura existente y de la experiencia de la clínica respectiva.
- La resonancia magnética es muy útil para evaluar a pacientes con déficits neurológicos difíciles de clasificar clínicamente y con sospecha de isquemia del tronco encefálico.
- Los pacientes con déficits neurológicos en regresión también deben someterse a un estudio completo del ictus y a pruebas de imagen. La experiencia demuestra que estos pacientes pueden deteriorarse clínicamente con rapidez.
- Según las nuevas directrices de la AHA/ASA, un protocolo de ictus por TC o RM debe incluir series nativas para excluir hemorragias y/o detectar isquemia, así como imágenes vasculares. Sin embargo, esto último no debe retrasar la trombólisis intravenosa si está indicada.
Literatura:
- Oficina Federal de Salud Pública, Indicadores de calidad de los hospitales suizos de agudos, Indicadores de calidad número de casos: B1.1.M HD Apoplejía todas las formas (edad >19), 2015 (www.bag.admin.ch/bag/de/home/service/zahlen-fakten/zahlen-fakten-zu-spitaelern/qualitaetsindikatoren-der-schweizer-akutspitaeler/qualitaetsindikatoren-fallzahl.exturl.html/aHR0cDovL3d3dy5iYWctYW53LmFkbWluLmNoLzIwMTZfdGFnbG/FiLzIwMTZfc3BpdGFsc3RhdGlzdGlrL3BvcnRhbC5waHA_cD1x/aWZhbGx6Jmxhbmc9ZGUmYmFza2V0PSU3Q2IxLjElN0MwJnF5PT/IwMTY=.html)
- DeLaPaz RL, et al: ACR Appropriateness Criteria on Cerebrovascular Disease. J Am Coll Radiol 2011; 8(8): 532-538.
- Ahorrador JL: El tiempo es cerebro – cuantificado. Ictus 2006; 37: 263-266.
- Powers WJ, et al: 2018 Guidelines for the Early Management of Patients With Acute Ischemic Stroke: A Guideline for Healthcare Professionals From the American heart Association / American Stroke Association. Ictus 2018; 49: e46-e110. doi: 10.1161/STR.0000000000000158.
- Astrup J, et al: Umbrales en la isquemia cerebral – la penumbra isquémica. Ictus 1981; 12(6): 723-725.
- Knash M, et al: El bajo volumen sanguíneo cerebral sólo predice la restricción de difusión en el ictus hiperagudo. Ictus 2010; 41(12): 2795-2800.
- Riedel CH, et al.: La importancia del tamaño: el éxito de la recanalización mediante trombólisis intravenosa en el ictus anterior agudo depende de la longitud del trombo. Ictus 2011; 42(6): 1775-1777.
- Morita N, et al: Hallazgos isquémicos de la resonancia magnética de 3 teslas ponderada en T2* en pacientes con ictus agudo. Cerebrovasc Dis 2008; 26(4): 367-375.
- Allen LM, et al: Hallazgos de imagen por RM específicos de la secuencia que son útiles para datar el ictus isquémico. Radiografía 2012; 32(5): 1285-1297.
- Wintermark M, et al: Recomendaciones de diagnóstico por imagen para pacientes con ictus agudo y ataque isquémico transitorio: Declaración conjunta de la Sociedad Americana de Neurorradiología, el Colegio Americano de Radiología y la Sociedad de Cirugía Neurointervencionista. J Am Coll Radiol 2013; 10(11): 828-832.
- Birenbaum D, Bancroft LW, Felsberg GJ: Imagen en el ictus. West J Emerg Med 2011; 12(1): 67-76.
CARDIOVASC 2018; 17(2): 16-19