La leucemia linfoblástica aguda es el cáncer infantil más frecuente. Se trata de forma adaptada al riesgo y es curable en la mayoría de los casos. Nuevos fármacos innovadores, como las inmunoterapias, se encuentran en fase de ensayo clínico.
Con una cuota de alrededor del 30% y 3,3 nuevos casos por cada 100.000 habitantes menores de 15 años, la leucemia linfoblástica aguda (LLA) es el cáncer infantil más frecuente. El pico de edad se sitúa en torno a los cinco años. En Suiza, cada año se diagnostica LLA a unos 50-60 niños. El subtipo inmunológicamente más común en la infancia es la LLA de precursores B, que se desarrolla a partir de células inmaduras de la serie B del sistema linfático. La totalidad de la linfopoyesis T se produce con menor frecuencia. Una forma especial es la leucemia de células B maduras, que se basa en una transformación maligna de las células B maduras y se entiende como una manifestación leucémica del linfoma de Burkitt. La LLA es una enfermedad heterogénea caracterizada por la proliferación incontrolada de células progenitoras linfoides en la médula ósea y la sangre periférica [1]. Actualmente se considera una enfermedad que a menudo presenta grandes similitudes morfológicas pero que puede tener subentidades citogenéticas o genético moleculares muy heterogéneas [2], lo que también se correlaciona con una respuesta clínica heterogénea al tratamiento. Con las modernas técnicas de secuenciación, se puede demostrar la enorme heterogeneidad clonal de esta enfermedad.
Causas
La causa del desarrollo de la leucemia aún no está clara. Factores conocidos pero poco frecuentes son las radiaciones ionizantes y los síndromes congénitos. Sin embargo, esto explica menos del 10% de todas las enfermedades. Los niños con síndrome de Down tienen un riesgo aproximadamente 20 veces mayor de desarrollar leucemia (LLA o leucemia mieloblástica aguda) en los primeros cinco años de vida en comparación con los niños sanos no afectados. Sin embargo, la mieloproliferación transitoria se produce incluso con mayor frecuencia (en un 3-10%) en estos niños en el periodo neonatal, que en ocasiones puede convertirse posteriormente en leucemia. Otras alteraciones congénitas poco frecuentes con un mayor riesgo de leucemia son la ataxia teleangiectásica, el síndrome de Fanconi y otros síndromes asociados a una inmunodeficiencia o a una mayor fragilidad cromosómica. El hecho de que la LLA se produzca con mayor frecuencia entre el segundo y el quinto año de vida, que la enfermedad sea más común en los países industrializados y la observación de que en el pasado se han producido repetidamente agrupaciones, especialmente en regiones de nuevas aglomeraciones, han dado lugar a diversas hipótesis asociadas a infecciones para el desarrollo de la leucemia [3,4].
Síntomas
La proliferación de blastos leucémicos en la médula ósea provoca un desplazamiento de la hematopoyesis normal, lo que explica los síntomas más comunes como la palidez y la fatiga debidas a la anemia o la tendencia a las hemorragias debida a la trombocitopenia. Las infiltraciones provocan con frecuencia dolores óseos difusos y artropatías alternas, que en ocasiones se manifiestan en niños pequeños como reticencia a moverse o incluso rechazo a caminar. Además, puede producirse inflamación de los ganglios linfáticos y organomegalia.
Diagnóstico
En la sangre, es frecuente encontrar alteraciones en al menos dos series de células sanguíneas, con mayor frecuencia trombocitopenia con anemia simultánea. El recuento de leucocitos puede ser normal, estar disminuido o aumentado. La morfología del hemograma proporciona pistas diagnósticas importantes, el diagnóstico definitivo se realiza mediante aspiración de médula ósea. Además de examinar la morfología, se determina el inmunofenotipo de los blastos leucémicos mediante citometría de flujo (FACS) y se realiza un análisis cromosómico. El inmunofenotipado permite determinar el estadio de desarrollo del clon celular correspondiente. El subtipo de leucemia más frecuente en niños, la denominada “LLA común”, se caracteriza por la expresión de los marcadores de células B CD10 y CD19. La expresión de antígenos mieloides, normalmente sin importancia pronóstica, puede detectarse hasta en la mitad de los casos de LLA. Hoy en día, los exámenes citogenéticos y de genética molecular son cada vez más importantes. Es importante reconocer los subgrupos más importantes, ya que tienen implicaciones terapéuticas. Por un lado, se buscan alteraciones cromosómicas numéricas como la hiperdiploidía o la hipodiploidía, así como alteraciones estructurales como translocaciones, por ejemplo t(12;21) (fusión de los genes ETV6/RUNX1) o t(9;22) (fusión de BCR/ABL1), reordenamientos MLL (MLL 11q23) y otras alteraciones.
Clásicamente, la detección de estos cambios se realiza mediante citogenética convencional (banda G) y/o hibridación fluorescente in situ (FISH) en las células leucémicas. En los últimos años, la medición de la enfermedad mínima residual (EMR) de la médula ósea se ha establecido como parte del diagnóstico de seguimiento para evaluar la respuesta de la leucemia al tratamiento. En la actualidad, la respuesta a la terapia se ha convertido en uno de los parámetros pronósticos más importantes. Hoy en día, en el diagnóstico de la progresión se utilizan esencialmente dos métodos que se complementan en la práctica clínica diaria. El método más sensible es el seguimiento de los reordenamientos de los receptores de inmunoglobulinas y células T. Inicialmente, se buscan reordenamientos clonales específicos de la leucemia, que se siguen con PCR cuantitativa en puntos temporales específicos de la terapia. El límite de detección así alcanzado es de aproximadamente una célula de leucemia por cada 100.000 células normales de médula ósea. Una técnica para la medición de la MRD que es aproximadamente un nivel logarítmico menos sensible se basa en el seguimiento del inmunofenotipo asociado a la leucemia mediante FACS. Puede alcanzarse una sensibilidad del 0,001% [5].
Tratamiento
En los años 70, menos del 30% de los niños sobrevivían a la enfermedad, mientras que hoy en día casi el 85% de los pacientes pueden curarse a largo plazo (Fig. 1) . Los avances en las tasas de supervivencia durante los últimos diez a quince años se han logrado principalmente gracias a una mejor estratificación del riesgo y al consiguiente tratamiento adaptado al mismo. La terapia actual de primera línea de la LLA consiste esencialmente en la combinación de corticosteroides, una depleción de aminoácidos o sustratos (asparaginasa, metotrexato), sustancias alquilantes, antimetabolitos, bloqueantes metafásicos clásicos y antraciclinas [6]. Las sustancias más nuevas, las llamadas terapéuticas “dirigidas”, sólo se han utilizado hasta ahora de forma muy limitada en el tratamiento de la LLA pediátrica, con algunas excepciones como los inhibidores de la tirosina quinasa en la LLA con cromosoma Filadelfia positivo. Recientemente se han identificado nuevos subgrupos poco frecuentes de LLA de precursores B, los denominados “tipo Filadelfia” (o “tipo BCR-ABL”), que por un lado muestran un riesgo significativamente mayor de recurrencia, pero por otro podrían ser candidatos potenciales a terapias dirigidas [7]. Sin embargo, para la mayoría de los nuevos criterios genéticos de alto riesgo, también se ha podido demostrar que su influencia varía en función de la respuesta terapéutica medible.
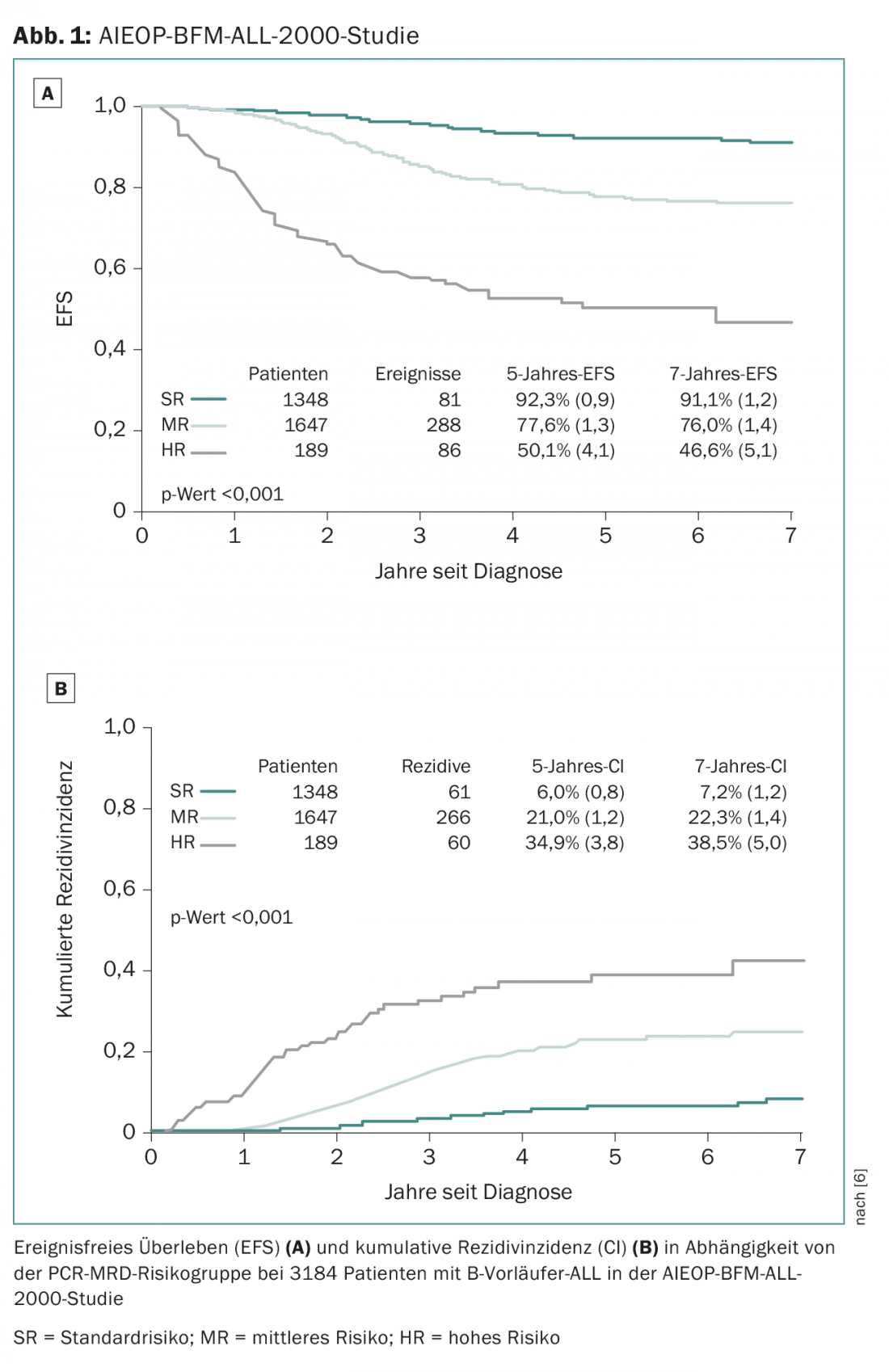
La mayoría de los centros de oncología pediátrica suizos tratan a sus pacientes en el marco de los estudios del grupo de estudio ALL-BFM, una asociación de centros de oncología pediátrica alemanes, austriacos y suizos, que ha contribuido significativamente a la mejora de la terapia de la LLA en numerosos estudios terapéuticos aleatorizados a gran escala desde 1976. Después de que la mayor parte de los avances en los anteriores ensayos ALL-BFM se consiguieran mediante ajustes en la clasificación de los grupos de riesgo y la individualización del tratamiento, se están utilizando por primera vez nuevos fármacos prometedores en el estudio de seguimiento AIEOP-BFM ALL 2017, que se está planificando actualmente. La llamada “columna vertebral” del tratamiento está representada por los fármacos clásicos del tratamiento de la LLA mencionados anteriormente. Además, los nuevos medicamentos innovadores se someten a pruebas aleatorias para determinar sus posibles beneficios. El estudio AIEOP-BFM-2017 previsto definirá nuevos grupos citogenéticos de alto riesgo (resumen 1) que tendrán acceso a nuevos enfoques terapéuticos innovadores. Uno de estos nuevos subgrupos se define por la presencia de una deleción IKZF1 en combinación con una deleción CDKN2A, CDKN2B, PAX5 o PAR1 en ausencia de una deleción ERG y se denomina IKZF1plus. En estudios anteriores, alrededor del 10-15% de los pacientes podían identificarse como ICZF1plus y éstos tenían una tasa de recurrencia significativamente mayor que los pacientes ICZF1plus-negativos [8]. Uno de estos nuevos fármacos que se utilizará en un pequeño grupo de grupos de alto riesgo con un pronóstico especialmente desfavorable es el blinatumomab, un anticuerpo biespecífico de células T (BiTE) que se dirige simultáneamente al receptor CD3 de células T y a la proteína de superficie CD19 de células B [9]. El blinatumomab pretende combinar dos efectos potenciales: Reducción de las toxicidades agudas y a largo plazo mediante el ahorro de la quimioterapia convencional y una terapia más eficaz de los pacientes que hasta ahora sólo han respondido de forma insatisfactoria a la terapia de alto riesgo.

Otro nuevo fármaco con un nuevo modo de acción en la terapia de primera línea de la LLA es el inhibidor del proteasoma bortezomib. Dado que los intentos anteriores de intensificación tardía de la terapia en pacientes de alto riesgo han tenido poco éxito, y debido a las toxicidades ya de por sí elevadas de las terapias de alto riesgo (AR), el bortezomib se asignará aleatoriamente a pacientes AR en la fase temprana posterior a la reinducción en el próximo ensayo.
Sistema nervioso central (SNC)
Hoy en día, la prevención de una recaída en el SNC se realiza sobre todo con fármacos, por un lado con inyecciones intratecales de metotrexato, por otro administrando fármacos citostáticos de acción sistémica que se infiltran en el cerebro (por ejemplo, altas dosis de metotrexato). Esto permitió limitar a situaciones de riesgo muy especiales la radioterapia más temprana del SNC, que condujo a una reducción espectacular de las recidivas en el SNC pero se asoció a efectos tardíos nada desdeñables [10,11].
Trasplante de células madre
Después de que los resultados de la terapia primaria así como los protocolos de recaída de las leucemias mejoraran significativamente con el tiempo, esto también condujo a un ajuste continuo de la indicación de terapias de dosis altas con reinfusión de células madre. La indicación actual del trasplante de células madre (TCM) como parte de la terapia primaria se reserva para determinados subgrupos citogenéticos de pronóstico desfavorable como t(9;22), hipodiploidías con menos de 44 cromosomas en los blastos e IKZF1plus en combinación con una respuesta insuficiente a la terapia (MRD) a lo largo del tiempo [12]. La experiencia del grupo BFM ha demostrado que el éxito del tratamiento de las recaídas depende del momento en que se produzca la recaída, del patrón de la leucemia y del subtipo de leucemia [13]. Sin embargo, también se ha demostrado en este caso que la respuesta a la terapia tras la inducción de la terapia renovada y, por tanto, la dinámica de la disminución de la enfermedad mínima residual tiene una importancia pronóstica particular y los elementos de terapia adicionales, como el uso de SCT, pueden alinearse en consecuencia [14].
Nuevas terapias
Con unas pocas excepciones (clofarabina, nelarabina, imatinib), no ha habido nuevas aprobaciones para la LLA pediátrica en los últimos diez a quince años. Sin embargo, en la actualidad existen varios enfoques terapéuticos interesantes en ensayos clínicos en estudios de fase I-III. Además del ya mencionado blinatumomab, también se incluyen las células T con receptores de antígenos quiméricos (CAR), con las que ya se han tratado con éxito las recaídas de la LLA CD19-positiva. También se trata de una inmunoterapia que aprovecha el potencial de las células T citotóxicas autólogas para reconocer y destruir las células de la línea celular B. Otras inmunoterapias prometedoras, algunas de ellas combinadas con citostáticos, se encuentran actualmente en ensayos de fase I/II. Además de las inmunoterapias, las terapias dirigidas tras ensayos previos in vitro en modelos de xenoinjertos o líneas celulares o los inhibidores específicos contra genes de fusión detectados citogenéticamente también representan opciones terapéuticas interesantes y prometedoras.
Mensajes para llevarse a casa
- La leucemia linfoblástica aguda, el cáncer infantil más frecuente, se trata de forma adaptada al riesgo y es curable en la mayoría de los casos.
- La determinación de la enfermedad mínima residual tras la inducción de la terapia es uno de los factores pronósticos más importantes junto con marcadores biológicos como el subtipo leucémico y los cambios citogenéticos y genéticos moleculares en los blastos leucémicos.
- Los avances actuales persiguen un tratamiento más eficaz y específico de los subtipos de leucemia previamente resistentes, así como una reducción de la toxicidad de la terapia.
- Nuevos fármacos innovadores como las inmunoterapias y los enfoques terapéuticos individualizados se encuentran en fase de ensayo clínico.
Literatura:
- Jabbour E, et al: Nuevos conocimientos sobre la fisiopatología y la terapia de la leucemia linfoblástica aguda del adulto. Cáncer 2015; 121(15): 2517-2528.
- Pui CH, et al: Biología, estratificación del riesgo y terapia de las leucemias agudas pediátricas: una actualización. J Clin Oncol 2011; 29(5): 551-565.
- Kinlen L, et al: Infecciones y factores inmunitarios en el cáncer: el papel de la epidemiología. Oncogene 2004; 23: 60-75.
- Greaves M, et al: Infección, respuestas inmunitarias y etiología de la leucemia infantil. Nat Rev Cancer 2006; 6(3): 193-203.
- Campano D, et al: Seguimiento de la enfermedad residual mínima en la leucemia linfoblástica aguda infantil. Curr Opin Hematol 2012; 19: 313-318.
- Conter V, et al: La respuesta molecular al tratamiento redefine todos los factores pronósticos en niños y adolescentes con leucemia linfoblástica aguda de células B precursoras: resultados en 3184 pacientes del estudio AIEOP-BFM ALL 2000. Sangre 2010; 115(16): 3206-3214.
- Loh ML, et al: Secuenciación del cinoma de tirosina de la leucemia linfoblástica aguda pediátrica: un informe del Proyecto TARGET del Grupo de Oncología Infantil. Sangre 2013; 121(3): 485-488.
- Hinze L, et al: Impacto pronóstico de las deleciones de IKZF1 en asociación con pulsos de vincristina-dexametasona durante el tratamiento de mantenimiento de la leucemia linfoblástica aguda infantil en el ensayo ALL-BFM 95. Leukemia 2017; 31: 1840-1842.
- Brentjens RJ, et al.: Seguridad y persistencia de células T autólogas dirigidas a CD19 transferidas adoptivamente en pacientes con leucemias de células B en recaída o refractarias a la quimioterapia. Sangre 2011; 118(18): 4817-4828.
- Möricke A, et al.: La terapia ajustada al riesgo de la leucemia linfoblástica aguda puede disminuir la carga del tratamiento y mejorar la supervivencia: resultados del tratamiento de 2169 pacientes pediátricos y adolescentes no seleccionados inscritos en el ensayo ALL-BFM 95. Blood 2008; 111(9): 4477-4489.
- Kamps WA, et al: Tratamiento orientado al BFM para niños con leucemia linfoblástica aguda sin irradiación craneal y reducción del tratamiento para pacientes de riesgo estándar: resultados del protocolo ALL-8 del DCLSG (1991-1996). Leucemia 2002; 16(6): 1099-1111.
- Balduzzi A, et al: Quimioterapia frente a trasplante alogénico para la leucemia linfoblástica aguda infantil de muy alto riesgo en primera remisión completa: comparación mediante aleatorización genética en un estudio prospectivo internacional. Lancet 2005; 366: 635-642.
- Tallen G, et al: Resultados a largo plazo en niños con leucemia linfoblástica aguda en recaída tras la estratificación del punto temporal y del lugar de recaída y la quimioterapia multifarmacológica intensificada de corta duración: resultados del ensayo ALL-REZ BFM 90. J Clin Oncol 2010; 28: 2339-2347.
- Eckert C, et al: La enfermedad residual mínima tras la inducción es el factor predictivo más potente del pronóstico en la leucemia linfoblástica aguda recidivante de riesgo intermedio – Resultados a largo plazo del ensayo ALL-REZ BFM P95/96. Eur J Cancer 2013 Apr; 49(6): 1346-1355.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2017; 5(5): 30-33