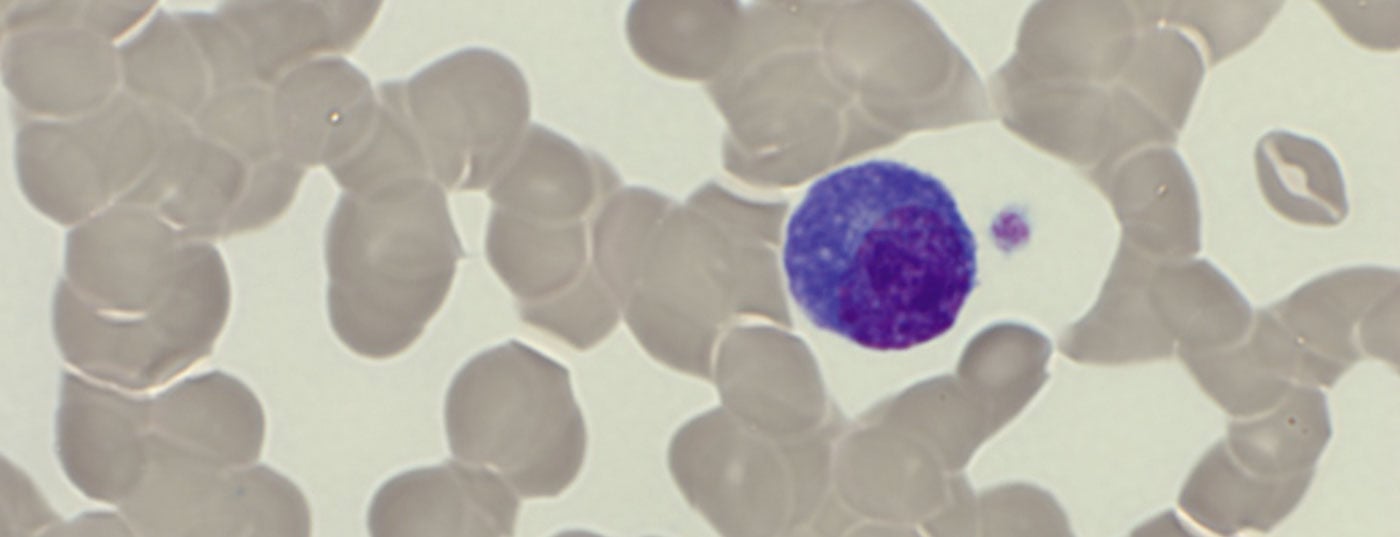
Las plasmocitosis reactivas son raras, pero entonces a menudo pronunciadas. Deben probarse frente a un P reactivo (policlonal) y monoclonallasma la proliferación celular. Un diagnóstico diferencial preciso permite una terapia eficaz.
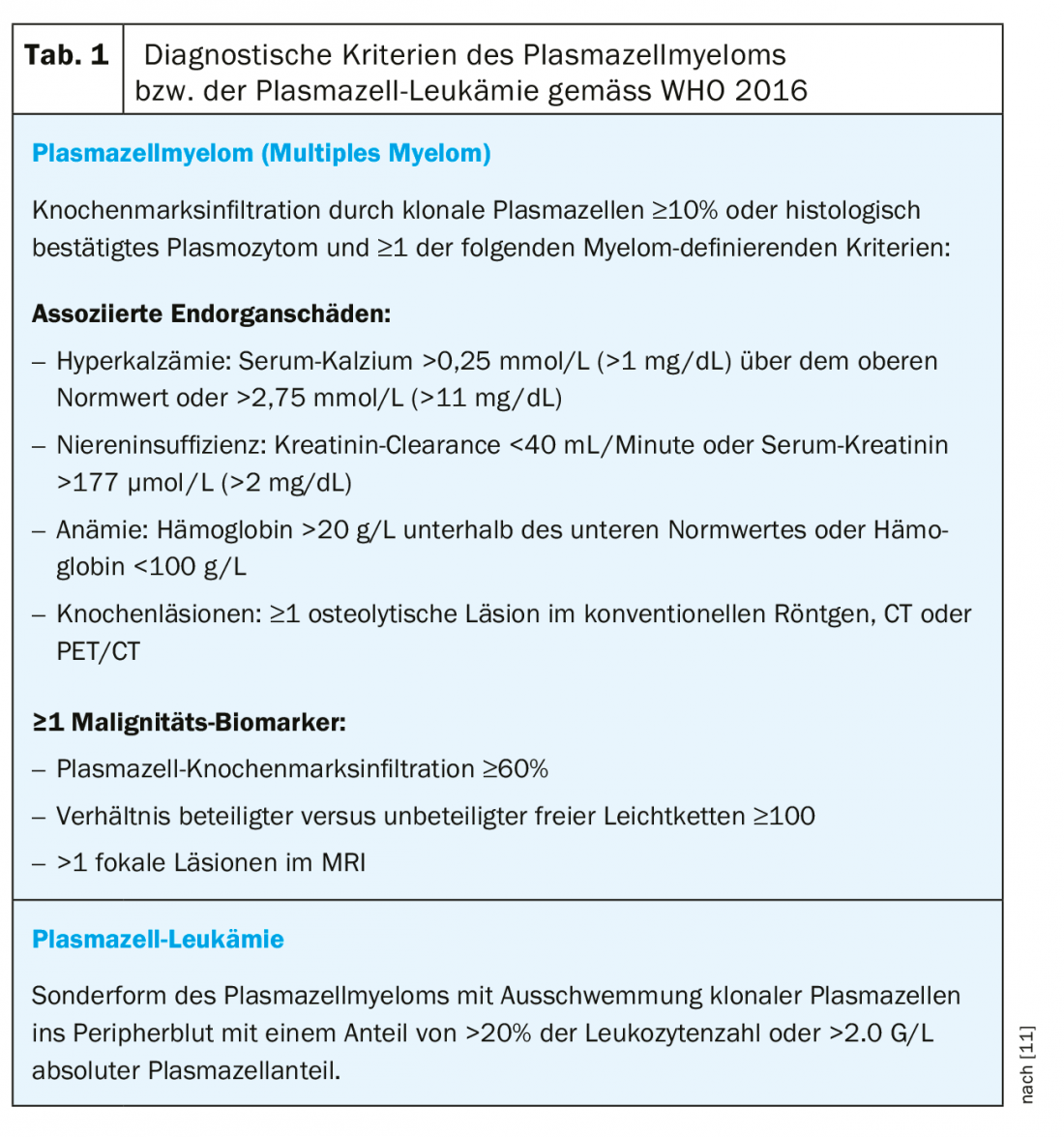
La plasmocitosis reactiva se describió por primera vez en 1988 como una proliferación policlonal de células plasmáticas en sangre periférica y es poco frecuente en general [1,2]. Las enfermedades asociadas a la proliferación de células plasmáticas reactivas incluyen, por un lado, los procesos no neoplásicos como las enfermedades autoinmunes, las infecciones y las anemias por deficiencia de sustrato y, por otro, los procesos malignos, neoplásicos, especialmente las enfermedades tumorales hematológicas [3,4]. En la mayoría de los casos, la extensión de la proliferación de células plasmáticas es pequeña y suele limitarse a la médula ósea, pero es posible que se produzca una plasmocitosis pronunciada que puede llevar a sospechar el diagnóstico de leucemia de células plasmáticas (Tab. 1) [3–10].
Informe de un caso
Una paciente de 70 años acudió al servicio de urgencias de un hospital regional por disnea aguda agravada. Dos semanas antes, el médico de cabecera inició una terapia antibiótica por un cuadro clínico de neumonía. Debido a la disnea persistente más allá de la terapia antibiótica, se realizó un TAC torácico, que reveló émbolos pulmonares subsegmentarios en ambos lados y linfadenopatías difusas hasta un diámetro máximo de 16 mm. Se estableció la anticoagulación oral con edoxaban y se planificó un estudio de las linfadenopatías.
En el servicio de urgencias, la paciente se presentó taquidisneica con una frecuencia respiratoria de 35/min y una saturación de oxígeno del 93% por debajo de los 5 litros de oxígeno por minuto. Por lo demás, los signos vitales eran los siguientes: Tensión arterial 119/81 mmHg, pulso 81/min, temperatura 35,6°C. La exploración física reveló ruidos respiratorios obstructivos y estridor inspiratorio. El resto de la exploración física no presentaba observaciones. Debido a la respiración obstructiva, se administraron 125 mg de metilprednisolona a modo de prueba, lo que produjo un alivio parcial de la disnea.
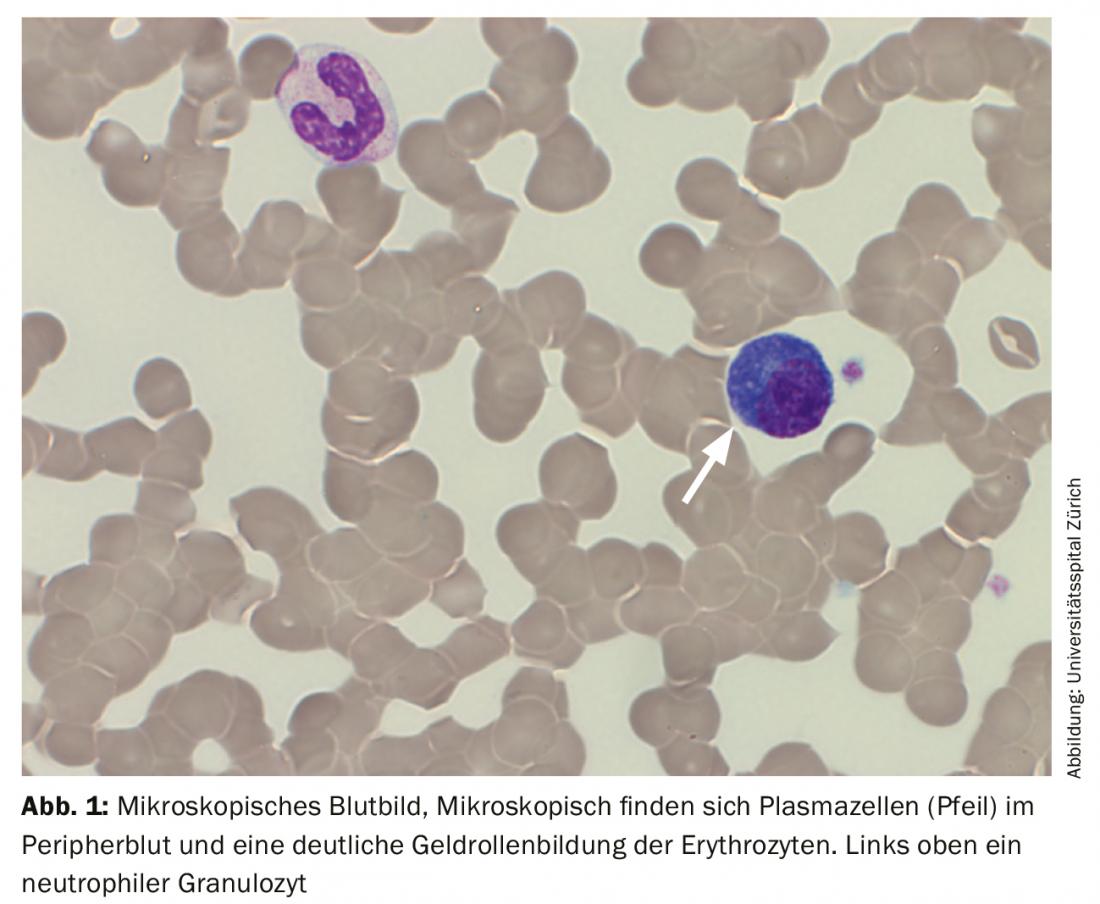
La sangre periférica mostró anemia con una hemoglobina de 77 g/L, valores normales de plaquetas y una leucocitosis de 20,4 G/L, debida a un lavado del 29,5% de células plasmáticas. Además, se observó una fuerte formación de gel de los eritrocitos como indicio de la presencia de paraproteinemia. Apropiadamente, había un aumento de la proteína sérica total de 106 g/L (rango de referencia: 62-80 g/L) con un ligero descenso simultáneo de la albúmina de 28 g/L (rango de referencia: 32-46 g/L) y un aumento de la lactato deshidrogenasa (LDH) de 987 U/L (rango de referencia: 232-430 U/L).
Esta constelación de hallazgos condujo a la sospecha diagnóstica de leucemia de células plasmáticas y la disnea aguda se interpretó como un posible signo de síndrome de hiperviscosidad. Por lo tanto, la paciente fue remitida al hospital de nuestro centro para la evaluación de la plasmaféresis.
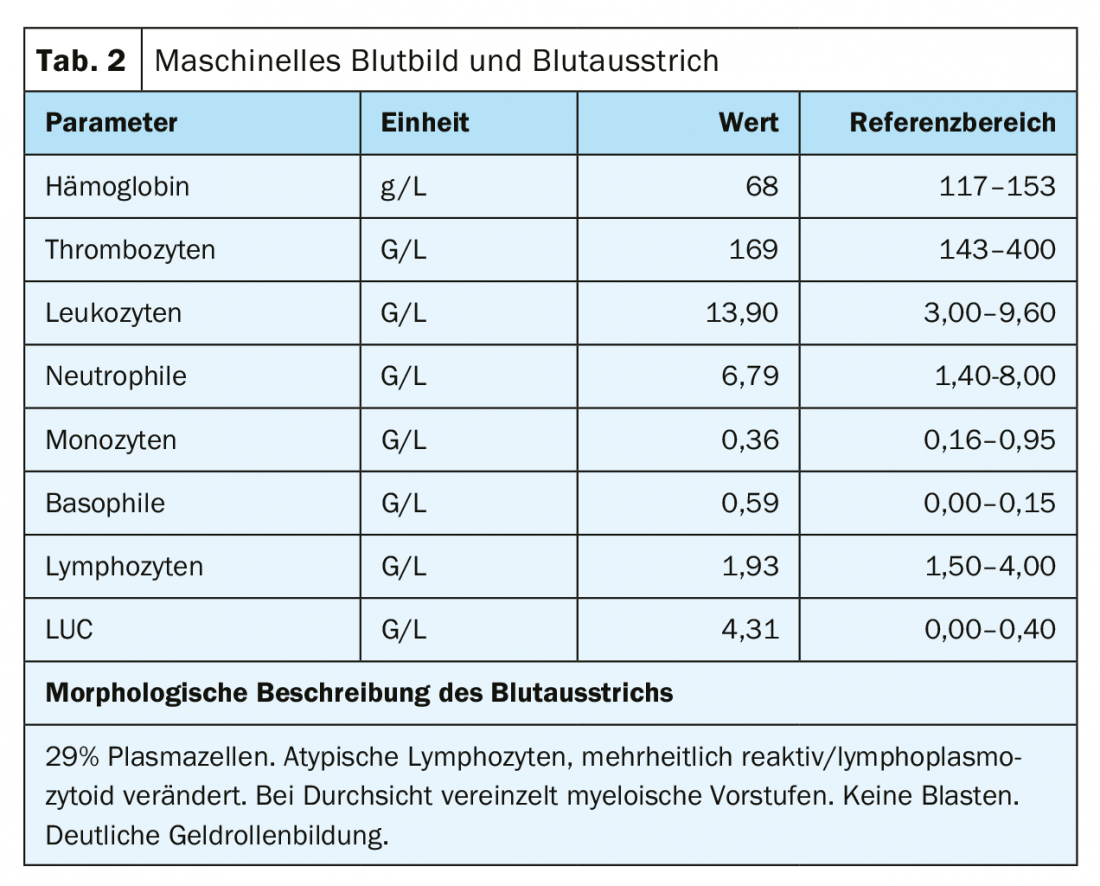
Al ingreso, la paciente se encontraba en una condición cardiopulmonar estable con una situación respiratoria compensada. No había otros síntomas que requirieran tratamiento, posiblemente asociados a la hiperviscosidad, por lo que no había indicación de plasmaféresis. Se confirmó el impresionante hallazgo externo de una plasmocitosis periférica del 29%. (Tab. 2) (Fig. 1). Los análisis de sangre posteriores revelaron un marcado aumento de las inmunoglobulinas (IgG, IgM, IgA), así como de las cadenas ligeras libres en el suero, pero con una proporción de cadenas ligeras poco visible. (Tab. 3). Se detectó una banda lambda IgM ancha en la inmunofijación, pero no fue posible diferenciar de forma fiable entre una banda clonal con di/multimerización y un patrón policlonal. La β2-microglobulina también estaba elevada a 17,6 mg/L (rango de referencia <2,5 mg/L). Para profundizar en el diagnóstico, fue necesario realizar un esclarecimiento de la clonalidad de las células plasmáticas mediante inmunofenotipado.
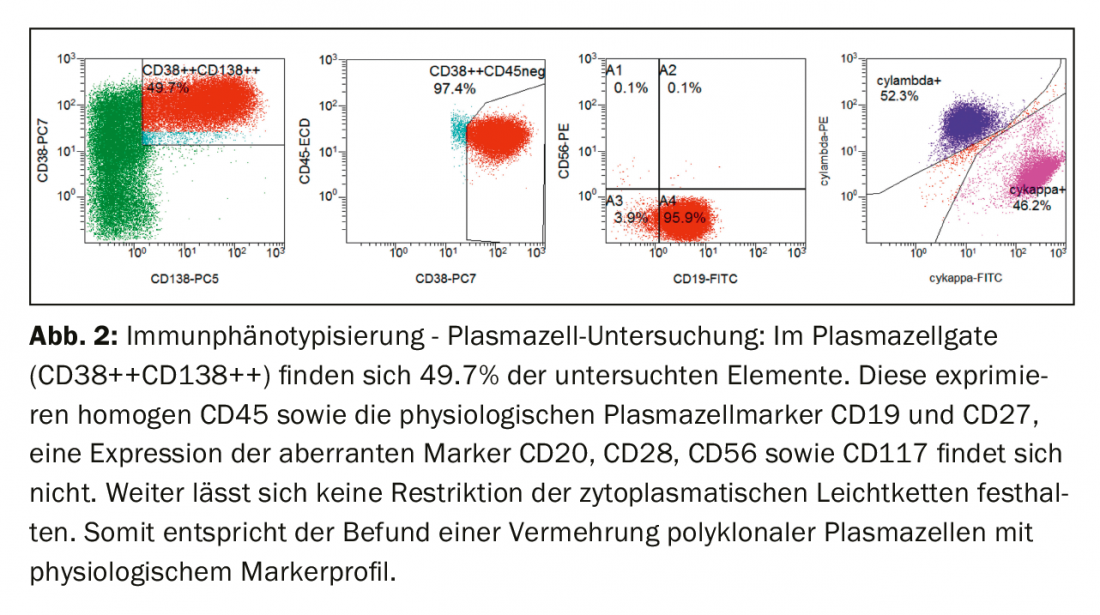
Inmunofenotípicamente, las células plasmáticas de la sangre periférica estaban claramente aumentadas en la puerta clásica de las células plasmáticas (CD38++CD138++). Éstas mostraban la expresión de CD45, así como de los marcadores fisiológicos de células plasmáticas CD19 y CD27. No se encontró expresión de marcadores aberrantes (CD20, CD28, CD56 y CD117), ni restricción de las cadenas ligeras citoplasmáticas, por lo que en resumen había una proliferación de células plasmáticas policlonales (Fig. 2).
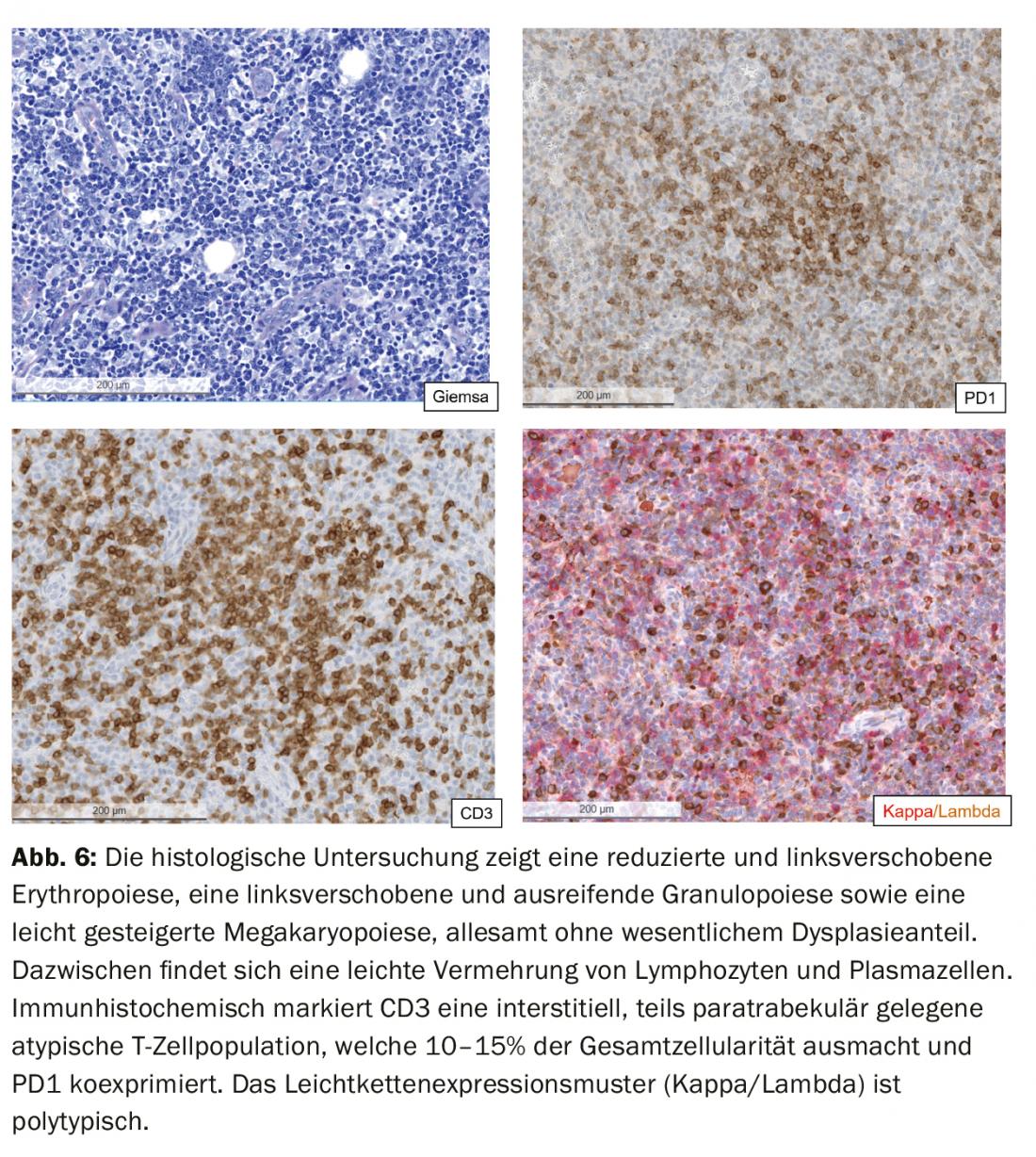
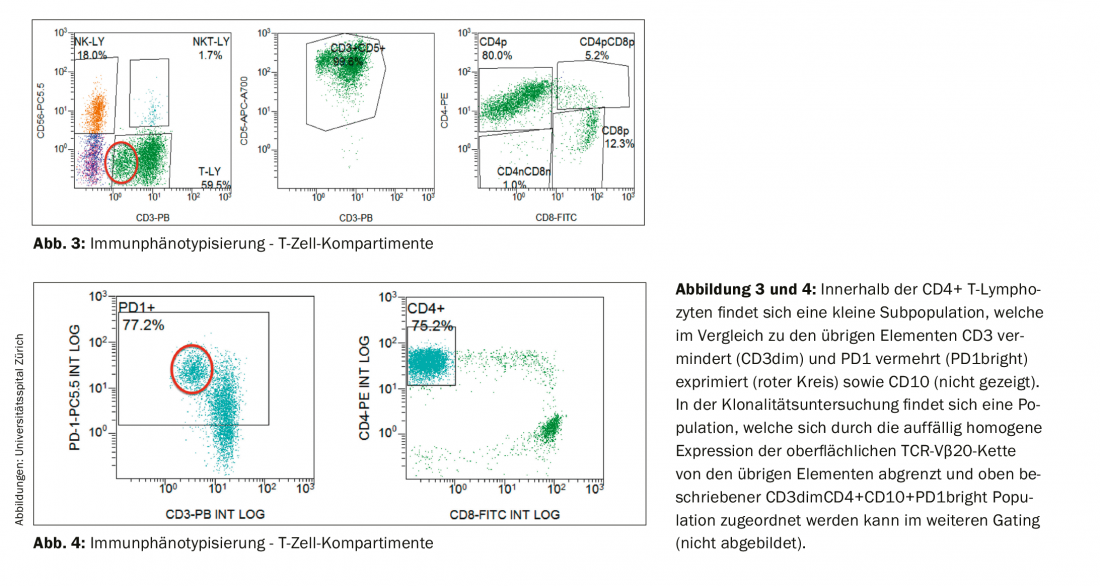
El examen inmunofenotípico de los linfocitos permaneció sin evidencias de una población clonal de células B. Por el contrario, el compartimento de células T mostró un cambio en la relación CD4:CD8 a favor de los linfocitos T CD4 positivos (en el presente estudio 6,5:1; rango de referencia en sangre periférica: relación CD4:CD8 2:1), así como una pequeña población con expresión reducida de CD3 (CD3dim). (Fig.3). En la investigación de seguimiento, se pudo asignar un inmunofenotipo CD4+CD3dimPD-1+CD10+ a esta población conspicua (Fig. 4) y resultó ser clonal a la cadena TCR-Vβ20 mediante análisis del TCR. Así pues, el hallazgo era coherente con un linfoma no hodgkiniano de células T periféricas (LNHT) del tipo linfoma angioinmunoblástico de células T (LTIA).
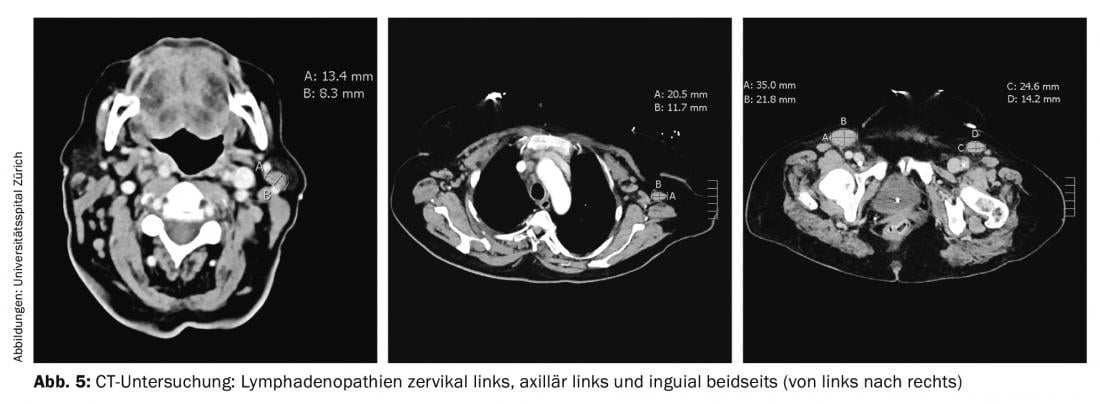
Debido a la disnea persistente, se volvió a realizar una tomografía computarizada. El examen no reveló ninguna embolia pulmonar, pero había varias linfadenopatías, la mayor de las cuales estaba en la región inguinal izquierda (35×22 mm) (Fig. 5). Consecutivamente, se realizó una escisión del ganglio linfático axilar derecho, donde se confirmó el diagnóstico de linfoma angioinmunoblástico de células T (LTA). El examen de la médula ósea mostró una afectación medular por AITL con una infiltración del 10-15% y una proliferación de células plasmáticas policlonales medulares del 20%.
Así pues, se realizó el diagnóstico de linfoma angioinmunoblástico de células T (LTA) en estadio IV de Ann-Arbor con plasmocitosis reactiva. (Fig. 6). Inicialmente, se administró una terapia citorreductora con altas dosis de corticosteroides, lo que condujo a una rápida mejoría del estado clínico y a una clara regresión de la hiperglobulinemia G/M/A a corto plazo. (Tab. 3). Tras confirmar el diagnóstico, se inició una terapia dirigida a AITL con CHOP.
Definición
La plasmacitosis se define como la proliferación de células plasmáticas en la sangre periférica y puede ser de origen neoplásico en el sentido de una enfermedad clonal de células plasmáticas, pero también puede ser de causa reactiva [12]. La plasmocitosis reactiva fue descrita por primera vez en 1988 por Peterson et al. descrito como “Proliferaciones inmunoblásticas policlonales sistémicas” en cuatro pacientes con proliferación policlonal de células plasmáticas en la sangre periférica [1,2].
En la literatura, el término plasmocitosis a veces también se equipara a la proliferación de células plasmáticas en general y se especifica el compartimento afectado (sangre periférica, médula ósea, otros tejidos).
Epidemiología y etiología
La plasmocitosis reactiva es un fenómeno raro con pocos casos registrados, mientras que la proliferación de células plasmáticas reactivas en la médula ósea es relativamente común [13,14]. Batdorf et al. encontraron proliferación de células plasmáticas (definida como >2,0% de contenido de células plasmáticas) en el 8,8% (303/3435) en su análisis de 3435 exámenes de médula ósea. En un estudio más pequeño realizado por Gupta et al. Se procesaron 830 exámenes de médula ósea y se registró proliferación de células plasmáticas (definida como >contenido de células plasmáticas del 3,5%) hasta en un 13,7% (114/830) de los casos. En ambos estudios, la proliferación de células plasmáticas se debió al mieloma de células plasmáticas en menos del 10% de los casos [3,4].
Se han observado causas no malignas como la anemia por deficiencia de sustrato, la anemia hemolítica, infecciones (especialmente el VIH), enfermedades autoinmunes y enfermedades hepáticas (especialmente en la cirrosis hepática), pero también procesos malignos como enfermedades asociadas a la proliferación de células plasmáticas reactivas. Este último en el 15,7% al 55,4% de los casos, la mayoría de los cuales eran tumores hematológicos [3,4]. El grado de proliferación de células plasmáticas se situó entre el 5 y el 24% para la etiología no neoplásica, menos del 10% para la anemia y entre el 10 y el 30% para la infección y la médula ósea hipoplásica [3]. La proliferación de células plasmáticas reactivas también puede ser inducida por fármacos. Por ejemplo, un estudio de Zamarin et al. demostró que en el 20% de los pacientes con mieloma de células plasmáticas, la exposición prolongada a la lenalidomida (>6 meses), se produce una hiperglobulinemia policlonal y una proliferación de células plasmáticas medulares del 5-20% (mediana del 12%) [15]. Este fenómeno se asocia a una supervivencia libre de progresión prolongada, pero el mecanismo no está claro.
Sólo existen informes de casos de plasmocitosis reactivas, pero no por ello el espectro de enfermedades subyacentes es comparable: hay informes de plasmocitosis en el contexto de infecciones víricas (hepatitis A aguda, virus de Ebstein-Barr, parvovirus B19, dengue, virus SFTS) pero también bacterianas (S. aureus, K. pneumoniae) [5,7,10,16–20]. Se describió un caso en un paciente con síndrome de Sjögren [8]. Además, existen varios casos de plasmocitosis pronunciada en relación con linfomas angioinmunoblásticos de células T y en un caso incluso se ha postulado una conexión con un mieloma de células plasmáticas coexistente [6,9,13,21,22]. Aunque en los casos comunicados había una plasmocitosis pronunciada en cada caso, las plasmocitosis reactivas son probablemente en su mayoría leves; por ejemplo, en una serie de casos de Jego et al. Sólo 2 de cada 10 pacientes presentaban exudado de células plasmáticas >20% en [23].
Fisiopatología
En las proliferaciones de células plasmáticas reactivas, existe una mezcla de precursores de células plasmáticas (plasmablastos) y precursores (células plasmáticas tempranas), todos ellos con una expresión homogénea de CD45bright, mientras que en la médula ósea normal y en el mieloma de células plasmáticas existe una expresión heterogénea de CD45 [24]. Se desconoce el mecanismo exacto que conduce a la proliferación, pero parece probable que el aumento de la liberación de citocinas sea una causa, especialmente porque la IL-2 y la IL-10 son fuertes estímulos para la formación de plasmoblastos y células plasmáticas tempranas [25]. La IL-6 potencia este efecto y es esencial para la supervivencia de las células plasmáticas [25,26].
El linfoma angioinmunoblástico de células T se caracteriza histológicamente por un infiltrado inflamatorio polimorfo y se asocia con mayor frecuencia a niveles séricos elevados de citocinas (incluida la IL-6, así como la IL-10) en comparación con otros linfomas periféricos de células T. Esta observación sugiere que en estos casos la proliferación de células plasmáticas reactivas asociada está mediada por citocinas. Existen casos individuales descritos en la literatura en los que también se encontró una proliferación de células plasmáticas monoclonales [13,27,28].
Mensajes para llevarse a casa
- Las plasmocitosis reactivas son raras pero pueden ser pronunciadas (lavado de células plasmáticas >20%).
- En el caso de la plasmocitosis, la diferenciación entre la proliferación de células plasmáticas reactivas (policlonales) y monoclonales es posible de forma rápida y fiable mediante la inmunofenotipificación por citometría de flujo a partir de sangre periférica.
- Los principales diagnósticos diferenciales son las infecciones, las neoplasias malignas (especialmente los tumores hematológicos) y las enfermedades autoinmunes.
- El patomecanismo exacto no está claro; el aumento de la liberación de citoquinas (IL-2, IL-6, IL-10) como causa es posible.
Literatura:
- Peterson LC, Kueck B Fau-Arthur DC, Arthur Dc Fau-Dedeker K, et al: Proliferaciones inmunoblásticas policlonales sistémicas.
- Li L, et al: Proliferación policlonal de células plasmáticas con hipergammaglobulinemia marcada y autoanticuerpos múltiples. Ann Clin Lab Sci 36, 479-484 (2006).
- Gupta M, et al: Perfil etiológico de la plasmacitosis en aspirados de médula ósea. Revista médica Dicle 43, 4, doi:10.5798/diclemedj.0921.2016.01.0628 (2016).
- Batdorf B, Kroft S, Olteanu H, Harrington A: Plasmacitosis reactiva de la médula ósea: una actualización para la era moderna. American Journal of Clinical Pathology 142, A102-A102, doi:10.1093/ajcp/142.suppl1.102 %J American Journal of Clinical Pathology (2014).
- Shtalrid M, Shvidel L, Vorst E: Plasmacitosis reactiva policlonal de sangre periférica que imita una leucemia de células plasmáticas en un paciente con sepsis estafilocócica. Leukemia & lymphoma 44, 379-380, doi:10.1080/1042819021000029713 (2003).
- Ahsanuddin AN, Brynes RK, Li S: Plasmacitosis policlonal en sangre periférica que imita la leucemia de células plasmáticas en pacientes con linfoma angioinmunoblástico de células T: informe de 3 casos y revisión de la literatura. Int J Clin Exp Pathol 4, 416-420 (2011).
- Desborough MJ, Grech H: Aplasia de médula ósea y plasmocitosis provocadas por el virus de Epstein-Barr que imitan una neoplasia de células plasmáticas. Br J Haematol 165, 272, doi:10.1111/bjh.12721 (2014).
- Lee J, Chang Je Fau-Cho YJ, Cho Yj Fau-Han, et al: caso de plasmocitosis reactiva que imita un mieloma múltiple en un paciente con síndrome de Sjogren primario.
- Sokol K, et al: Plasmacitosis extrema en sangre periférica que imita la leucemia de células plasmáticas como característica de presentación del linfoma angioinmunoblástico de células T (AITL). Front Oncol 9, 509, doi:10.3389/fonc.2019.00509 (2019).
- Zhang J, et al: Plasmacitosis reactiva que simula un mieloma múltiple asociada a una infección por el virus SFTS: informe de dos casos y revisión de la literatura. BMC Infect Dis 18, 528, doi:10.1186/s12879-018-3431-z (2018).
- SH S, et al: Clasificación de la OMS de los tumores de los tejidos hematopoyéticos y linfoides. IARC Press, Lyon Clasificación de tumores de la OMS, 4ª edición revisada, volumen 2 (2017).
- J., B. B., Karl-Anton K: Das Blutbild – Diagnostische Methoden und klinische Interpretation. De Gruyter (2017).
- Xu J. et al: Linfoma angioinmunoblástico de células T con mieloma de células plasmáticas coexistente: informe de un caso y revisión de la literatura. Tohoku J Exp Med 235, 283-288, doi:10.1620/tjem.235.283 (2015).
- Pellat-Deceunynck C, et al.: Plasmocitosis reactiva, un modelo para estudiar la biología de los progenitores y precursores de células plasmáticas humanas. The hematology journal: the official journal of the European Haematology Association / EHA 1, 362-366, doi:10.1038/sj/thj/6200053 (2000).
- Zamarin D, et al.: Activación inmunitaria policlonal y plasmocitosis de la médula en pacientes con mieloma múltiple que reciben tratamiento a largo plazo con lenalidomida: incidencia e importancia pronóstica. Leucemia 27, 2422-2424, doi:10.1038/leu.2013.126 (2013).
- Wada T, et al: Plasmacitosis reactiva de sangre periférica en un paciente con hepatitis A aguda.
- Koduri PR, Naides SJ: Plasmocitosis sanguínea transitoria en la infección por parvovirus B19: informe de dos casos. Ann Hematol 72, 49-51, doi:10.1007/bf00663017 (1996).
- Thai KT, et al: Alta incidencia de plasmocitosis en sangre periférica en pacientes con infección por el virus del dengue. Clin Microbiol Infect 17, 1823-1828, doi:10.1111/j.1469-0691.2010.03434.x (2011).
- Wada T, Iwata Y, Kamikawa Y, et al: Plasmacitosis en sangre periférica en el síndrome de fiebre grave con trombocitopenia. Jpn J Infect Dis 70, 470-471, doi:10.7883/yoken.JJID.2016.575 (2017).
- Moon Y, et al: Plasmacitosis extrema asociada a Klebsiella pneumoniae. Infect Chemother 45, 435-440, doi:10.3947/ic.2013.45.4.435 (2013).
- Sakai H, et al: Linfoma angioinmunoblástico de células T que se presenta inicialmente con sustitución de la médula ósea y plasmocitosis periférica. Intern Med 46, 419-424, doi:10.2169/internalmedicine.46.6121 (2007).
- Yamane A, Awaya N, Shimizu T, et al: Linfoma angioinmunoblástico de células T con proliferación policlonal de células plasmáticas en sangre periférica y médula. Acta Haematol 117, 74-77, doi:10.1159/000096894 (2007).
- Jego G, et al.: Las plasmocitosis reactivas son expansiones de plasmoblastos que conservan la capacidad de diferenciarse en células plasmáticas.
- Pellat-Deceunynck C, Bataille R: Células plasmáticas humanas normales y malignas: proliferación, diferenciación y expansiones en relación con la expresión de CD45. Blood Cells Mol Dis 32, 293-301, doi:10.1016/j.bcmd.2003.12.001 (2004).
- Jego G, Bataille R, Pellat-Deceunynck C: La interleucina-6 es un factor de crecimiento para los plasmoblastos humanos no malignos. Blood 97, 1817-1822, doi:10.1182/blood.v97.6.1817 (2001).
- Jourdan M, et al.: La IL-6 favorece la generación de células plasmáticas humanas de larga vida en combinación con factores APRIL o solubles en células estromales. Leucemia 28, 1647-1656, doi:10.1038/leu.2014.61 (2014).
- Dogan A, Attygalle AD, Kyriakou C: Linfoma angioinmunoblástico de células T. Br J Haematol 121, 681-691, doi:10.1046/j.1365-2141.2003.04335.x (2003).
- Yi JH, Ryu KJ, Ko YH, et al: Perfiles de citocinas séricas y sus implicaciones clínicas en pacientes con linfoma periférico de células T. Citocina 113, 371-379, doi:10.1016/j.cyto.2018.10.009 (2019).
InFo ONCOLOGÍA Y HEMATOLOGÍA 2020; 8(1): 4-8