La radioquimioterapia combinada con citotóxicos clásicos e inhibidores específicos de estructuras moleculares diana aumenta la amplitud terapéutica y forma parte de la rutina clínica en muchas entidades tumorales. Los citotóxicos clásicos aumentan cuantitativa y cualitativamente el daño al ADN en combinación con la radiación ionizante; los inhibidores específicos de dianas moleculares aumentan la eficacia del daño al ADN fijado por la radiación. Tanto las cascadas de transducción de señales específicas de las células tumorales como el medio tumoral (hipoxia, sistema inmunitario) son objetivos interesantes para el tratamiento combinado moderno.
La radioterapia clínica ha pasado en los últimos 100 años de ser una aplicación experimental de los rayos X a una modalidad terapéutica compleja, tecnológicamente muy sofisticada y de amplia aplicación. Probablemente, los avances tecnológicos más importantes que configuraron el desarrollo de la radioterapia fueron la introducción de la TC y la IRM, que permiten una localización tridimensional precisa del tumor, y el perfeccionamiento de la tecnología de los aceleradores lineales, que hoy en día permiten una irradiación precisa del tumor real con una reducción simultánea del volumen de irradiación y, por tanto, la preservación del tejido sano. Este desarrollo ha dado lugar a la tecnología IMRT (Radioterapia de Intensidad Modulada) y SBRT (Radioterapia Estereotáctica Corporal) utilizada en la radioterapia clínica actual. Sin embargo, a pesar de estos avances técnicos, en el futuro difícilmente será posible un aumento ilimitado de la dosis sin que se produzcan nuevas toxicidades importantes en los tejidos normales [1].
Radioquimioterapia combinada
Paralelamente a estos logros tecnológicos, se han realizado enormes avances en el campo de la comprensión biológica de los efectos de la radiación, que hoy en día se manifiestan en la clínica en el campo de la radioquimioterapia combinada. Mientras que la combinación con quimioterápicos clásicos tiene como objetivo aumentar el daño del ADN en la célula cancerosa, las clases de sustancias modernas están diseñadas para aumentar la eficacia del daño del ADN inducido por la radiación y el programa de estrés en la célula tumoral y el medio tumoral, lo que en última instancia conduce a la muerte del tumor.
Hoy en día, comprendemos el efecto de la radiación en diferentes entidades tumorales no sólo a nivel del daño en el ADN, sino que reconocemos que la diferente sensibilidad a la radiación en el tumor y en el tejido normal se debe a una compleja red de cascadas de transducción de señales intra e intercelulares. Estos hallazgos han conducido al desarrollo de nuevas estrategias para superar la resistencia a la radiación, tanto intrínseca como adquirida, como parte de la radioquimioterapia combinada con radiosensibilizadores. Estas estrategias incluyen tanto sustancias de moléculas pequeñas que inhiben específicamente las cascadas de señalización impulsadas por oncogenes como modernos moduladores de los puntos de control inmunitarios con el objetivo de aumentar la amplitud terapéutica en el contexto de la radioquimioterapia combinada [2,3].
En la actualidad, más del 50% de todos los pacientes con un tumor sólido son tratados con radioterapia sola o como parte de una terapia combinada con cirugía y/o quimioterapia. En la actualidad, el 40% de todos los pacientes de cáncer en los que se puede conseguir una cura reciben también radioterapia como parte de una terapia combinada.
Aunque el carcinoma (avanzado) de células escamosas de cabeza y cuello (HNSCC) afecta sólo a una pequeña proporción de todos los pacientes con cáncer, el desarrollo de la radioquimioterapia combinada puede ilustrarse muy bien con esta entidad tumoral. A nivel de investigación preclínica, en los últimos 20 años se han probado innumerables combinaciones de radioterapia con inhibidores de moléculas pequeñas de diversas estructuras diana. Sin embargo, hasta ahora sólo unas pocas estrategias se han aplicado con éxito en la clínica.
Hipoxia tumoral
La hipoxia, debida principalmente a la vascularización desestructurada del tumor, es uno de los principales mecanismos de resistencia a la radiación en el HNSCC. Un metaanálisis basado en pruebas de nivel 1a de 2011 muestra claramente que diversas estrategias de modificación de la hipoxia (administración de oxígeno hiperbárico, respiración carbógena en combinación con nicotinamida y radiosensibilizadores, etc.) conducen a una mejora de la supervivencia libre de progresión y de la supervivencia global en el HNSCC [4]. Por ello, resulta aún más sorprendente que estas estrategias de modificación de la hipoxia no se hayan convertido todavía en parte de la rutina clínica, excepto en Dinamarca, donde se utiliza el nimorazol.
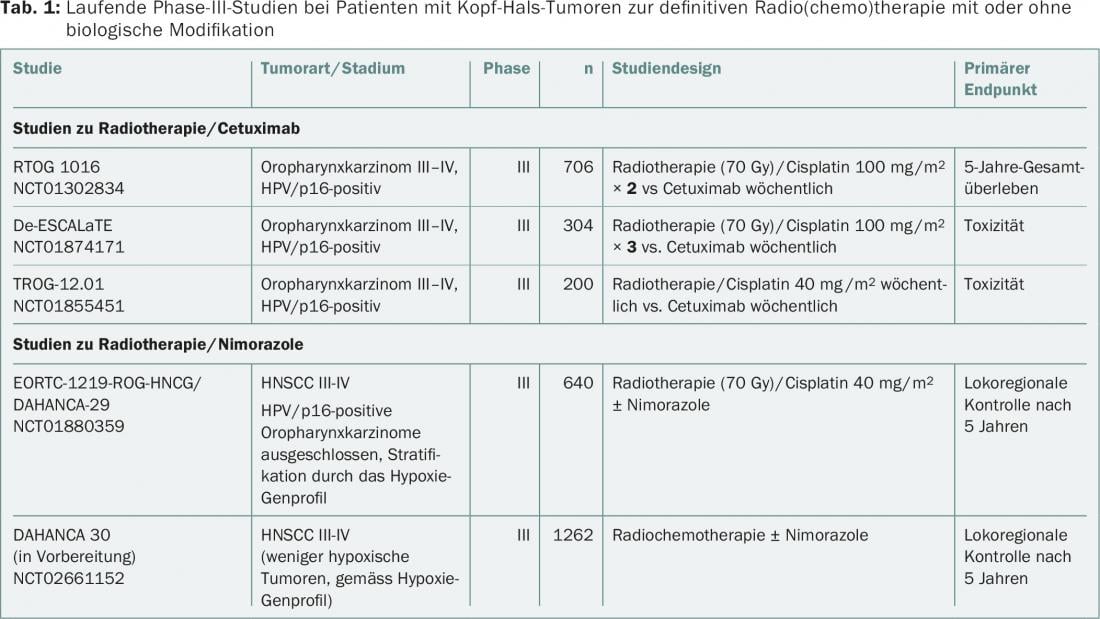
El nimorazol pertenece a la clase de los llamados miméticos del oxígeno (misonidazol, etanidazol, pimonidazol), que se han probado clínicamente durante décadas como prototipos de radiosensibilizadores de la hipoxia. Sin embargo, la mayoría de estos derivados del nitroimidazol provocan una neurotoxicidad grave a dosis elevadas y, por lo tanto, sólo se utilizan clínicamente como marcadores de hipoxia tumoral diagnóstica. Sin embargo, el nimorazol parece estar abriéndose camino en la rutina clínica, en parte debido a la experiencia adquirida en los ensayos clínicos con los llamados “profármacos de la hipoxia” (tirapazaminas, evofosfamida) [5,6]. Estos estudios demuestran que debe llevarse a cabo una caracterización del estado de hipoxia y una estratificación adecuada cuando se administra radioquimioterapia combinada con radiosensibilizadores de hipoxia. En general, se están realizando grandes esfuerzos para determinar tanto el estado de hipoxia antes del inicio del tratamiento como la dinámica de la hipoxia tumoral bajo radioterapia de forma predictiva mediante PET de hipoxia (por ejemplo, con misonidazol marcado con F18). Al mismo tiempo, también se identificó una denominada firma de expresión de 15 genes para la clasificación de la hipoxia. Esta firma caracteriza los tumores como más o menos hipóxicos y complementará la determinación directa convencional de la presión parcial de oxígeno en el tumor en lo que respecta a la caracterización de la hipoxia. Por ejemplo, un ensayo multicéntrico prospectivo de fase III de la EORTC (EORTC-1219) está investigando actualmente el efecto del nimorazol en combinación con radioquimioterapia basada en cisplatino en el HNSCC localmente avanzado y VPH/p16 negativo. También se determinará si esta firma de 15 genes es adecuada como clasificador predictivo. Se está preparando otro gran ensayo de fase III con nimorazol (DAHANCA30).
El receptor del EGF como diana terapéutica
Diversos estudios aleatorizados y la rutina clínica han demostrado durante más de 15 años que la administración simultánea de cisplatino en combinación con radioterapia aumenta tanto el tiempo libre de progresión como la supervivencia global en comparación con la radioterapia sola. Mecanísticamente, este efecto se basa predominantemente en la modificación combinada del ADN por el cisplatino y los radicales reactivos del oxígeno generados por la radiación, que juntos provocan daños complejos en el ADN. Sin embargo, esta combinación también provoca graves efectos secundarios agudos y crónicos [7]. Esto estimuló una intensa investigación sobre terapias alternativas, que condujo a la combinación de radioterapia con el anticuerpo monoclonal específico del EGFR cetuximab (Erbitux®).
La sobreexpresión del EGFR (receptor del factor de crecimiento epidérmico) es un factor pronóstico fuerte e independiente en el HNSCC. El cetuximab se une con gran afinidad a su dominio extracelular, bloqueando así la unión de los ligandos activadores del receptor. El cetuximab en combinación con radioterapia se probó clínicamente en el conocido estudio de Bonn en comparación con la radioterapia sola y se caracterizó por una mejora de la supervivencia libre de progresión y de la supervivencia global (49 frente a 29 meses), así como por una gran reducción de las toxicidades del tejido normal [8].
Hasta la fecha no se ha documentado una comparación directa de las dos formas de combinación (cisplatino/radioterapia frente a cetuximab/radioterapia). En cuanto a la desescalada del tratamiento, tres ensayos aleatorizados de fase III investigan actualmente el valor de la radioterapia/cetuximab frente a la radioterapia/cisplatino en el carcinoma orofaríngeo VPH/p16 positivo (RTOG 1016, De-ESCALaTE, TROG-12.01) (tab. 1) . En parte debido al abrumador número de ensayos de cisplatino/radioterapia -en comparación con los ensayos de combinación de cetuximab/radioterapia-, el cisplatino sigue siendo el tratamiento estándar en combinación con la radioterapia. En la actualidad, el cetuximab/radioterapia se utiliza principalmente en pacientes con HNSCC en situaciones de alto riesgo, por ejemplo, intolerancia al cisplatino o mal estado general. Curiosamente, la triple combinación de cetuximab/cisplatino/radioterapia no mejoró la supervivencia libre de progresión ni la supervivencia global en un ensayo aleatorizado [9].
Aunque varios aspectos del estudio de Bonn han sido criticados en el pasado, representa un hito en el desarrollo de la radioquimioterapia combinada. A nivel preclínico y clínico, se pudo demostrar por primera vez que la inhibición de una estructura diana estrictamente definida a nivel molecular (EGFR) en la célula tumoral conduce a la radiosensibilización. La investigación sobre los mecanismos de acción de esta forma de combinación también demostró que se superan los mecanismos clásicos de resistencia a la radioterapia clínicamente relevantes (repoblación del tumor, capacidad de reparación intrínseca, umbral de apoptosis elevado). Curiosamente, el cetuximab puede incluso controlar procesos inmunomoduladores que también influyen en la respuesta global.
Inmunoterapia
En la actualidad, la investigación preclínica y clínica intensiva se centra en los procesos inmunológicos relevantes desde el punto de vista radioterapéutico. La radioterapia se ha caracterizado durante mucho tiempo por ser inmunosupresora, ya que las células hematopoyéticas son especialmente radiosensibles. No obstante, se ha demostrado que la irradiación del tumor también tiene un efecto inmunoestimulante.
La radiación ionizante provoca la activación de las células asesinas naturales, la infiltración de células T CD8 positivas, el aumento de la presentación de antígenos en las células dendríticas y la producción de citocinas inmunoestimuladoras en el tumor. Sin embargo, nuestra comprensión de estos procesos inducidos por la radiación es sólo rudimentaria [10]. Por ejemplo, observamos patrones de reacción completamente diferentes tras la irradiación fraccionada con dosis bajas y la irradiación con dosis únicas elevadas, lo que a su vez hace muy atractiva la investigación radiobiológica y traslacional.
La atención se centra en la investigación de la muerte celular inmunogénica inducida por la radiación o la activación del llamado efecto abscopal por la radioterapia. Se refiere a un efecto sistémico de la irradiación sobre el tejido tumoral en lugares no irradiados, que está mediado por procesos inmunológicos. Existe un gran interés por potenciar el efecto abscopal, clínicamente poco frecuente, en el contexto de la radioquimioterapia combinada con inmunomoduladores. También existen protocolos correspondientes de radioquimioterapia combinada con inhibidores de puntos de control inmunitarios para el HNSCC. Sin embargo, aún existen muchos interrogantes y no se han completado ensayos clínicos concluyentes en este prometedor campo de aplicación.
En el sitio web del NCI (https://clinicaltrials.gov) están registrados actualmente varios ensayos de fase I/II en pacientes con HNSCC para radioquimioterapia en combinación con inmunoterapia y se están preparando ensayos aleatorizados de fase III.
Conclusión
La radioterapia moderna es una forma de terapia contra el cáncer de alta tecnología en la que cada paciente recibe un plan terapéutico individual basado en los parámetros clínicos (incl. entidad del tumor, volumen, localización). Los agentes quimioterapéuticos clásicos aumentan la eficacia de la radioterapia. En el contexto de la “medicina personalizada”, la amplitud terapéutica de esta forma individualizada de terapia puede mejorarse aún más con sustancias específicas definidas molecularmente. El objetivo es superar el perfil de radioresistencia, que se basa en el fondo genético individual del tumor.
Literatura:
- Baumann M, et al: La oncología radioterápica en la era de la medicina de precisión. Nat Rev Cancer 2016; 16(4): 234-249.
- Begg AC, et al: Estrategias para mejorar la radioterapia con fármacos dirigidos. Nat Rev Cancer 2011; 11(4): 239-253.
- Morris ZS, et al: Interacción de la radioterapia con agentes moleculares dirigidos. J Clin Oncol 2014; 32(26): 2886-2893.
- Overgaard J: Modificación hipóxica de la radioterapia en el carcinoma de células escamosas de cabeza y cuello – una revisión sistemática y metaanálisis. Radiother Oncol 2011; 100(1): 22-32.
- Ahn GO, et al: Targeting tumours with hypoxia-activated cytotoxins. Front Biosci 2007; 12: 3483-3501.
- Brown JM, et al: Aprovechamiento de la hipoxia tumoral en el tratamiento del cáncer. Nat Rev Cancer 2004; 4(6): 437-447.
- Pignon JP, et al.: Metaanálisis de la quimioterapia en el cáncer de cabeza y cuello (MACH-NC): una actualización de 93 ensayos aleatorizados y 17.346 pacientes. Radiother Oncol 2009; 92(1): 4-14.
- Bonner JA, et al: Radioterapia más cetuximab para el cáncer de cabeza y cuello locorregionalmente avanzado: datos de supervivencia a 5 años de un ensayo aleatorizado de fase 3 y relación entre la erupción inducida por el cetuximab y la supervivencia. Lancet Oncol 2010; 11(1): 21-28.
- Ang KK, et al: Ensayo aleatorizado de fase III de radiación acelerada concurrente más cisplatino con o sin cetuximab para el carcinoma de cabeza y cuello en estadio III a IV: RTOG 0522. J Clin Oncol 2014; 32(27): 2940-2950.
- Salama AK, et al: Irradiación e inmunoterapia: del concepto a la clínica. Cáncer 2016; 122(11): 1659-1671.
InFo ONcOLOGíA & HEMATOLOGíA 2016; 4(7-8): 12-15.











