Estudios como CESAR o SHOCK II, pero también el desarrollo ulterior de bombas, oxigenadores y tubos de perfusión han contribuido a que la terapia con ECMO y ECLS haya cobrado mucha más importancia. Estos procedimientos suponen un reto para el equipo interdisciplinar de tratamiento.
ECMO significa “oxigenación extracorpórea por membrana” y se refiere a una bomba centrífuga extracorpórea con un oxigenador que se conecta a la circulación del paciente a través de un sistema de tubos. Se hace una distinción entre la OMEC veno-venosa, que se utiliza en la insuficiencia respiratoria aguda, y la OMEC veno-arterial, que se utiliza en pacientes en shock cardiogénico agudo. Recientemente, la nomenclatura se ha concretado en la denominación ECMO para la configuración veno-venosa (vv) y ECLS (“Extracorporeal Life Support”) para la configuración veno-arterial (va).
La terapia con ECMO/ECLS ha ganado importancia rápidamente en los últimos años. Esto se debió inicialmente a los resultados publicados en el estudio CESAR, que demostraron que los pacientes con síndrome de dificultad respiratoria aguda (SDRA) tratados con ECMO veno-venosa tenían una ventaja en términos de supervivencia y calidad de vida en comparación con los pacientes que recibieron únicamente terapia de ventilación dirigida al SDRA [1]. La implantación del vaECLS en el shock cardiogénico también ha experimentado un auge extraordinario. Por un lado, esto se debió a los avances técnicos en bombas, oxigenadores y tubos de perfusión. Por otro lado, el ensayo SHOCK II, que no logró demostrar un beneficio en la supervivencia en el shock cardiogénico con el uso del balón de contrapulsación intraaórtico (BCIA) [2], allanó el camino para el uso del vaECLS.
El tratamiento de los pacientes sometidos a vvECMO o vaECLS es especialmente difícil. La implantación del sistema y el tratamiento posterior del paciente requieren un equipo interdisciplinar y multiprofesional, que incluya intensivistas, cirujanos cardiacos, cardiólogos y neumólogos, así como perfusionistas y enfermeras de cuidados intensivos.
Canulación y configuración de vvECMO y vaECLS
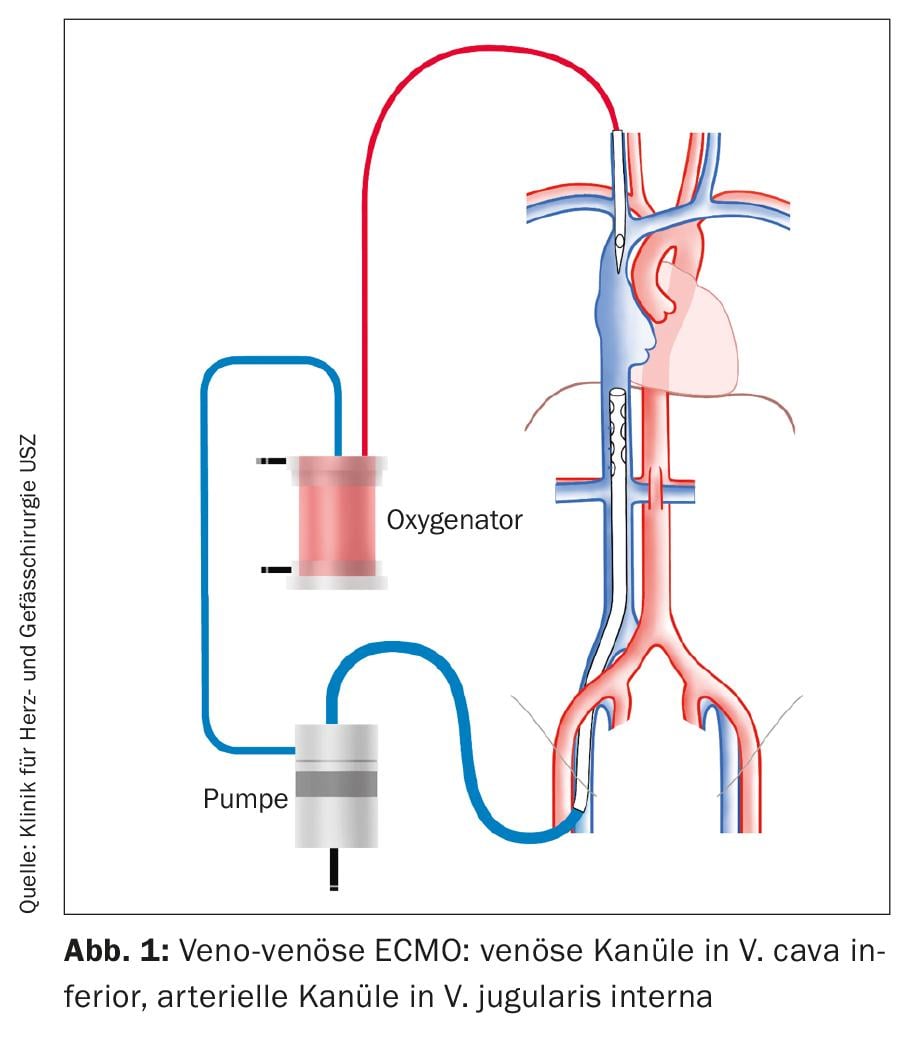
Como procedimiento para la insuficiencia respiratoria aguda, la ECMO se implanta en una configuración veno-venosa (Fig. 1). Para el drenaje venoso, se inserta una cánula en la vena femoral común (VFC). La punta de la cánula se coloca bajo control ecocardiográfico de modo que quede a la entrada de la vena cava inferior (VCI) en la aurícula derecha. Se introduce una cánula en la vena yugular interna (VYI) para suministrar la sangre oxigenada. La punta de la cánula se sitúa en la vena cava superior (VCS).
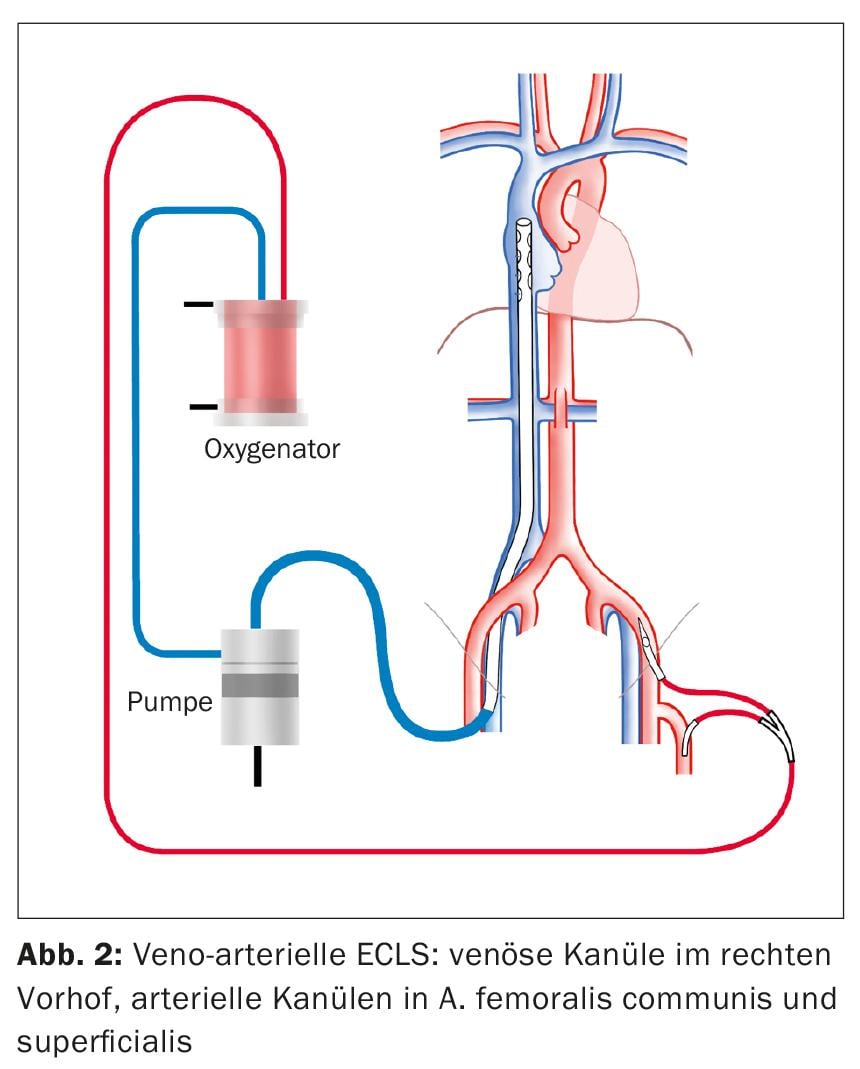
El ECLS como procedimiento para el shock cardiogénico se implanta en una configuración veno-arterial (Fig. 2 ). De forma similar a la vvECMO, se inserta una cánula en la VFC derecha para el drenaje venoso. También bajo control ecocardiográfico, la punta de la cánula se coloca de modo que se sitúe 1-2 cm en la vena cava superior para lograr un drenaje óptimo de la mitad superior e inferior del cuerpo. El acceso estándar para el suministro arterial es el A. femoralis communis (AFC). La cánula se inserta proximalmente en la arteria ilíaca externa. Además, se coloca una pierna de perfusión distal en la arteria femoral superficial para evitar la isquemia de la pierna.
Principalmente, todas las cánulas se implantan por vía percutánea. Antes de la inserción de la cánula AFC, se coloca un sistema de oclusión vascular percutánea para lograr la oclusión del orificio de punción durante la posterior extracción percutánea de la cánula. Si la punción percutánea de la AFC no tiene éxito, la cánula debe implantarse abiertamente de forma quirúrgica. Este procedimiento puede ser necesario cuando se implante en condiciones de reanimación. No se requiere ningún sistema de cierre vascular percutáneo para retirar las cánulas venosas de la VFC y la VJI. El orificio de punción puede cerrarse con una sutura.
Estrategias de tratamiento
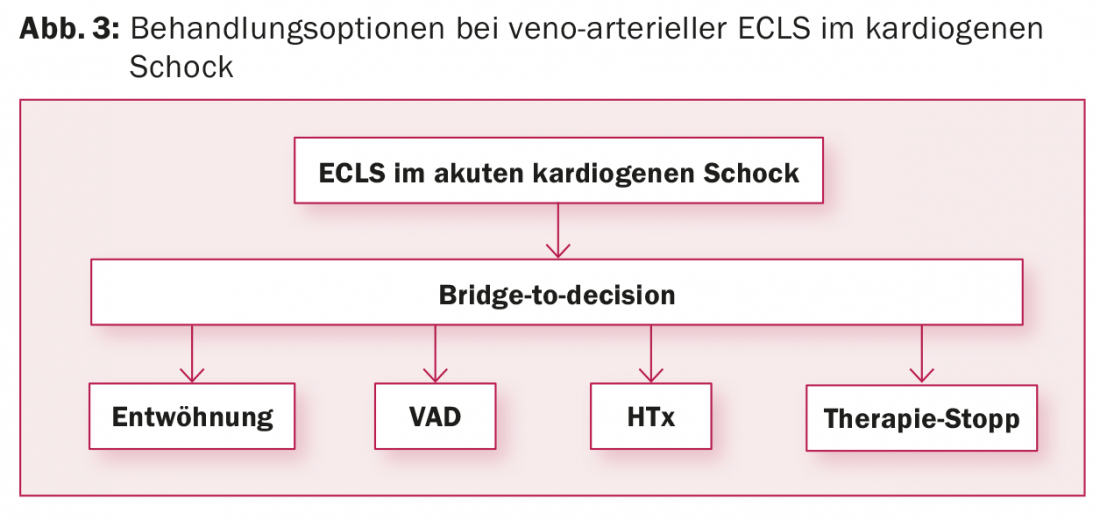
vaECLS: La implantación del vaECLS suele producirse en una situación de emergencia, lo que no da tiempo a evaluar la estrategia de tratamiento tras el vaECLS. Normalmente se desconocen las comorbilidades y el entorno psicosocial del paciente. Sin embargo, se trata de un requisito previo para determinar el concepto de tratamiento tras el vaECLS. Por ello, el vaECLS suele implantarse como “puente hacia la decisión” para ganar tiempo y determinar la situación del paciente. Además de aclarar las enfermedades concomitantes y la situación vital del paciente, es necesario evaluar la situación neurológica, sobre todo si el vaECLS se implantó en condiciones de reanimación. Para ello, además del TAC craneal y el EEG, debe realizarse una prueba de despertar en el ECMO para poder evaluar al paciente clínico-neurológicamente. Una vez finalizados los exámenes, puede elegir entre cuatro opciones de terapia posterior (Fig. 3):
- Destetar al paciente del vaECLS si la función cardiaca se recupera.
- Si la función cardiaca no se recupera: Cambiar al paciente del vaECLS a un dispositivo de asistencia cardiaca como “puente al trasplante” si el paciente es candidato a un trasplante de corazón, o como “terapia de destino” si el paciente no es candidato a un trasplante de corazón.
- Trasplante de corazón, si el cambio a un sistema de asistencia cardiaca no parece razonable, no existen contraindicaciones para el trasplante de corazón y se dispone de un corazón donado adecuado en un plazo máximo de dos a tres semanas. Para ello, el paciente se inscribe urgentemente en la lista de espera. Si no se dispone de un corazón donado adecuado en este plazo, se implantará al paciente un dispositivo de asistencia ventricular, ya que de lo contrario aumentará la tasa de complicaciones en el vaECLS.
- Finalización del vaECLS con muerte consecutiva del paciente si la función cardiaca del paciente no se recupera y las contraindicaciones no permiten la implantación de un dispositivo de asistencia cardiaca o un trasplante de corazón.
Según las directrices actuales de 2016 de la Sociedad Europea de Cardiología para la insuficiencia cardiaca aguda y crónica [3], la implantación de un vaECLS puede considerarse en el shock cardiogénico refractario, teniendo en cuenta la edad del paciente, las comorbilidades y la función neurológica (recomendación IIb, nivel de evidencia C).
vvECMO: La implantación de la vvECMO suele ser urgente y rara vez de emergencia. Existen tres opciones de tratamiento tras la vvECMO:
- Destete de la vvECMO en caso de recuperación de la función pulmonar.
- Trasplante de pulmón si la función pulmonar no se recupera y no hay contraindicaciones.
- Finalización de la vvECMO con posterior fallecimiento del paciente si la función pulmonar no se recupera y el paciente no es candidato a un trasplante de pulmón.
Mortalidad y morbilidad
vaECLS: La tasa de supervivencia de los pacientes que han recibido vaECLS en shock cardiogénico hasta el alta hospitalaria es de aproximadamente el 40%. Este es el resultado de un análisis de 3846 pacientes del registro internacional de la Organización de Soporte Vital Extracorpóreo (ELSO) entre 2003 y 2013 [4]. Basándose en sus resultados, los autores desarrollaron una puntuación de riesgo, la denominada “puntuación SAVE”, que permite estimar la tasa de supervivencia de los pacientes en el vaECLS en función de los factores de riesgo presentes. Un metaanálisis de 1199 pacientes de 22 estudios observacionales de 2000 a 2014 confirma el análisis del registro ELSO con una tasa de supervivencia del 40% de los pacientes con vaECLS al alta hospitalaria [5]. La tasa de supervivencia parece baja al principio, en torno al 40%. Sin embargo, sin el vaECLS, el 0% habría sobrevivido. La baja tasa de supervivencia a pesar del restablecimiento de una circulación suficiente mediante el vaECLS se debe, al menos en parte, a los complejos procesos del shock cardiogénico con el desarrollo de una reacción inflamatoria sistémica y un síndrome multiorgánico disfuncional. Evidentemente, establecer una perfusión suficiente de los órganos únicamente mediante el vaECLS no siempre es suficiente para superar estos procesos.
Las tasas de supervivencia a largo plazo de los pacientes tras la implantación de un vaECLS son escasas en la literatura. En el metaanálisis mencionado anteriormente, la supervivencia a 3 años se cifra en un 42,7% [5]. Esto corresponde aproximadamente a la tasa de supervivencia hasta el alta hospitalaria. Esto significa que la mortalidad sólo es baja una vez que los pacientes han sido dados de alta del hospital.
Las complicaciones en la ECMO suelen tener una influencia desfavorable en la supervivencia del paciente. Más de la mitad de los pacientes desarrollan una o más complicaciones [5]. Pueden producirse complicaciones vasculares en el 10-20% de los pacientes [5,6]. Dependiendo del grado de obstrucción vascular por la cánula en el AFC, puede producirse una isquemia en la pierna. Para evitarlo, actualmente es una práctica estándar insertar una cánula de perfusión distal en el AFS en el momento de la implantación del vaECLS. Las complicaciones hemorrágicas se producen en el 26-41% de los pacientes [5,6]. Se ven favorecidos por el trastorno de la coagulación intravascular diseminada que suele presentarse en el shock cardiogénico, la producción insuficiente de factores de coagulación en la insuficiencia hepática, la trombocitopenia y el adelgazamiento de la sangre necesario en el vaECLS.
Las complicaciones neurológicas incluyen el ictus isquémico o hemorrágico en el 6-8% de los pacientes [5,6]. Son el resultado de un flujo sanguíneo cerebral insuficiente en el shock cardiogénico o durante la reanimación previa a la implantación del vaECLS. El complejo trastorno de la coagulación resultante del shock cardiogénico, que no siempre puede detectarse mediante la química de laboratorio, puede favorecer el desarrollo de estas complicaciones en el vaECLS. Las complicaciones infecciosas son frecuentes (25-49%) e incluyen infecciones locales en los puntos de canulación (17%) e infecciones sistémicas como la neumonía y la sepsis. Las normas de esterilidad que no siempre pueden cumplirse durante la implantación de emergencia de un vaECLS y el sistema inmunológico comprometido en el shock cardiogénico favorecen el desarrollo de infecciones [5–7]. La insuficiencia renal aguda es el resultado de la reducción de la perfusión en el shock cardiogénico y se produce en el 47-55% de los pacientes [5,6]. La sustitución renal es necesaria en el 40-46% de los pacientes [6,7]. También se han desarrollado puntuaciones de riesgo para la terapia vvECMO con el fin de estimar la probabilidad de supervivencia, como la puntuación PRESERVE o PRESET [9,10].
vvECMO: Más del 60% de los pacientes que reciben vvECMO para la insuficiencia pulmonar refractaria sobreviven hasta el alta hospitalaria, como muestra un metaanálisis de 1042 pacientes publicado recientemente [8]. La edad del paciente y el tamaño insuficiente de la cánula, con el consiguiente potencial de oxigenación insuficiente, son factores de riesgo.
Se producen complicaciones en el 40,2%. La hemorragia es la más frecuente, con un 29,3%. Las hemorragias intracerebrales se producen en el 5,4% de los casos. La hemorragia en los puntos de canulación venosa no desempeña un papel significativo, con un 10%, en contraste con el mayor riesgo de hemorragia en las cánulas arteriales en el vaECLS. Las infecciones locales en los puntos de canulación se desarrollan en algo menos del 10% de todos los pacientes. Pero sólo el 7% de las complicaciones conducen a la muerte.
Transporte de pacientes de ECMO
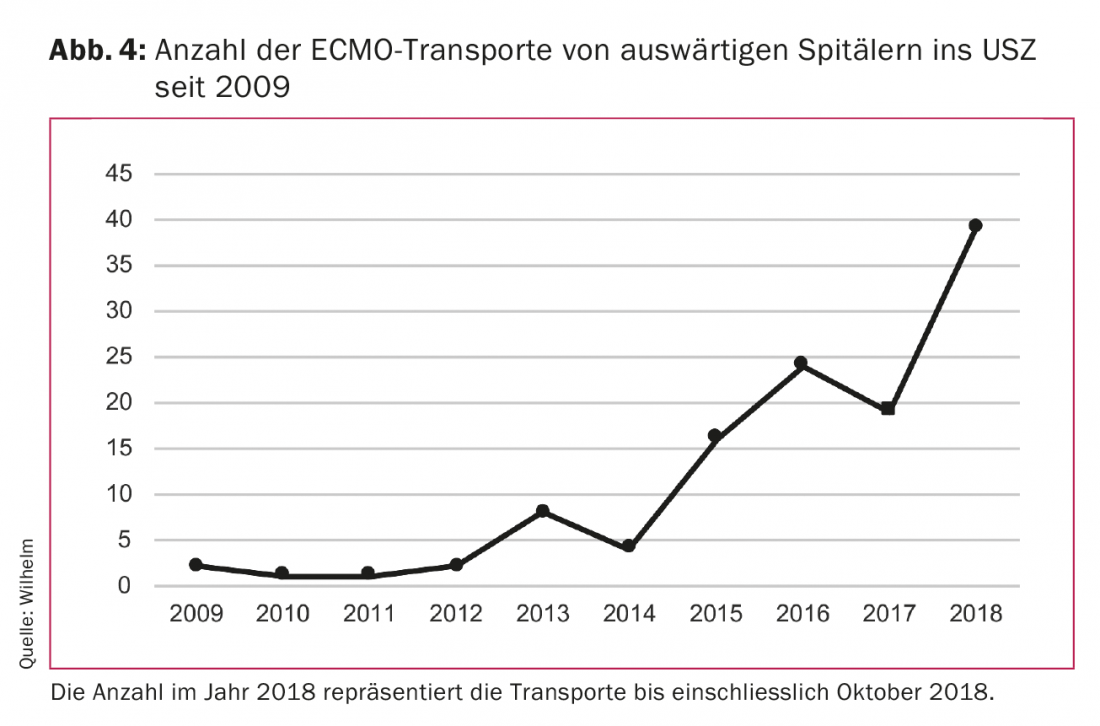
El desarrollo técnico de las bombas centrífugas y los oxigenadores ha permitido reducir considerablemente el tamaño de los sistemas. Gracias a ello, ahora pueden transportarse fácilmente en ambulancia o helicóptero. Esto ha hecho posible transportar pacientes de un hospital a otro en el vaECLS o el vvECMO. Esto ha dado lugar a un nuevo concepto de tratamiento. Los pacientes de hospitales de fuera de la ciudad con insuficiencia respiratoria aguda o en shock cardiogénico que no sean transportables debido a su estado crítico pueden ser tratados in situ con el vaECLS o el vvECMO y posteriormente transportados en este sistema al hospital del centro para recibir tratamiento adicional. Nuestro equipo de la Clínica de Cirugía Cardiovascular del Hospital Universitario de Zúrich (USZ) ha sido capaz de realizar estos transportes con éxito, de forma segura y sin problemas técnicos, tanto en tierra como en helicóptero. La necesidad de este tipo de tratamiento ha aumentado significativamente en los últimos años (Fig. 4). El equipo, formado por un cirujano cardiaco y un perfusionista, se traslada con el equipo al hospital de fuera de la ciudad, donde implantan el vaECLS o el vvECMO. A continuación, el paciente es transportado a la USZ del sistema. Nuestros resultados muestran que la tasa de supervivencia de estos pacientes es absolutamente comparable a la de los pacientes que reciben vaECLS o vvECMO en el hospital de nuestro centro.
El reto sigue siendo
El uso del vaECLS en el shock cardiogénico y del vvECMO en la insuficiencia respiratoria refractaria permite tratar a pacientes en estado crítico que habrían muerto antes de disponer de este tratamiento. Sin embargo, esta terapia aún no tiene el éxito que nos gustaría. Esto se debe a la complejidad de esta población de pacientes. En vista del esfuerzo humano, material y financiero que supone, el uso de vaECLS o vvECMO debe examinarse críticamente en cada caso concreto desde un punto de vista ético y socioeconómico. El uso de puntuaciones puede ser aquí una ayuda para la evaluación de riesgos. Los ensayos controlados aleatorios, que pueden proporcionar orientación en otras áreas de la medicina, aún no están disponibles en este campo y puede que nunca lo estén.
Mensajes para llevarse a casa
- La ECMO veno-venosa se utiliza en la insuficiencia respiratoria refractaria.
- El ECLS veno-arterial se implanta en el shock cardiogénico agudo.
- La ECMO veno-venosa y la ECLS veno-arterial sirven de “puente a la decisión”.
- La tasa de supervivencia al alta hospitalaria es del 40% para el vaECLS y del 60% para el vvECMO.
- Los pacientes pueden ser transportados de forma segura desde un hospital de fuera de la ciudad al hospital del centro en el vaECLS o en el vvECMO.
Literatura:
- Peek GJ, et al: Eficacia y evaluación económica de la asistencia ventilatoria convencional frente a la oxigenación por membrana extracorpórea para la insuficiencia respiratoria grave en adultos (CESAR): un ensayo controlado aleatorizado multicéntrico. Lancet 2009; 374(9698): 1351-1363.
- Thiele H, et al: Balón intraaórtico de contrapulsación en el infarto agudo de miocardio complicado con shock cardiogénico (IABP-SHOCK II): resultados finales a los 12 meses de un ensayo aleatorizado y abierto. Lancet 2013; 382(9905): 1638-1645.
- Ponikowski P, et al.: 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016; 37(27): 2129-2200.
- Schmidt M, et al: Predicción de la supervivencia tras ECMO para shock cardiogénico refractario: la puntuación de supervivencia tras ECMO venoarterial (SAVE). Eur Heart J 2015; 36(33): 2246-2256.
- Xie A, et al: Oxigenación por membrana extracorpórea venoarterial para el shock cardiogénico y la parada cardiaca: Un metaanálisis. J Cardiothorac Vasc Anesth 2015; 29(3): 637-645.
- Cheng R, et al: Complicaciones de la oxigenación por membrana extracorpórea para el tratamiento del shock cardiogénico y la parada cardiaca: un metaanálisis de 1.866 pacientes adultos. Ann Thorac Surg 2014; 97(2): 610-616.
- Bermúdez CA, et al: Oxigenación por membrana extracorpórea para el shock refractario avanzado en la miocardiopatía aguda y crónica. Ann Thorac Surg 2011; 92(6): 2125-2131.
- Vaquer S, et al: Revisión sistemática y metaanálisis de las complicaciones y la mortalidad de la oxigenación por membrana extracorpórea venovenosa para el síndrome de distrés respiratorio agudo refractario. Ann Cuidados Intensivos 2017; 7(1): 51.
- Schmidt M, et al: La puntuación de riesgo de mortalidad PRESERVE y el análisis de los resultados a largo plazo tras la oxigenación por membrana extracorpórea para el síndrome de distrés respiratorio agudo grave. Intensive Care Med 2013; 39(10): 1704-1713.
- Hilder M, et al: Comparación de los modelos de predicción de la mortalidad en el síndrome de distrés respiratorio agudo sometido a oxigenación por membrana extracorpórea y desarrollo de una nueva puntuación de predicción: la PREdiction of Survival on ECMO Therapy-Score (PRESET-Score). Crit Care 2017; 21: 301.
CARDIOVASC 2018; 17(6): 4-7