La enfermedad del hígado graso no alcohólico es la enfermedad hepática más común en todo el mundo. La directriz alemana S2k, actualizada en 2022, recomienda el cribado de los pacientes de riesgo. El algoritmo de cribado propuesto incluye la evaluación de la fibrosis y la detección de esteatosis como elementos principales y se ajusta en gran medida a las recomendaciones de la EASL. Los principales pilares de la terapia son la modificación del estilo de vida y el control de las comorbilidades.
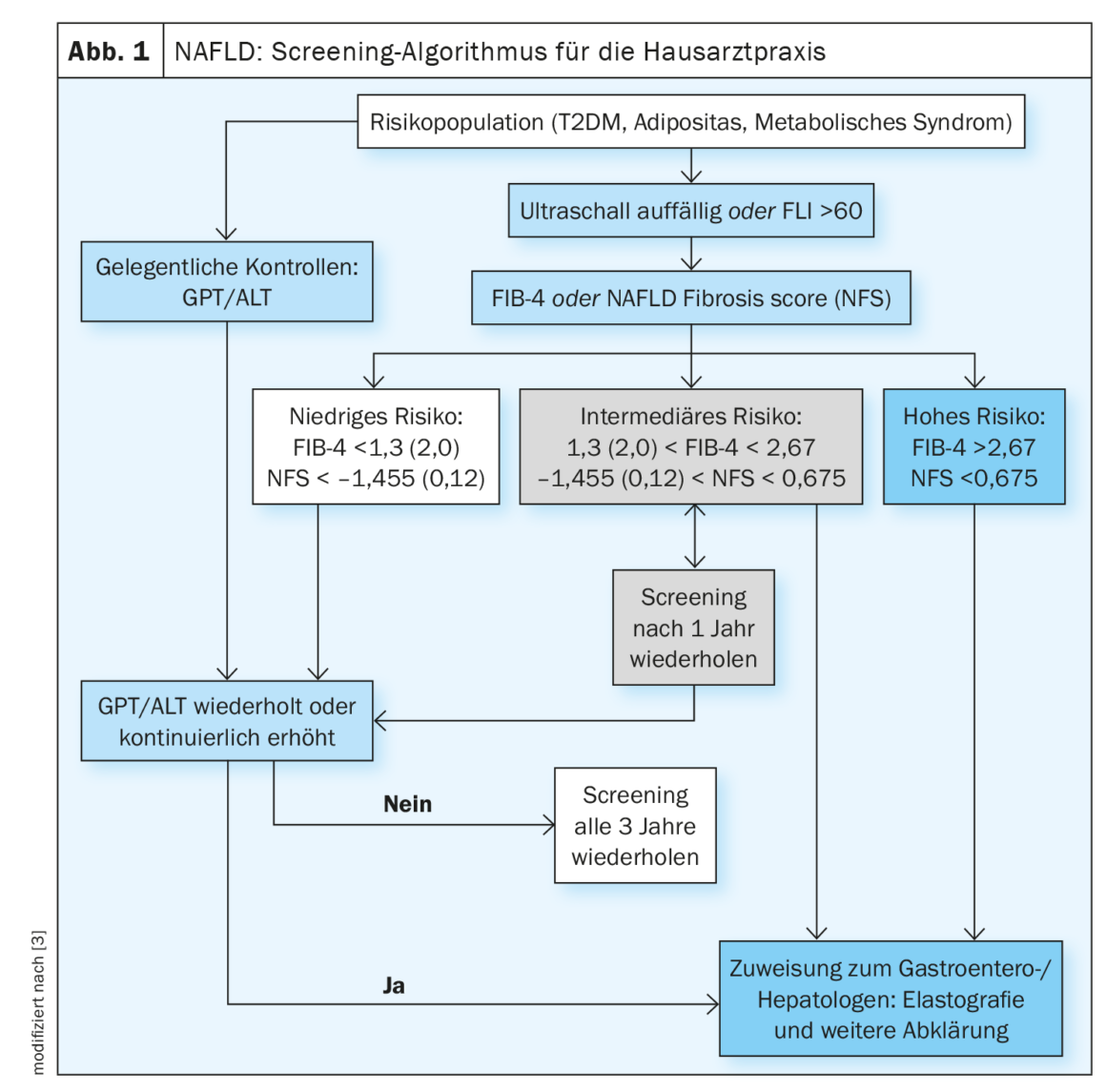
La enfermedad del hígado graso no alcohólico es una de las principales causas de complicaciones y muerte asociadas al hígado. Un nivel elevado de fibrosis se asocia a un mayor riesgo de complicaciones. La regresión de la remodelación cirrótica es posible [1]. En un estudio publicado en 2022, se demostró que la mejora de la fibrosis hepática reducía 10 veces el riesgo de complicaciones (HR, 0,08; IC 95%: 0,02-0,32) [2]. El algoritmo de cribado de la HGNA propuesto para el ámbito de la atención primaria (Fig. 1 ) incluye puntuaciones como el cociente AST/ALT o el FIB-4 [3]. Los pacientes que presenten uno o más factores de riesgo de fibrosis avanzada deben someterse a un cribado: Edad >45-55 años, diabetes tipo 2 (DMT2), síndrome metabólico, obesidad (IMC >30 kg/m²), hipertensión arterial [2,3]. La DMT2 y la obesidad son factores de riesgo independientes para el desarrollo de fibrosis relacionada con EHNA [4]. En pacientes con sospecha de HGNA, la ecografía transabdominal actúa como modalidad de imagen primaria en el cribado.
Dependiendo del estadio de la fibrosis, los pacientes con HGNA presentan un aumento de la mortalidad relacionada con el hígado y de la mortalidad por cualquier causa en comparación con los controles sanos [5,6]. Las causas cardiovasculares de muerte encabezan la lista [7,8].
En un análisis retrospectivo de 619 pacientes con HGNA durante el periodo 1975-2005 y una mediana de seguimiento de 12,6 años, la enfermedad cardiovascular fue la causa más común de muerte (38%), seguida de la enfermedad tumoral no hepática (19%) y las complicaciones de la cirrosis hepática (8%) [9]. Datos similares proceden de dos estudios prospectivos de Suecia con un seguimiento de hasta 33 años: causas de muerte cardiovasculares 43% y 48%, tumores no hepáticos 23% y 22%, y mortalidad relacionada con el hígado 9% y 10% [10,11].
Detección de la progresión de la fibrosis en pacientes de alto riesgo
La directriz s2k sugiere el cribado de los pacientes de riesgo cada 2-3 años mediante un algoritmo que coincide en gran medida con el de las directrices de práctica clínica de la Asociación Europea para el Estudio del Hígado (EASL) y otras recomendaciones de consenso para médicos de familia y diabetólogos, pero es más sencillo de utilizar (Fig. 1) [3,12]. El FLI (índice de hígado graso) puede utilizarse para la determinación no invasiva del contenido graso del hígado. Las herramientas utilizadas habitualmente para la predicción no invasiva de la fibrosis son el FIB-4 y la puntuación de fibrosis NAFLD (NFS).
El FIB-4 es fácil de calcular a partir de los valores de AST, ALT, plaquetas y la edad del paciente. La evaluación se basa en dos valores de corte: los pacientes con un valor <1,45 haben ein geringes Fibroserisiko, während Patienten mit einem Wert>2,67 tienen un alto riesgo de fibrosis avanzada [13].
La puntuación de fibrosis NAFLD (NFS) es fácil de calcular a partir de valores de laboratorio estándar mediante una máscara de entrada en línea. Para el cálculo se introducen los siguientes parámetros Edad, IMC, diabetes sí/no, AST, ALT, plaquetas y albúmina. Un valor inferior a -1,455 excluye la fibrosis avanzada con una sensibilidad del 90%. Una NFS >0,676 diagnostica la fibrosis avanzada con una especificidad del 97% y una sensibilidad del 67%.
Dado que ambas puntuaciones se basan en gran medida en parámetros rutinarios, son muy adecuadas para su uso en el cribado. Otras puntuaciones de fibrosis no invasivas como la relación AST/plaquetas (APRI) o la puntuaciónBARD (IMC, relación AST/ALT y diabetes)muestran buenos valores predictivos negativos y, por lo tanto, son adecuadas para descartar la fibrosis avanzada.
La secuencia de FLI (índice de hígado graso) y FIB-4 se ha estudiado en una población de riesgo de diabéticos de tipo 2 para el cribado [14].
El uso de valores de corte ajustados a la edad puede ser útil para reducir la elevada proporción de individuos con pruebas intermedias. La gestión de los pacientes de riesgo intermedio es objeto de debate y puede organizarse de forma diferente (reexploración o derivación directa a un hepatólogo). Los estudios futuros deben demostrar si también pueden utilizarse nuevos marcadores sustitutos (por ejemplo, NIS4, puntuación FAST) o técnicas de imagen como la elastografía por RM o la MR-PDFF para evaluar la progresión individual de la fibrosis y el curso de la EHNA [15].
Los datos del registro de NAFLD ofrecen hallazgos reveladores
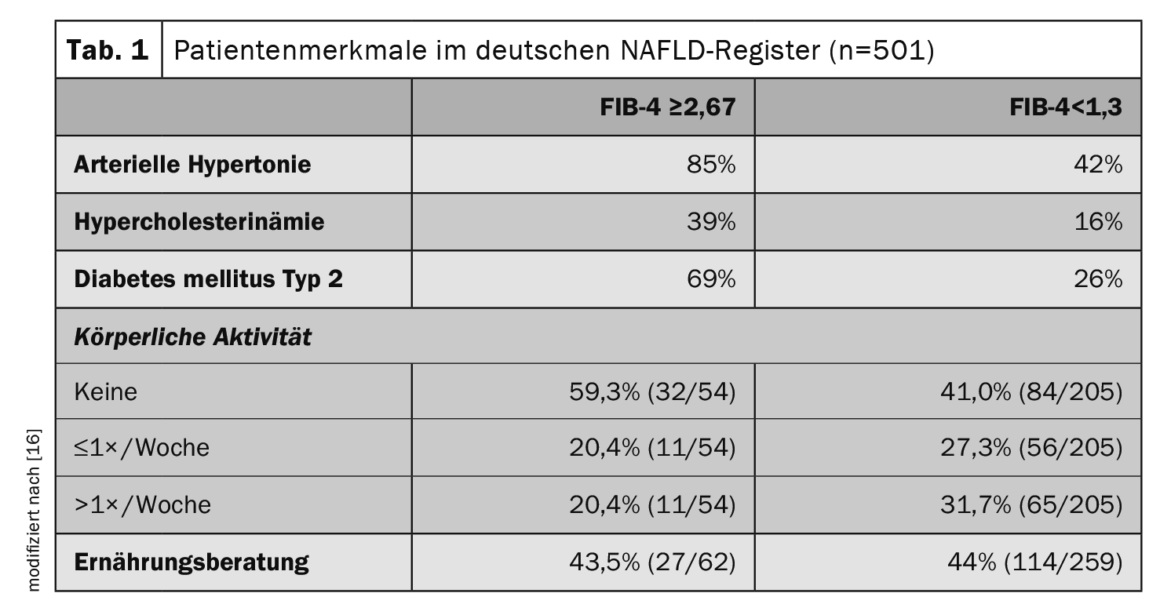
Para saber más sobre los marcadores de riesgo y los factores de importancia pronóstica asociados a la HGNA, los datos de los registros son informativos. El Registro Alemán de HGNA es un estudio prospectivo no intervencionista de la Fundación Alemana del Hígado para describir las características clínicas y la evolución de la enfermedad de los pacientes con HGNA en estructuras de atención secundaria y terciaria [16]. De 501 pacientes con HGNA (edad media 54 años, 48% mujeres), el 13% presentaba un alto riesgo de fibrosis avanzada (índice FIB-4 ≥2,67) y el 10% tenía un diagnóstico clínico de cirrosis. Las estatinas se utilizaron en el 22% de la población total del estudio, mientras que entre los diabéticos, la metformina, los agonistas del GLP-1 y los inhibidores del SGLT2 se utilizaron en el 65%, el 17% y el 17%, respectivamente. Entre los pacientes con fibrosis avanzada (FIB-4 ≥2,67), el 85% tenía hipertensión arterial, el 69% diabetes de tipo 2 y el 39% hipercolesterolemia (tab. 1). El control de las comorbilidades metabólicas y los cambios en el estilo de vida (pérdida de peso y ejercicio) son los pilares del tratamiento de la NAFLD.
Congreso: Praxis Update
Literatura:
- «Leber», Gastroenterologie, Prof. Dr. med. Andreas Stallmach, Praxis Update, Berlin, 28-29.04.2023.
- Sanyal AJ, et al.: Cirrhosis regression is associated with improved clinical outcomes in patients with nonalcoholic steatohepatitis. Hepatology 2022; 75: 1235–1246.
- Roeb E, et al.; Collaborators: Aktualisierte S2k-Leitlinie nicht-alkoholische Fettlebererkrankung der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) – April 2022 – AWMF-Registernummer: 021–025. Z Gastroenterol 2022; 60(9): 1346–1421.
- Jarvis H, et al.: Metabolic risk factors and incident advanced liver disease in non-alcoholic fatty liver disease (NAFLD): A systematic review and meta-analysis of population-based observational studies. PLoS Med 2020; 17: e1003100
- Dulai PS, et al.: Increased risk of mortality by fibrosis stage in nonalcoholic fatty liver disease: Systematic review and meta-analysis. Hepatology 2017; 65: 1557–1565.
- Vilar-Gomez E, et al.: Fibrosis Severity as a Determinant of Cause-Specific Mortality in Patients With Advanced Nonalcoholic Fatty Liver Disease: A Multi-National Cohort Study. Gastroenterology 2018; 155: 443–457.
- Younossi ZM, et al.: Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology 2016; 64: 73–84.
- Kim D, et al.: Asociación entre marcadores de fibrosis no invasivos y mortalidad entre adultos con enfermedad de hígado graso no alcohólico en Estados Unidos. Hepatología 2013; 57: 1357-1365.
- Angulo P, et al.: Liver Fibrosis, but No Other Histologic Features, Is Associated With Long-term Outcomes of Patients With Nonalcoholic Fatty Liver Disease. Gastroenterology 2015; 149: 389-397.e310
- Nasr P, et al.: Natural history of nonalcoholic fatty liver disease: A prospective follow-up study with serial biopsies. Hepatol Commun 2018; 2: 199–210.
- Ekstedt M, et al.: Fibrosis stage is the strongest predictor for disease-specific mortality in NAFLD after up to 33 years of follow-up. Hepatology 2015; 61: 1547–1554.
- Berzigotti A, et al.: EASL Clinical Practice Guidelines (Cpgs) On Non-Invasive Tests For Evaluation Of Liver Disease Severity And Prognosis- 2020 Update. J Hepatol 2021; DOI: 10.1016/j.jhep.2021.05.025.
- Kaswala DH, Lai M, Afdhal NH: Fibrosis Assessment in Nonalcoholic Fatty Liver Disease (NAFLD) in 2016. Dig Dis Sci 2016; 61: 1356–1364.
- Ciardullo S, et al.: Screening for non-alcoholic fatty liver disease in type 2 diabetes using non-invasive scores and association with diabetic complications. BMJ Open Diabetes Res Care 2020; 8.
DOI: 10.1136/bmjdrc-2019-000904. - Loomba R, et al.: Multicenter Validation of Association Between Decline in MRI-PDFF and Histologic Response in NASH. Hepatology 2020;
DOI: 10.1002/hep.31121. - Geier A, et al.: Clinical characteristics of patients with nonalcoholic fatty liver disease (NAFLD) in Germany – First data from the German NAFLDRegistry. Zeitschrift für Gastroenterologie 2023; 61: 60–70.
| Imagen de portada: Micrografía de la enfermedad del hígado graso no alcohólico (NAFLD). Masson’s trichrome & Verhoeff stain. Autor: Nephron, wikimedia |
HAUSARZT PRAXIS 2023; 18(7): 28–29