La gravedad y la prevalencia de la carencia de hierro en la insuficiencia renal crónica son paralelas a su estadio y su origen es multifactorial. En los pacientes con insuficiencia renal, la homeostasis del hierro está significativamente alterada, por lo que los parámetros óptimos de hierro se definen de forma diferente que en la salud renal. Esto tiene implicaciones en los aspectos de la historia clínica, los exámenes a realizar y los límites y objetivos. Este artículo trata de ello y analiza la sustitución del hierro por vía oral y parenteral.
El elemento hierro es esencial y, en términos de cantidad, el oligoelemento más importante para casi todos los organismos vivos. Presente en animales y humanos en forma divalente y trivalente, el hierro interviene principalmente en la fijación del oxígeno y la transferencia de electrones. Estas propiedades fisicoquímicas dan lugar a sus principales funciones como aglutinante y transportador de oxígeno, catalizador de reacciones redox en la cadena respiratoria celular y componente activo de numerosas enzimas no hemo. Sin embargo, la capacidad de los iones de hierro libres de formar especies de oxígeno altamente reactivas (por ejemplo, radicales hidroxilo) a partir de peróxido de hidrógeno (la llamada reacción de Fenton) y de provocar la peroxidación lipídica alberga un potencial citotóxico considerable. Por esta razón, la mayor parte del hierro, tanto intracelular como extracelularmente, está presente en forma redox-inactiva unido a proteínas especializadas [1].
Homeostasis del hierro
El cuerpo humano adulto contiene unos 3,5-5 g de hierro elemental [2]. Está presente casi exclusivamente en forma ligada como hierro de almacenamiento y funcional. La reserva de almacenamiento (0,8-1,2 g) está formada por el complejo proteico ferritina, una proteína de aproximadamente 450 kDa llena de óxido de hidróxido de hierro(III), y la hemosiderina estrictamente intracelular, que es una forma de almacenamiento lenta y difícil de movilizar de la ferritina desnaturalizada. El hígado, el bazo y la médula ósea son especialmente ricos en hierro de almacenamiento. Aunque la proporción de ferritina extracelular es comparativamente pequeña, su concentración sérica parece correlacionarse bien con la reserva de hierro intracelular en los casos normales.
El hierro funcional incluye la hemoglobina (2,5-3 g), que es la más importante en términos de cantidad, la mioglobina (150 mg), el hierro intracelular (80 mg) y las enzimas que contienen hierro (10 mg). El hierro de transporte circulante (4 mg) unido a la transferrina, una glicoproteína de aproximadamente 80 kDa, forma relativamente sólo una pequeña fracción de la cantidad total. Así, el hierro rápidamente intercambiable disponible para la resíntesis del hemo y de las enzimas que contienen hierro (25 mg/día) se recicla varias veces al día. Esto ocurre a través de la descomposición de los grupos hemo en el sistema reticuloendotelial. La saturación de transferrina, la relación entre el hierro sérico y la capacidad total de fijación del hierro (transferrina), es una medida indirecta del hierro disponible [1, 3].
La figura 1 ofrece una visión general de la cantidad de hierro presente y su distribución en adultos sanos.
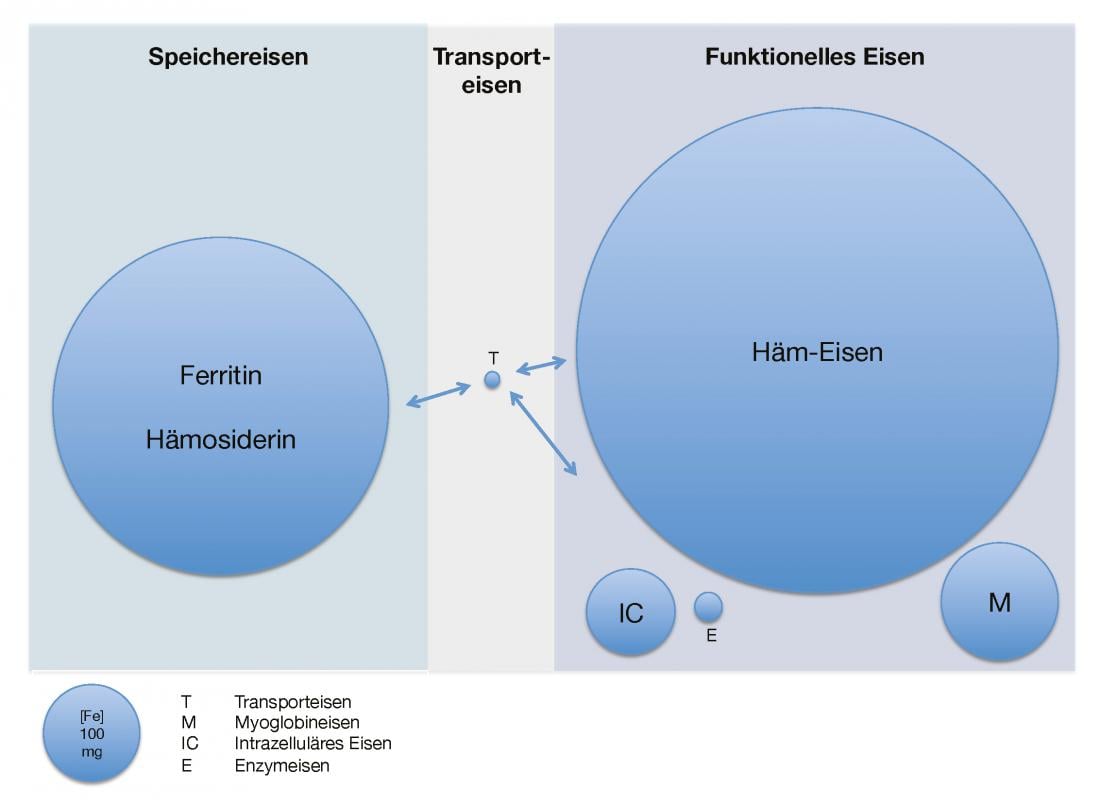
Fig. 1: Cantidad y distribución del hierro disponible en adultos sanos
Distribución del hierro en el organismo bajo aspectos cuantitativos. T corresponde al hierro unido a la transferrina, M al hierro de la mioglobina, IC al hierro intracelular y E al hierro contenido en las enzimas.
Debido a su doble propiedad como oligoelemento indispensable y toxina altamente potente de órganos y células, el equilibrio del hierro y su compartimentación en el organismo están estrictamente regulados. A diferencia de los cationes polivalentes como el calcio, la homeostasis del hierro está regulada exclusivamente por la resorción, ya que las pérdidas normales no pueden controlarse y no es posible aumentar la excreción de hierro. Así, en individuos sanos en estado estacionario, la ingesta diaria de hierro enteral (1-2 mg en hombres, 2-3 mg en mujeres menstruantes) cubre las pérdidas naturales a través de la exfoliación de las células de la piel y las mucosas, la menstruación en mujeres en edad fértil y trazas a través de las heces y la orina.
En los mamíferos, el hierro(III) poco absorbible es reducido al hierro(II) más soluble por el citocromo B duodenal en el polo apical del enterocito. Luego se produce la captación intracelular en el enterocito a través del transportador de metales divalentes (DMT1). El hierro también puede ser captado por un mecanismo paralelo y muy eficaz como hemina, un producto de degradación del hemo y la mioglobina abundante en los productos cárnicos, a través del transportador proteína transportadora de hemo 1 (HCP1). A continuación, el hierro(II) es exportado por la ferroportina basolateral y oxidado directamente por la ceruloplasmina a hierro(III), que se une a la transferrina. Sin embargo, la tasa de reabsorción del hierro absorbido por vía oral es baja, con una media del 6% en los hombres y aproximadamente el doble en las mujeres jóvenes. Un aumento cuando el sistema está estimulado al máximo (deficiencia de hierro) sólo puede llegar al 20%. Un papel clave en esta fina regulación lo desempeña la hormona peptídica hepcidina, descubierta hace unos 13 años. Éste se une e induce la degradación del exportador de hierro ferroportina en los enterocitos duodenales, los macrófagos reticuloendoteliales y los hepatocitos e impide que el hierro se libere a la transferrina. Esto provoca una baja absorción entérica de hierro y una menor liberación de hierro de la ferritina a la transferrina, lo que se conoce como bloqueo reticuloendotelial. El hierro circulante y los mediadores inflamatorios estimulan la producción de hepcidina, mientras que la hipoxemia y la administración de AEE tienen un efecto inhibidor [1, 3-5].
Deficiencia de hierro en la insuficiencia renal crónica
Una de las características más importantes de la insuficiencia renal crónica es la anemia renal, que se asocia a una menor calidad de vida, un aumento de la morbilidad cardiovascular y de la mortalidad por cualquier causa [6, 7]. Además de la deficiencia relativa de eritropoyetina [8, 9], la resistencia uraémica a la eritropoyetina [10] y el tiempo de supervivencia significativamente reducido de los eritrocitos en el medio uraémico [11], debe mencionarse la deficiencia absoluta y funcional de hierro como un factor causal importante. Ambos son también factores importantes en la resistencia a la eritropoyetina, que se caracteriza por la gran demanda de agentes estimulantes de la eritropoyesis (AEE) y la dificultad o incluso imposibilidad de alcanzar el objetivo terapéutico sin necesidad de transfusión [12, 13].
La prevalencia y la gravedad de la carencia de hierro en la insuficiencia renal crónica son paralelas a su estadio y su origen es multifactorial. La inapetencia observada con frecuencia en este colectivo, la restricción dietética de fosfato prescrita y el uso elevado y generalizado de inhibidores de la bomba de protones y captores de fosfato que contienen calcio conducen a una ingesta y absorción de hierro reducidas [14, 15]. Debido a la trombopatía urémica y a la gastritis, hay pérdidas gatrointestinales adicionales. Paralelamente, con el aumento de la insuficiencia renal, se produce un aumento de la formación y acumulación de hepcidina debido al estado proinflamatorio asociado a la uremia y a la disminución del aclaramiento de las hormonas peptídicas. Esta constelación particular explica la deficiencia funcional de hierro observada con frecuencia en diversos grados, que se caracteriza por valores elevados de ferritina y valores de saturación de transferrina de bajos a normales [4, 12, 15, 16]. En consecuencia, en los pacientes con insuficiencia renal, el valor de ferritina para la definición de la carencia de hierro se establece más alto que en los pacientes renales sanos, en 100-200 ng/ml [6, 7, 15, 17]. Una formulación alternativa para esto sería que la utilización óptima del hierro en estos pacientes se produce a expensas de un aumento del hierro de almacenamiento. Así, los niveles de ferritina sérica inferiores a 100 ng/ml presentan una respuesta subóptima a los AEE y unas reservas insuficientes [18].
Por el contrario, casi todos los pacientes con insuficiencia renal, incluidos los pacientes en hemodiálisis, tienen suficientes reservas intramedulares de hierro cuando los niveles de ferritina sérica son superiores a 300 ng/ml [19]. Sin embargo, Mirahmadi et al. demostraron biopticamente hace décadas que a niveles de ferritina sérica superiores a 124 ng/ml ciertos pacientes en hemodiálisis ya muestran signos de sobrecarga de hierro [20]. Toda la situación se vuelve aún más compleja si se tiene en cuenta el hecho de que ciertos pacientes en hemodiálisis con niveles elevados de ferritina sérica (hasta más de 1200 ng/ml) siguen mostrando una respuesta positiva a la administración parenteral de hierro, sobre todo cuando la saturación de transferrina es subóptima, inferior al 20% [21, 22].
Estas cifras demuestran claramente que la evaluabilidad general de estas pruebas debe relativizarse [23]. En caso de movilización rápida de la reserva de hierro, como ocurre, por ejemplo, en el contexto de una terapia con AEE recién iniciada o intensificada, el aporte de hierro procedente de las reservas puede ser insuficiente, lo que conduce a la denominada eritropoyesis limitada por hierro. Puede producirse independientemente de la carencia funcional de hierro y se caracteriza por un contenido reducido de hemoglobina en los eritrocitos y sus precursores. El porcentaje de eritrocitos hipocrómicos (% HRC) y el contenido de hemoglobina reticulocitaria (CHr) son indicadores bien establecidos de la carencia funcional de hierro y de la oitropoyesis limitada por el hierro. Así pues, un CHr inferior a 29 pg/célula en pacientes en tratamiento con AEE es indicativo de una carencia funcional de hierro. La hemoglobina reticulocitaria equivalente (Ret-HE) por debajo de 30,6 pg/célula, una contrapartida de la CHr medida por un método alternativo, es en sí misma altamente predictiva de una buena respuesta a la administración intravenosa de hierro en pacientes en hemodiálisis tratados con AEE. Los parámetros más nuevos y precisos de la ferropenia funcional y la eritropoyesis limitada por el hierro, como la protoporfirina de zinc eritrocítica (ZPP) y el receptor soluble de transferrina (sTFR), no se recomiendan actualmente como pruebas estándar en pacientes con insuficiencia renal debido a su disponibilidad limitada, sus costes más elevados y su experiencia aún insuficiente [22].
Según los criterios mencionados anteriormente, la prevalencia de la carencia de hierro en pacientes con insuficiencia renal no dependientes de diálisis (ERC estadios 3 y 4) es superior al 50% [15]. La situación de los pacientes en hemodiálisis es aún más crítica. Aparte de los factores ya mencionados, hay una pérdida considerable de hierro de 1-3 g (con un hematocrito normal, 1 ml de sangre contiene aproximadamente 0,5 mg de hierro) debido a las numerosas extracciones de sangre y al secuestro regular de sangre en el filtro y el equipo de diálisis. Esto conduce prácticamente a una deficiencia de hierro en todos los pacientes si las pérdidas no se reemplazan por una sustitución adecuada [10].
La ferropenia aislada sin anemia (EoA), una entidad cada vez mejor definida en pacientes renalmente competentes [24, 25], es rara en pacientes renalmente insuficientes. A menudo se trata de situaciones iatrogénicas en las que los pacientes no reciben sustitución de hierro o incluso flebotomía durante mucho tiempo debido a valores de hematocrito espontáneamente elevados. Un tratamiento inadecuado de la anemia renal con dosis elevadas de AEE y la falta o insuficiencia de sustitución de hierro pueden conducir al mismo cuadro. Los síntomas generales típicos de la EoA como la fatiga, el déficit de atención, la termorregulación alterada y la caída del cabello están ausentes o enmascarados por los síntomas de la uremia que se encuentran en primer plano. Sólo el síndrome de las piernas inquietas (SPI) parece estar asociado a la carencia funcional de hierro en esta población, independientemente del grado de anemia [26].
Sustitución y monitorización del hierro en la insuficiencia renal
Todos los pacientes renales deben ser examinados para detectar la presencia de anemia. La prevalencia de la anemia renal aumenta significativamente a partir del estadio 3 de la ERC y requiere un estudio adecuado [6, 7, 27]. Además de una anamnesis y un examen específicos, se incluye al menos un hemograma completo con índices eritrocitarios y recuento absoluto de reticulocitos y un nivel sérico de vitamina B12 y folato. El estado del hierro debe evaluarse en función del hierro de almacenamiento (ferritina sérica) y del hierro rápidamente movilizable (saturación de transferrina y/o contenido de hemoglobina reticulocitaria) [6, 7].
La sustitución con hierro se recomienda en principio para todos los pacientes con insuficiencia renal dializados y no dializados con anemia y tratamiento con AEE. Además, la administración parenteral de hierro puede evitar o al menos retrasar la necesidad de terapia con AEE en pacientes no dializados y contribuye a una reducción sustancial de la necesidad de AEE en pacientes en hemodiálisis, lo que se asocia a beneficios económicos y posiblemente sanitarios [6, 7, 13, 28].
Aunque los grupos de expertos no los definen de manera uniforme, se puede extraer un consenso sobre los valores objetivo. Se acepta unánimemente un valor mínimo de 200 ng/ml para la ferritina sérica y del 20% para la saturación de transferrina. Alternativamente, se definen valores objetivo para CHr (>29 pg/cell) y % HCR (<10%) además de la saturación de transferrina. Estos requisitos mínimos no representan en sí mismos valores objetivo a nivel de la población, que aquí son naturalmente más elevados.
Sigue siendo más complicado pronunciarse con claridad sobre los límites máximos con respecto a las complicaciones inmediatas y las tardías, aún poco estudiadas, de la terapia parenteral con hierro [29–31]. Se han observado signos de toxicidad hepática y un aumento de la mortalidad y de la susceptibilidad a las infecciones en pacientes en hemodiálisis con sobrecarga de hierro [15, 29, 32]. En general, no se recomienda la suplementación con hierro para niveles de ferritina superiores a 500 ng/ml [6, 7, 17]. Además, en caso de infecciones activas y fiebre, debe evitarse la administración parenteral de hierro debido a los efectos deletéreos sobre el sistema inmunitario y a la menor capacidad de transporte asociada a la inflamación [7]. El déficit funcional persistente de hierro requiere el esclarecimiento adicional de una infección criptogénica o una neoplasia. Si se excluyen ambos, puede recurrirse a la optimización del tratamiento de hemodiálisis y a la administración controlada de hierro parenteral para intentar superar esta afección. En un futuro próximo, se espera poder tratar el “bloqueo de hierro urémico” de forma aún más eficaz mediante el uso terapéutico de inhibidores de la hepcidina. La tabla 1 resume los parámetros objetivo para la terapia con hierro según las directrices disponibles en la actualidad.
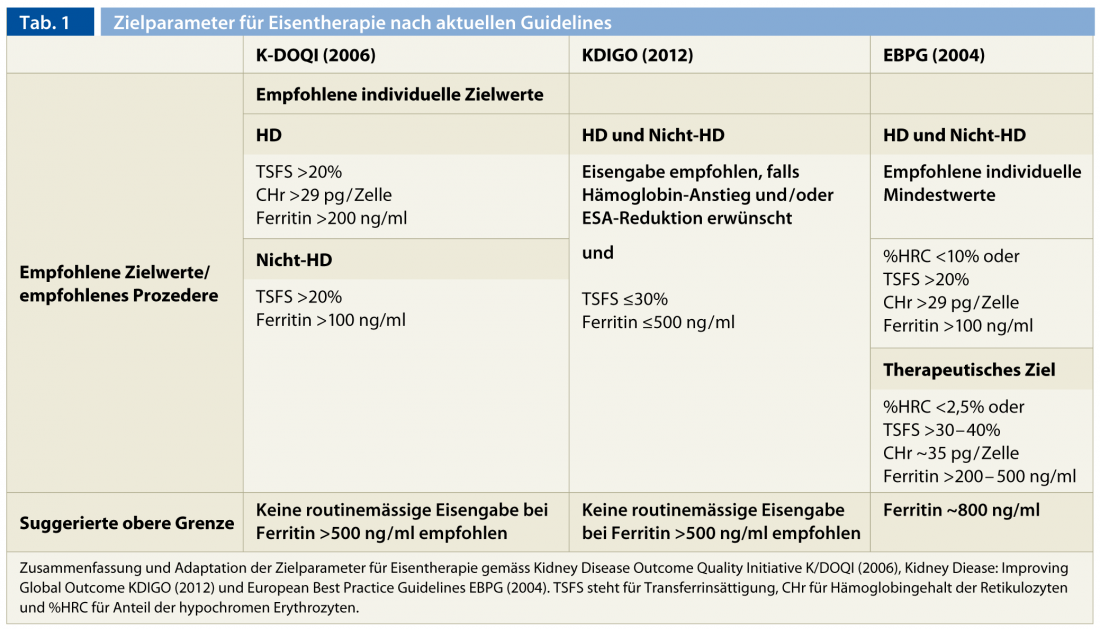
El efecto terapéutico debe ser regular para garantizar unas reservas de hierro óptimas continuas y evitar efectos secundarios tóxicos debidos a la acumulación incontrolada de hierro de almacenamiento (de aprox. 500-800 ng/ml de ferritina) y/o a la superación de la capacidad de transporte sérico con un aumento deletéreo del hierro libre en el suero (TSFS >60%) [33]. Es importante señalar que la evaluabilidad de los parámetros de hierro se ve gravemente afectada inmediatamente después de la administración parenteral de hierro y debe observarse un intervalo de al menos una semana entre la administración y la medición. Se recomiendan controles mensuales durante las fases de saturación o al inicio de la terapia con AEE. En casos estables y en pacientes sin terapia con AEE, basta con controles trimestrales.
Sustitución oral de hierro
A pesar de su bajo precio y su facilidad de uso, la sustitución oral por hierro presenta varios inconvenientes. El hierro ingerido por vía peroral puede provocar daños oxidativos en el tracto gastrointestinal, que pueden manifestarse clínicamente con vómitos, dispepsia y diarrea. El escaso cumplimiento resultante puede ser significativo, llegando hasta el 70% en ciertos colectivos [34]. Además, la eficacia de la sustitución oral con hierro sigue siendo muy baja por las razones ya mencionadas.
Una reposición más eficaz de las reservas de hierro y una mejor respuesta al AEE sólo pueden lograrse con la forma parenteral [14]. Incluso con unas reservas de hierro previamente normalizadas, la administración peroral no fue capaz de mantener unas reservas de hierro suficientes a largo plazo [35]. Cuando se utilizan preparados con altas dosis de sales de hierro (hierro[II]-anión), la difusión pasiva e incontrolada del hierro puede provocar un aumento significativo del hierro libre, el llamado hierro no unido a la transferrina (NTBI), debido al agotamiento de los mecanismos de transporte local, lo que también puede dar lugar a toxicidad sistémica. En general, la sustitución oral debe limitarse a pacientes no en diálisis sin terapia con AEE y sin deficiencia grave de hierro, con una evaluación periódica de la eficacia y la tolerancia [6, 7].
Sustitución parenteral de hierro
Las elevadas necesidades de hierro, sobre todo en los pacientes en hemodiálisis, superan la capacidad de captación y liberación de hierro enteral de la reserva de almacenamiento, que ya está deteriorada en el contexto de la insuficiencia renal, y explican la clara superioridad terapéutica de la administración parenteral sobre la peroral. Por esta razón, se recomienda como forma estándar de administración en todos los pacientes con insuficiencia renal. Actualmente existen en Suiza tres preparados parenterales de hierro (Tab. 2).
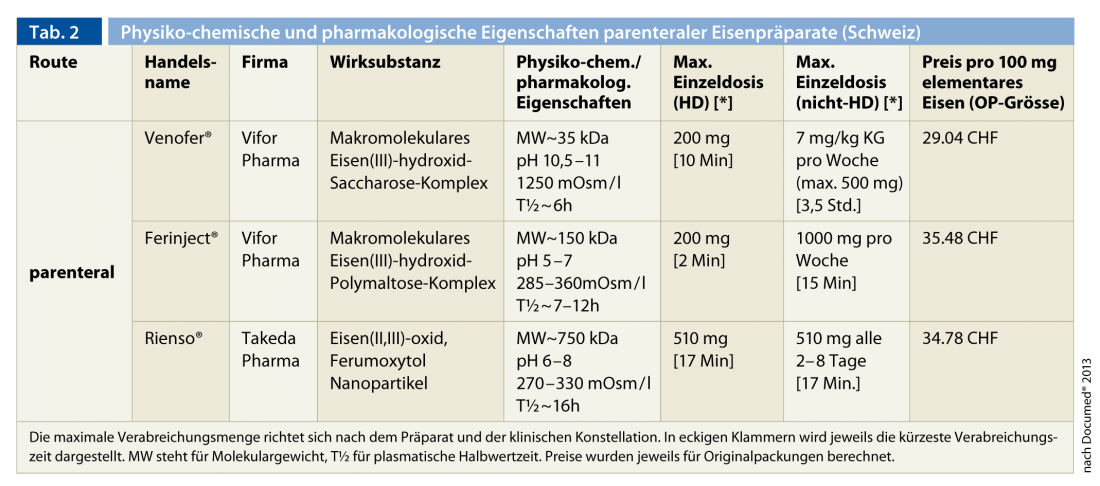
Se trata, por orden cronológico de aprobación, de Venofer® (complejo macromolecular de hidróxido de hierro(III) sacarosa), Ferinject® (complejo macromolecular de hidróxido de hierro(III) polimaltosa) y Rienso® (nanopartículas de óxido de hierro(II, III) (ferumoxitol)). Los preparados de bajo y alto peso molecular que contienen dextrano ya no se comercializan debido a las reacciones adversas potencialmente mortales (anafilaxia). La experiencia adquirida durante décadas con el antiguo preparado (Venofer®) es considerable. Los dos preparados más recientes permiten la administración de dosis únicas más elevadas debido a sus propiedades fisicoquímicas (pH y osmolalidad) y, sobre todo, a la mayor estabilidad del complejo de hierro. Se trata de una ventaja significativa para los pacientes ambulatorios no sometidos a hemodiálisis. En todos los casos, la frecuencia de efectos secundarios graves potencialmente mortales es muy baja. No cabe esperar reacciones cruzadas con los preparados que contienen dextrano, que no están disponibles en Suiza [15, 36]. Ocasionalmente, se observan episodios hipotensivos, broncoespasmo, reacción cutánea, mialgias y artralgias o fiebre, especialmente con la administración rápida.
La terapia se divide en una fase de reposición y otra de mantenimiento. La necesidad inicial de hierro puede calcularse según la fórmula de Ganzoni:
Déficit total de hierro (mg) = [Soll-Hb – Ist-Hb (g/dl)] × peso corporal (kg) × 2,4 + hierro de reserva (mg)
A continuación, esta cantidad puede administrarse de forma fraccionada (Venofer® y Ferinject®) o como dosis única (Ferinject® y Rienso®), según el preparado, la gravedad de la insuficiencia renal y la forma de administración. La dosis de mantenimiento depende del efecto terapéutico conseguido y de los parámetros de hierro controlados regularmente.
CONCLUSIÓN PARA LA PRÁCTICA
- La carencia absoluta y funcional de hierro es frecuente en la insuficiencia renal crónica y está implicada de forma significativa en el desarrollo de la anemia renal.
- La sustitución con hierro es un componente central en la terapia de la anemia renal. La optimización de los parámetros del hierro permite alcanzar los objetivos terapéuticos en la mayoría de los pacientes y minimiza el uso de AEE, lo que se asocia a una reducción de costes y posiblemente a un mejor resultado.
- La homeostasis del hierro está significativamente alterada en la insuficiencia renal, por lo que los parámetros óptimos de hierro se definen de forma diferente que en la salud renal.
- Hoy en día, la administración parenteral es superior a la peroral debido a su mayor eficacia y tolerabilidad. Los preparados parenterales de hierro más modernos son seguros y facilitan mucho la sustitución por hierro.
- Debido a la falta de estudios de resultados a largo plazo y a las pruebas existentes sobre los efectos nocivos de la sobredosis de hierro en esta población, la administración sistemática de hierro sólo debe realizarse respetando los valores objetivo.
Dr. Robert M. Kalicki
Literatura:
- Dunn LL, Suryo Rahmanto Y, Richardson DR: Trends Cell Biol 2007; 17, 93.
- Löffler G: Bioquímica y Patobioquímica. 7 edición. Springer-Verlag: Berlín 2002.
- Andrews NC: Blood 2008; 112: 219.
- Babitt JL, Lin HY: Am J Kidney Dis 2010; 55: 726.
- Nemeth E, et al.: Science 2004; 306: 2090.
- Am J Kidney Dis 2006; 47: S16.
- Kidney International Supplements 2012; 2: 279.
- Jacobson LO, Goldwasser E, Fried W, Plzak L: Nature 1957; 179: 633.
- McGonigle RJ, Wallin JD, Shadduck RK, Fisher JW: Kidney Int 1984; 25: 437.
- Besarab AF, en: Anemia en la enfermedad renal. Lippincott Williams and Wilkins: Filadelfia 2007; 2406-2430.
- Eschbach JW: Kidney Int 1989; 35: 134.
- Babitt JL, Lin HY: J Am Soc Nephrol 2012; 23: 1631.
- Coyne DW, Auerbach M: Am J Hematol 2012; 85: 311.
- Fudin R, Jaichenko J, Shostak A, Bennett M, Gotloib L: Nephron 1998; 79: 299.
- Macdougall IC, Geisser P: Iran J Kidney Dis 2012; 7: 9.
- Ashby DR, et al: Kidney Int 2009; 75: 976.
- Nephrol Dial Transplant 2004; 19 [Suppl 2]: ii6.
- Fernandez-Rodriguez AM, et al: Am J Kidney Dis 1999; 34: 508.
- Aljama P, et al: Clin Nephrol 1978; 10: 101.
- Mirahmadi KS, et al: JAMA 1977; 238: 601.
- Chang CH, Chang CC, Chiang SS: Clin Nephrol 2002; 57: 136.
- Thomas DW, et al: Br J Haematol 2013.
- Kalantar-Zadeh K, et al: Am J Kidney Dis 1995; 26: 292.
- Bruner AB, Joffe A, Duggan AK, et al: Lancet 1996; 348: 992.
- Rowland TW, Deisroth MB, Green GM, et al: Am J Dis Child 1988; 142: 165.
- Sloand JA, Shelly MA, Feigin A, et al: Am J Kidney Dis 2004; 43: 663.
- Bethesda MD, The National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases 2004.
- Solomon SD, et al: N Engl J Med 2010; 363: 1146.
- Kalantar-Zadeh K, et al: J Am Soc Nephrol 2005; 16: 3070.
- Feldman HI, et al: J Am Soc Nephrol 2002; 13: 734.
- Feldman HI, et al: J Am Soc Nephrol 2004; 15: 1623.
- Vaziri ND: Am J Kidney Dis 2013.
- Hershko C, Graham G, Bates GW, et al: Br J Haematol 1978; 40: 255.
- Kruske SG, Ruben AR, Brewster DR: J Paediatr Child Health 1999; 35: 153.
- Macdougall IC, et al: Kidney Int 1996; 50: 1694.
- Auerbach M, Ballard H: Hematología Am Soc Hematol Educ Program 2010; 338.










