La conferencia de la Asociación Americana del Corazón en Chicago atrajo la atención especialmente con dos actualizaciones de estudios largamente esperadas. En este punto, se examinarán con más detalle los resultados más importantes de los estudios IMPROVE-IT y DAPT. ¿Cómo deben clasificarse los datos y qué relevancia práctica tienen?
(ag) Está claro que reducir el colesterol LDL es un pilar fundamental de la prevención cardiovascular. Las pruebas proceden principalmente de estudios con estatinas. Éstos mostraron una reducción de la morbilidad y la mortalidad (las dosis altas de estatinas redujeron aún más la tasa de acontecimientos cardiovasculares no mortales). Hasta la fecha, ningún otro tratamiento hipolipemiante ha podido demostrar un beneficio clínico como complemento de las estatinas (fibratos, niacina, inhibidores de CETP). Las directrices de la AHA/ACC también hacen hincapié en el uso relativamente agresivo de las estatinas. IMPROVE-IT quería demostrar ahora que la reducción de LDL prevista de un 20% más con ezetimiba (en comparación con las estatinas) también se refleja en los resultados clínicos. No sólo es el mayor estudio sobre el tema de los fármacos hipolipemiantes, sino también el más largo. Los datos clave: 18.144 pacientes con síndrome coronario agudo (SCA) estudiados, reclutados en 1158 centros de 39 países y seguidos durante una media de siete años. La pregunta era hasta qué punto los pacientes con SCA de alto riesgo que ya tienen niveles bajos de colesterol LDL (50-125 mg/dl o 50-100 mg/dl si ya estaban tomando una estatina) se benefician de añadir una no estatina a su tratamiento estándar con estatinas. Los resultados pueden considerarse positivos.
Beneficio confirmado – Seguridad buena
Los pacientes, que debían tener al menos 50 años, fueron incluidos en el estudio en los diez días siguientes a su hospitalización (unos 5.000 por IAMCEST, el resto por IAMCEST o angina de pecho inestable). Todos ellos presentaban al menos un rasgo que los caracterizaba como pacientes de alto riesgo para futuros acontecimientos cardiovasculares, por ejemplo, un infarto de miocardio previo, diabetes, enfermedad arterial oclusiva periférica o enfermedad cerebrovascular, enfermedad coronaria en múltiples arterias o cirugía de bypass previa. 9077 recibieron la estatina simvastatina (40 mg), 9067 tomaron también ezetimiba (10 mg), un llamado inhibidor de la resorción del colesterol.
En comparación con el grupo que recibió simvastatina y placebo solos, el grupo de estudio que recibió ezetimiba adicional mostró un 6,4% menos de riesgo cardiovascular (criterio de valoración primario compuesto por muerte cardiovascular, infarto de miocardio, angina inestable con hospitalización, revascularización coronaria o ictus). La tasa de acontecimientos fue del 34,7 frente al 32,7% en los grupos de control y estudio, respectivamente (HR 0,936, IC 0,887-0,988, p=0,016). En cuanto al infarto de miocardio y al ictus, la probabilidad se redujo en un 14% cada uno (de forma significativa para el primero, pero apenas para el segundo). Los pacientes con ezetimiba también tenían un riesgo significativamente menor de sufrir un ictus isquémico (reducción del riesgo del 21%, p=0,008). No hubo diferencias entre los grupos en cuanto a la mortalidad por todas las causas.
La adición de ezetimiba no provocó un aumento relevante de los efectos secundarios (por ejemplo, problemas musculares o de vesícula biliar, cáncer), y la seguridad fue sistemáticamente buena.
¿Cuanto más profundo, mejor?
Así pues, la adición de ezetimiba al tratamiento con simvastatina reduce la probabilidad de futuros problemas cardiovasculares, como infarto de miocardio o ictus, en pacientes con SCA de alto riesgo. Así pues, la reducción adicional de las LDL aporta un beneficio relevante. Aunque los resultados son más bien moderados en magnitud, en vista del buen perfil de seguridad algunos expertos los consideran suficientes para justificar dicha terapia en la práctica clínica.
La terapia dual redujo el colesterol LDL a una media de unos 54 mg/dl (frente a los 69 mg/dl del grupo de control). Cabe destacar que los pacientes que ya tienen un nivel bajo y han alcanzado el objetivo de LDL clínicamente adecuado se benefician de una reducción aún mayor. En la práctica clínica diaria, difícilmente se pensaría en tratar a estos pacientes con un fármaco hipolipemiante adicional. Sin embargo, según los autores, en este caso se aplica el principio de que “aún más bajo es aún mejor”. Esto puede considerarse una confirmación de los resultados del estudio TIMI, que mostró mejores resultados clínicos con una estatina especialmente potente que también reducía los niveles de LDL más que las estatinas de dosis normal. Confirma la hipótesis de que un LDL-C más bajo previene los eventos cardiovasculares. Las directrices futuras podrían hacer referencia a este resultado.
Los críticos señalaron que muchas cosas habían cambiado desde el inicio del estudio IMRPOVE-IT y que simvastatina 40 mg ya no se utilizaba ampliamente en la práctica (ya que las directrices estadounidenses recomiendan dosis más altas de estatinas). Según esta opinión, habría sido más interesante probar la adición de ezetimiba con estatinas más fuertes.
DAPT – ¿Qué ha salido?
El segundo estudio que se esperaba con impaciencia era el estudio DAPT (Fig. 1). Probó la inhibición plaquetaria dual prolongada en pacientes con enfermedad arterial coronaria y un stent liberador de fármacos (DES) colocado. Para ser claros, el tratamiento antiplaquetario dual de 30 meses (aspirina más clopidogrel o prasugrel) provocó un número significativamente menor de coágulos en los stents y menos infartos que el correspondiente tratamiento más corto (12 meses más 18 meses de aspirina + placebo). Estos resultados van más allá de la práctica clínica actual: las recomendaciones estadounidenses aconsejan sólo doce meses de inhibición plaquetaria dual tras la implantación de un DES, mientras que las europeas aconsejan incluso de seis a un máximo de doce meses.
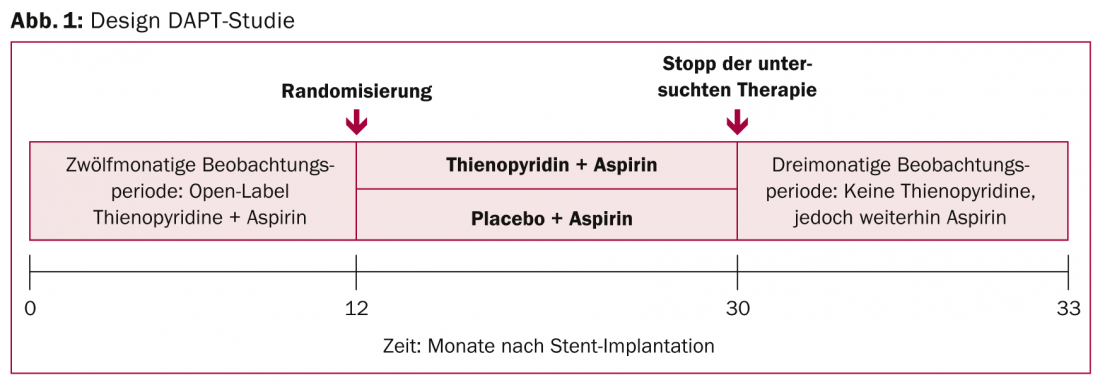
Se aleatorizó a 9961 pacientes y se les hizo un seguimiento de aproximadamente tres años (33 meses). En concreto, con la terapia prolongada (n=5020), el riesgo de la denominada trombosis intra-stent se redujo en más de la mitad al cabo de 30 meses: En el grupo de estudio, la tasa de trombosis del stent, el criterio de valoración primario, fue del 0,4% (frente al 0,6% del grupo de estudio). 1,4%, HR 0,29, CI 0,17-0,48, p<0,001). El criterio de valoración coprimario consistente en acontecimientos adversos cardiovasculares o cerebrovasculares relevantes también mostró una diferencia significativa del 29% a favor de la variante terapéutica de 30 meses. Un componente importante, la tasa de infarto de miocardio, fue del 2,1% (frente a la tasa de infarto de miocardio de la UE). 4,1%, HR 0,47, CI 0,37-0,61, p<0,001) y, por tanto, también se redujo a la mitad. El beneficio en términos de trombosis intra-stent e infarto de miocardio se produjo en todas las combinaciones de fármacos, stents más nuevos y más antiguos y en todos los grupos de riesgo. El beneficio superó al riesgo de una terapia prolongada, al menos en el análisis primario: Aunque hubo una incidencia significativamente mayor de hemorragias de moderadas a graves (criterio de valoración primario de seguridad: 2,5 frente a 1,6%), la tasa de letalidad fue baja en ambos grupos y no mostró diferencias significativas.
Sorprendente aumento de la mortalidad
La administración durante 30 meses no redujo la mortalidad por todas las causas ni las tasas de ictus. Por el contrario, un análisis secundario que también incluyó datos tras el cese de la terapia (después de 33 meses) mostró un aumento del 0,8% en la mortalidad por todas las causas en el grupo de estudio (aparentemente debido a traumatismos y cáncer y no a causas cardiovasculares). Esta diferencia es significativa y fue completamente inesperada. Junto con el aumento de las tasas de hemorragia, empañó los por lo demás buenos resultados. Los autores del estudio sospechan que hubo diferencias en el reclutamiento entre los grupos de estudio. Las personas con cáncer ya diagnosticado podrían haberse distribuido de forma diferente. En vista del sorprendente resultado, emprendieron un metaanálisis [1] de muchos grandes ensayos clínicos que también habían investigado la inhibición plaquetaria dual (con distinta duración de la terapia). No hubo diferencias en la mortalidad por todas las causas o por causas no cardiovasculares en la duración más larga del tratamiento en comparación con la aspirina sola o el tratamiento más corto. Por lo tanto, actualmente asumen un único hallazgo.
Resultado importante con limitaciones
Aunque antes estaba claro que la terapia antiplaquetaria dual era absolutamente esencial en la prevención de todos estos pacientes -después de todo, un coágulo de sangre, ya sea en el stent o en otros vasos sanguíneos, es uno de los riesgos más peligrosos tras la colocación de un DES. Sin embargo, el hecho de que los beneficios continúen más allá de la duración estándar de un año nunca se ha confirmado en un estudio tan amplio y con tan buena potencia. Por un lado, la inhibición plaquetaria dual durante un periodo de tiempo más largo puede considerarse así en determinados pacientes. La selección de los individuos elegibles es clave (el estudio excluyó a los pacientes con hemorragias graves antes o un año después de la colocación de un stent/tratamiento antiplaquetario dual). Curiosamente, parece existir una especie de fenómeno de rebote: tras la interrupción de la terapia antiplaquetaria dual, el riesgo isquémico aumenta durante unos tres meses [2], motivo por el cual se debatió en el congreso la opción de una terapia antiplaquetaria dual continuada, incluso de por vida, para determinados pacientes de alto riesgo.
Por otro lado, la mayor tasa de hemorragias debe tenerse en cuenta en cualquier caso. El estudio también probó su hipótesis, como se ha mencionado, sólo en pacientes en los que estaba claro que toleraban bien la terapia antiplaquetaria dual durante un año. Además, los resultados no pueden generalizarse (sólo se probaron determinados tipos de stents y antiagregantes plaquetarios y no se compararon entre sí).
El estudio se publicó paralelamente en la revista New England Journal of Medicine [3].
Fuente: Sesiones científicas 2014 de la Asociación Americana del Corazón (AHA), 15-19 de noviembre de 2014, Chicago.
Literatura:
- Elmariah S, et al: Terapia antiplaquetaria dual de duración prolongada y mortalidad. The Lancet. Publicado en línea: 16 de noviembre de 2014.
- Garratt KN, et al: Circulation 2014 Nov 16. pii: CIRCULATIONAHA.114.013570 [Epub ahead of print].
- Mauri L, et al: N Engl J Med 2014; 371: 2155-2166.
CARDIOVASC 2015; 14(1): 36-38











