El angiosarcoma asociado a la radiación es más frecuente de lo que se intuye. El diagnóstico inicial debe realizarse lo antes posible. Paradójicamente, incluso con este tumor inducido por la radiación, la re-radiación es una buena opción terapéutica.
El angiosarcoma asociado a la radiación (RAAS) es tan poco frecuente que no existen estudios prospectivos. Por lo tanto, todos los hallazgos anteriores se basan en series de casos retrospectivas e informes de casos. Debido a la publicación selectiva de los casos, las recomendaciones terapéuticas basadas en ellos sólo pueden hacerse con precaución. Por otro lado, hay que conformarse con esto hasta que se disponga de un mayor número de casos y de observaciones a largo plazo procedentes de registros de tumores, algunos de los cuales apenas se están estableciendo.
Los angiosarcomas son tumores altamente malignos de las células endoteliales, que sólo representan alrededor del 1-2% de todos los sarcomas de partes blandas [1]. El angiosarcoma de mama puede ser primario o secundario a un linfedema crónico tras una mastectomía (síndrome de Stewart-Treves) [2] o dentro de un RAAS en un campo de radiación previo [3]. Los angiosarcomas primarios parecen tener mejor pronóstico que los RAAS [4–6]. Los criterios modificados de Cahan suelen utilizarse para la diferenciación [7,8]. Entre ellas se incluyen:
- Diferente histología del tumor primario inicial y del tumor secundario
- Desarrollo del tumor secundario en el campo de irradiación anterior
- Latencia entre el tumor primario y el secundario de más de tres años.
En general, se informa de una latencia media de seis años entre la radioterapia (RT) del tumor primario y la aparición de la RAAS [1,9]. Este lapso de tiempo es significativamente menor en comparación con otros sarcomas asociados a la radiación, que normalmente sólo aparecen después de 10-20 años [10,11]. Se puede suponer una cierta disposición genética, aunque no se ha demostrado [12].
Un análisis de la base de datos SEER de casi 275.000 pacientes con cáncer de mama mostró una incidencia acumulada de RAAS del 0,09% al cabo de 15 años [9]. Esto parece estar aumentando debido a la RT adyuvante que se realiza de forma rutinaria tras la terapia conservadora de la mama (BET) para el carcinoma de mama o el CDIS [1]. El grado en que las terapias sistémicas intensificadas contribuyen a la génesis sigue sin estar claro.
La tasa de supervivencia a 5 años es baja y se informa de que es del 27-35% según la base de datos SEER [9]. Las razones de este mal pronóstico son múltiples. Las decoloraciones rojizas-lívidas, en parte planas, que aparecen en el antiguo campo de irradiación atraen la atención del paciente demasiado tarde. Además de la infestación macroscópica, se produce precozmente una metástasis microscópica oculta en la piel, similar a un “salto de pulga”. Esto apenas puede contrarrestarse quirúrgicamente, ya que puede volver a manifestarse rápidamente tras la extirpación del hallazgo macroscópico en otra localización [10,13,14].
No existen recomendaciones terapéuticas uniformes. La atención se centra en el procedimiento quirúrgico. La mayor revisión realizada hasta la fecha, basada en 222 pacientes con una RAAS, muestra un intervalo libre de recidiva local a 5 años del 32% y una tasa de supervivencia a 5 años del 43% [1], que es superior en comparación con la base de datos SEER (27-35%). Esto se debe probablemente a que los pacientes analizados procedían de informes de casos y series de casos con una respuesta predominantemente excepcional y terapias combinadas, por lo que el pronóstico está sobreestimado debido al sesgo de publicación. Por el contrario, esto puede indicar una posible mejora del pronóstico mediante terapias combinadas.
Informe de un caso
Informamos sobre una paciente que ahora tiene 79 años y padece una RAAS. 11/2006 se le diagnosticó un carcinoma ductal invasivo de mama en la izquierda. Se realizó BET con tumorectomía y linfadenectomía axilar centinela con un estadio de pT1c pN0 (0/1 sn) cMO ER/PR positivo, HER2 negativo. Tras la operación, se realizó RT adyuvante normofraccionada de toda la mama con campos tangenciales de hasta 50 Gy y un refuerzo local de 16 Gy seguido de terapia hormonal.
08/2011 la paciente notó una gran decoloración lívido-amarillenta en toda la mama izquierda con brotes de bultos y exulceraciones incipientes. El pezón ya no era reconocible (Fig. 1). Histológicamente, se detectó un hemangiosarcoma poco diferenciado (G3) que fue confirmado por una segunda evaluación.
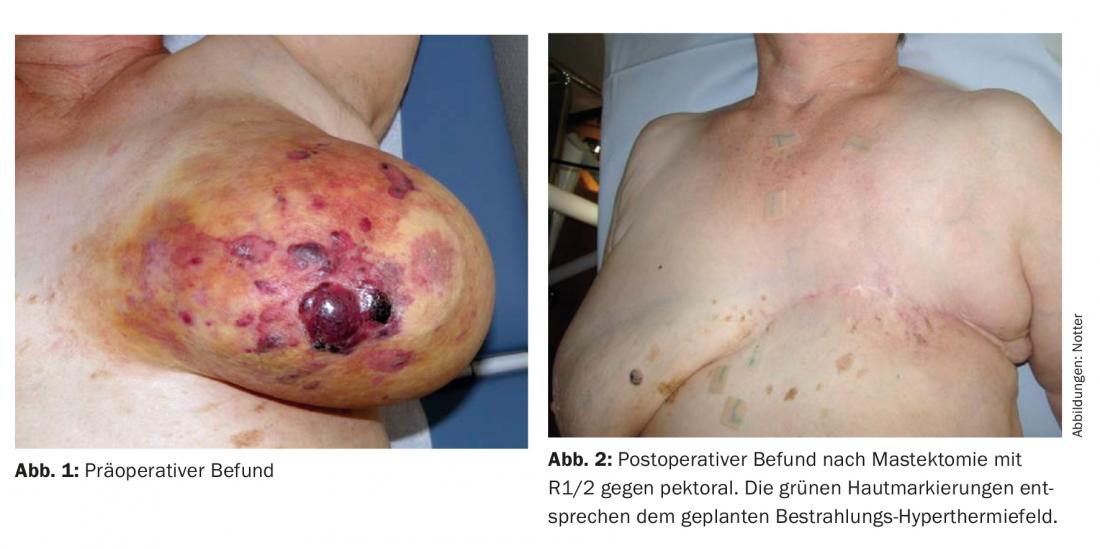
En la junta tumoral tuvo lugar una discusión preoperatoria sobre la estrategia terapéutica, en la que se recomendó una mastectomía seguida de reirradiación (re-RT) combinada con hipertermia (HT) a gran escala. En el postoperatorio se observó una resección R1/R2 en la zona de la cicatriz y hacia el pectoral (Fig. 2) . No se realizó una resección. Posteriormente, se realizó una re-RT hipofraccionada con 5× 4 Gy, 1×/semana, concomitante con THS de superficie, en analogía con un esquema terapéutico establecido de recidivas de mama y pared torácica [15] (Fig. 3) .
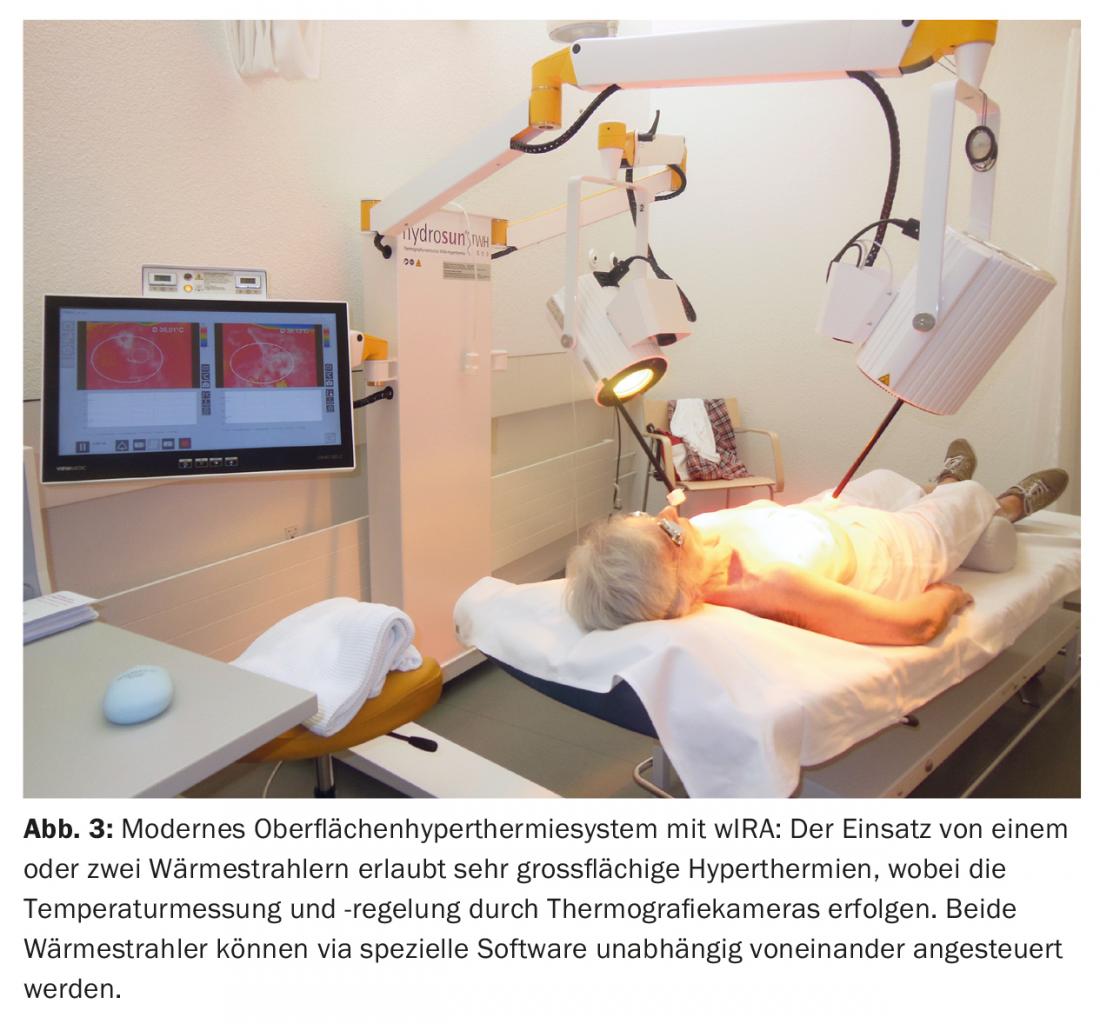
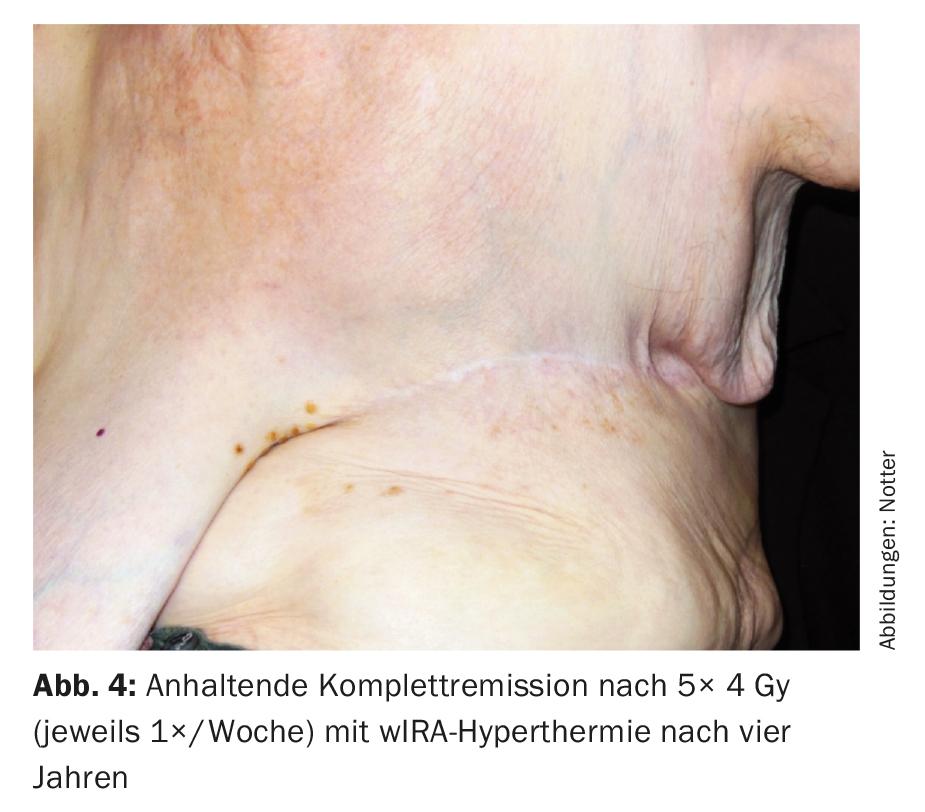
Ésta se administró siempre el mismo día antes de la RT con infrarrojos A filtrados por agua controlados por termografía (wIRA) durante 45 minutos. La RT se realizó en los dos minutos siguientes a la finalización de la TH con 4 Gy (9 electrones MeV) cada una y una dosis total de 20 Gy. El objetivo primario fue la región R1/R2, con la intención profiláctica de irradiar toda la pared torácica izquierda en una zona amplia para tratar las metástasis ocultas. Este tratamiento fue bien tolerado, con sólo un leve enrojecimiento transitorio de la piel (CTCAE grado 1) como efecto secundario. Cuatro años más tarde, también se produjo una remisión completa (Fig. 4), que duró hasta seis años después (08/2017). Esto es inusual en la medida en que los parámetros relevantes (resección R1/2, tumor >10 cm, multifocalidad, G3) indicarían un riesgo de recidiva local muy elevado.
Debate
Debido a su rareza, la RAAS de mama suele diagnosticarse demasiado tarde y a menudo no se analiza inicialmente/preoperatoriamente de forma interdisciplinar. El tratamiento estándar es la resección quirúrgica R0 como parte de una mastectomía o una resección local de la pared torácica con márgenes de seguridad generosos, aunque a pesar de la radicalidad R0 el riesgo de recidiva local es considerable, de hasta un 66% [13]. Se han descrito varios enfoques para reducir el riesgo de recidiva local con resecciones aún más extensas (“superradicales”/”márgenes amplios”) y los correspondientes déficits funcionales y mutilaciones. Se ha demostrado que la resección R0 es pronóstica tanto en la cirugía inicial como en caso de recidiva, pero que las recidivas pueden surgir de células diseminadas microscópicamente a pesar de la resección R0 [13,14,16]. Aún no está claro hasta qué punto la distancia de resección en individuos sanos es un factor determinante. Existen informes que no han podido demostrar una diferencia pronóstica entre un margen de resección libre <1 cm y >1 cm [14]. Un reciente estudio quirúrgico retrospectivo de 76 pacientes muestra que la cirugía “radical”, con la extirpación de al menos toda la piel previamente irradiada, tiene un pronóstico significativamente mejor que la “conservadora” (tasa de recidiva local a 5 años del 23% frente al 76%) [16]. Sin embargo, se produjeron más complicaciones en las heridas. También debe mencionarse que se administraron de forma concomitante un número significativamente mayor de quimioterapias (ChT) en las operaciones “radicales”, lo que podría haber actuado como factor de confusión.
En última instancia, el control de las metástasis microscópicas ocultas en la “zona de riesgo” parece ser el principal factor pronóstico de la recidiva posterior. Esto plantea la cuestión de si el control de la gran “zona de riesgo” debe realizarse necesariamente de forma quirúrgica y si podría haber opciones menos mutilantes. Por tanto, las opciones serían tanto la quimioterapia neoadyuvante como la adyuvante (ChT). En el mayor análisis con RAAS y ChT con 95 pacientes, se comparó retrospectivamente la cirugía sola con el ChT adicional (neo)adyuvante. Se consideró contraindicada la repetición del tratamiento. Con una pequeña posibilidad preoperatoria de resección R0/R1, se realizó un ChT neoadyuvante. El ChT adyuvante postoperatorio se realizó para lesiones tumorales grandes, G3 o distancias de resección <1 cm. Sorprendentemente, el grupo de peor pronóstico con cirugía y ChT mostró una supervivencia libre de recidiva local a 5 años significativamente mejorada del 62,8% en comparación con el 36,9% con cirugía sola, pero sin un impacto significativo en las tasas de supervivencia a 5 años [10]. Basándose en estos datos, desgraciadamente no es posible hacer una recomendación segura para el ChT, ya que, por un lado, no se utilizó un régimen de ChT uniforme y, por otro, no es posible realizar un análisis de subgrupos debido al número demasiado pequeño de casos. Un factor limitante adicional que debe tenerse en cuenta es que muchas mujeres titulares de patentes difícilmente podrían tolerar un ChT agresivo debido a su edad y a su estado general.
¿Puede ofrecerse la re-RT a pesar de una afección preexistente importante? Para diversas clínicas y juntas de tumores, una exposición previa sigue considerándose erróneamente una contraindicación debido a las posibles toxicidades [10,14,16]. Como muestra el ejemplo de la repetición de la RT (con TH) de las recidivas de mama y pared torácica, esto no está justificado [15,17–20]. El perfil de efectos secundarios depende del fraccionamiento, la dosis total y la latencia entre la RT primaria y la repetición de la RT prevista. Los datos disponibles hasta la fecha parecen apoyar el uso de la re-RT en la RAAS [21]. De forma análoga a las recidivas clásicas de la pared torácica, resulta interesante la combinación de re-RT con hipertermia de superficie (HT).
En el carcinoma de mama recidivante, un metaanálisis de 2110 pacientes mostró una tasa de remisión completa del 60% con una baja tasa de efectos secundarios al combinar la repetición de la RT y la TH [19]. La hipertermorradioterapia (HTreRT) para la recidiva mamaria o de la pared torácica se incluye en las directrices de la NCCN como “evidencia de categoría 3”. La TH se define como un calentamiento controlado del tejido a una temperatura de 39-43°C y actúa principalmente como radiosensibilizador a través de
- Inhibición de la reparación del daño del ADN inducido por la radiación
- Mejora de la microperfusión tumoral con sensibilización de las células hipóxicas y, por tanto, radioresistentes [19].
Esta última es especialmente útil en una pared torácica precargada radiogénicamente, fibrosada y, por tanto, capilarmente mal irrigada [15].
En una revisión de 222 pacientes con RAAS, la cirugía con re-RT adyuvante logró un mejor control local que la cirugía sola. Sin embargo, la TH se administró además de la repetición de la RT en el 30% de los casos [1].
En la RAAS se describe una buena respuesta a la mencionada combinación de HTreRT, utilizando otros regímenes de RT y una aplicación de HT diferente a la de nuestro caso [22,23]. Se incluyeron pacientes tras múltiples recidivas, lo que dio como resultado una baja tasa de supervivencia a 5 años del 11% a una edad media de 70 años, pero un buen efecto paliativo con tasas de control a 3 años del 46% (postoperatorio) y del 22% (HTreRT sola).
Conclusión
En resumen, una comparación directa de las diferentes opciones terapéuticas no es factible de forma fiable debido al escaso número de casos y a la recopilación retrospectiva de datos. En una entidad como la RAAS de mama, en la que la cirugía suele “perseguir” la enfermedad, debe buscarse una terapia interdisciplinar proactiva y bien coordinada. Sería ventajoso que se hablara de la HTreRT postoperatoria en el momento del diagnóstico para cubrir la “zona de riesgo” en una fase temprana. El RAAS pertenece a una junta especializada en tumores.
Mensajes para llevarse a casa
- El angiosarcoma asociado a la radiación (RAAS), con una incidencia aproximada del 0,1%, es más frecuente en las pacientes con cáncer de mama irradiado que en las intuitivas.
- esperado y se produce mucho antes que otros sarcomas asociados a la radiación.
- El diagnóstico inicial debe realizarse lo antes posible y la terapia combinada debe planificarse inicialmente de forma interdisciplinar en una junta tumoral experimentada.
- Paradójicamente, incluso con este tumor inducido por la radiación, la re-radiación es una buena opción de tratamiento con un bajo perfil de efectos secundarios.
- En el caso de la RAAS del tórax/pared torácica, hay mucho que decir a favor de la terapia interdisciplinar con cirugía y la hipertermo-radioterapia adyuvante semiprofiláctica de gran campo.
- Es necesario seguir evaluando el valor de la terapia sistémica adicional neo o adyuvante.
Literatura:
- Depla AL, et al: Tratamiento y factores pronósticos del angiosarcoma asociado a la radiación (RAAS) tras un cáncer de mama primario: una revisión sistemática. Eur J Cancer 2014; 50: 1779-1788.
- Stewart FW, Treves N: Linfangiosarcoma en el linfedema postmastectomía; informe de seis casos en elefantiasis quirúrgica. Cáncer 1948; 1: 64-81.
- Huang J, Mackillop WJ: Mayor riesgo de sarcoma de tejidos blandos tras la radioterapia en mujeres con carcinoma de mama. Cáncer 2001; 92: 172-180.
- Fraga-Guedes C, et al: Angiosarcomas primarios y secundarios de mama: experiencia de una sola institución. Breast Cancer Res Treat 2012; 132: 1081-1088.
- Fury MG, et al: Revisión retrospectiva de 14 años de angiosarcoma: características clínicas, factores pronósticos y resultados del tratamiento con cirugía y quimioterapia. Cancer J 2005; 11: 241-247.
- Vorburger SA, et al: Angiosarcoma de mama. Cáncer 2005; 104: 2682-2688.
- Cahan WG, et al: Sarcoma surgido en hueso irradiado; informe de 11 casos. Cáncer 1948; 1: 3-29.
- Arlen M, et al: Sarcoma óseo inducido por radiación. Cáncer 1971; 28: 1087-1099.
- Yap J, et al: Sarcoma como segunda neoplasia maligna tras el tratamiento del cáncer de mama. Int J Radiat Oncol Biol Phys 2002; 52: 1231-1237.
- Torres KE, et al: Resultados a largo plazo en pacientes con angiosarcomas de mama asociados a radiación tras cirugía y radioterapia por cáncer de mama. Ann Surg Oncol 2013; 20: 1267-1274.
- Manner J, et al: La amplificación del gen MYC a alto nivel es una característica distintiva de los angiosarcomas tras irradiación o linfedema crónico. Am J Pathol 2010; 176: 34-39.
- Nestle-Kramling C, et al.: [Hemangiosarcoma tras terapia conservadora del cáncer de mama: informe de cuatro casos con diagnóstico genético molecular y revisión bibliográfica]. Strahlenther Onkol 2011; 187: 656-664.
- Seinen JM, et al: Angiosarcoma asociado a la radiación tras un cáncer de mama: alta tasa de recurrencia y escasa supervivencia a pesar del tratamiento quirúrgico con resección R0. Ann Surg Oncol 2012; 19: 2700-2706.
- Lehnhardt M, et al: [Radiation-induced angiosarcoma of the breast]. Handchir Microchir Plast Chir 2017; 49: 103-110.
- Notter M, Piazena H, Vaupel P: Reirradiación hipofraccionada del cáncer de mama recidivante de gran tamaño con hipertermia infrarroja A controlada por termografía y filtrada por agua sin contacto: un estudio retrospectivo de 73 pacientes. Int J Hipertermia 2016; 1-10.
- Li GZ, et al: Angiosarcoma cutáneo de mama asociado a radiación: la radicalidad de la cirugía influye en la supervivencia. Ann Surg 2017; 265: 814-820.
- Wahl AO, et al: Revisión multiinstitucional de la irradiación repetida de la pared torácica y la mama para el cáncer de mama recurrente. Int J Radiat Oncol Biol Phys 2008; 70: 477-484.
- Vernon CC, et al: Radioterapia con o sin hipertermia en el tratamiento del cáncer de mama localizado superficial: resultados de cinco ensayos controlados aleatorizados. Grupo Internacional de Colaboración en Hipertermia. Int J Radiat Oncol Biol Phys 1996; 35: 731-744.
- Datta NR, et al: Hipertermia y radioterapia en los cánceres de mama locorregionales recidivantes: una revisión sistemática y metaanálisis. Int J Radiat Oncol Biol Phys 2016; 94: 1073-1087.
- Datta NR, et al: Hipertermia y reirradiación para las recidivas locorregionales en cánceres de mama preirradiados: experiencia de una única institución. Swiss Med Wkly 2015; 145: w14133.
- Ghareeb ER, et al: Angiosarcoma mamario primario e inducido por radiación: predictores clinicopatológicos de resultados e impacto de la radioterapia adyuvante. Am J Clin Oncol 2016; 39: 463-467.
- Linthorst M, et al.: Efecto de una terapia combinada de cirugía, reirradiación e hipertermia sobre la tasa de control local en el angiosarcoma radioinducido de la pared torácica. Strahlenther Onkol 2013; 189: 387-393.
- de Jong MA, et al: Reirradiación e hipertermia para el sarcoma asociado a la radiación. Cáncer 2012; 118: 180-187.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2017; 5(4): 28-32











