Un mayor número de donantes voluntarios y un acondicionamiento de intensidad reducida hacen que el trasplante alogénico de células madre sea accesible hoy en día a una mayor población de pacientes. A su vez, el trasplante autólogo de células madre también detiene las enfermedades autoinmunes al “reiniciar” el sistema inmunitario.
El trasplante alogénico de médula ósea cumplió 60 años el año pasado. En aquella época (1957), E. Donnall Thomas y sus colegas obtuvieron células de médula ósea de las costillas de cadáveres adultos o fetales, las filtraron, las suspendieron en medio de cultivo, las congelaron a -80°C y posteriormente las infundieron en pacientes irradiados. En una parte de los pacientes se pudo detectar un crecimiento pasivo de las células del donante, pero todos murieron en los primeros 100 días tras el trasplante. Aunque mucho ha cambiado desde entonces, el trasplante alogénico de células madre (allo-SCT, mediante transferencia de médula ósea, sangre periférica movilizada o sangre de cordón umbilical) sigue siendo un tratamiento complejo, intensivo y complicado. A la vista de las nuevas sustancias dirigidas y las inmunoterapias, algunos expertos postulan que el TCM alogénico ha superado su cenit y dejará de ser necesario para curar muchas enfermedades malignas del sistema sanguíneo y linfático en pocos años. Las cifras reales hablan en contra: la tendencia al aumento anual del número de trasplantes de células madre, tanto alogénicos como autólogos, se mantiene [1]. Este artículo ilustrará la evolución del trasplante de células madre en los últimos años con ejemplos seleccionados y aventurará una perspectiva de futuro.
Selección y disponibilidad de donantes
Los primeros trasplantes alogénicos de médula ósea tuvieron lugar antes del descubrimiento de los antígenos leucocitarios humanos (HLA). En los años 60, los conocimientos seguían limitándose esencialmente a las observaciones de que la sangre o los leucocitos de determinados pacientes reaccionaban entre sí y de que era posible una “sensibilización del sistema inmunitario”. En la década de 1970, R. Zinkernagel y P. Doherty descubrieron el principio básico de la activación de las células T mediante la presentación de antígenos y la restricción HLA. No fue hasta finales de la década de 1980 cuando se presentó la estructura proteínica del HLA. Hoy en día se conocen dos clases de HLA, cada una con 7678 alelos de clase I y 2268 de clase II. Hoy en día, el alo-SCT se realiza teniendo en cuenta las características del HLA, ya que se sabe que los llamados “desajustes” en el HLA son la causa más fuerte de una reacción de rechazo inversa (enfermedad de injerto contra huésped, EICH). Además, también se sabe -aunque todavía no se ha aplicado en la clínica- que el nivel de expresión de ciertas variantes alélicas dispares del HLA puede asociarse con la gravedad de la EICH [2], y que ciertas variantes alélicas dispares pueden influir al mismo tiempo en la probabilidad de recurrencia de la enfermedad [3]. La consideración de estos “desajustes” permisivos (para la EICH o los efectos injerto contra leucemia, IVL) en la selección de donantes es bastante concebible en el futuro, en vista del creciente número de donantes registrados. Actualmente hay más de 32 millones de donantes de células madre registrados en todo el mundo (123 471 en Suiza a fecha de 12.08.2018 y >8 millones en Alemania, www.wmda.info), lo que significa que a pesar de la disminución del tamaño de las familias y del número de hermanos, se puede encontrar un donante no emparentado HLA-idéntico para más del 70% de los pacientes de ascendencia caucásica. Para otros grupos étnicos, sin embargo, esta probabilidad es significativamente menor [4], y las personas de ascendencia étnica mixta suelen tener pocas posibilidades de encontrar con éxito un donante no emparentado.
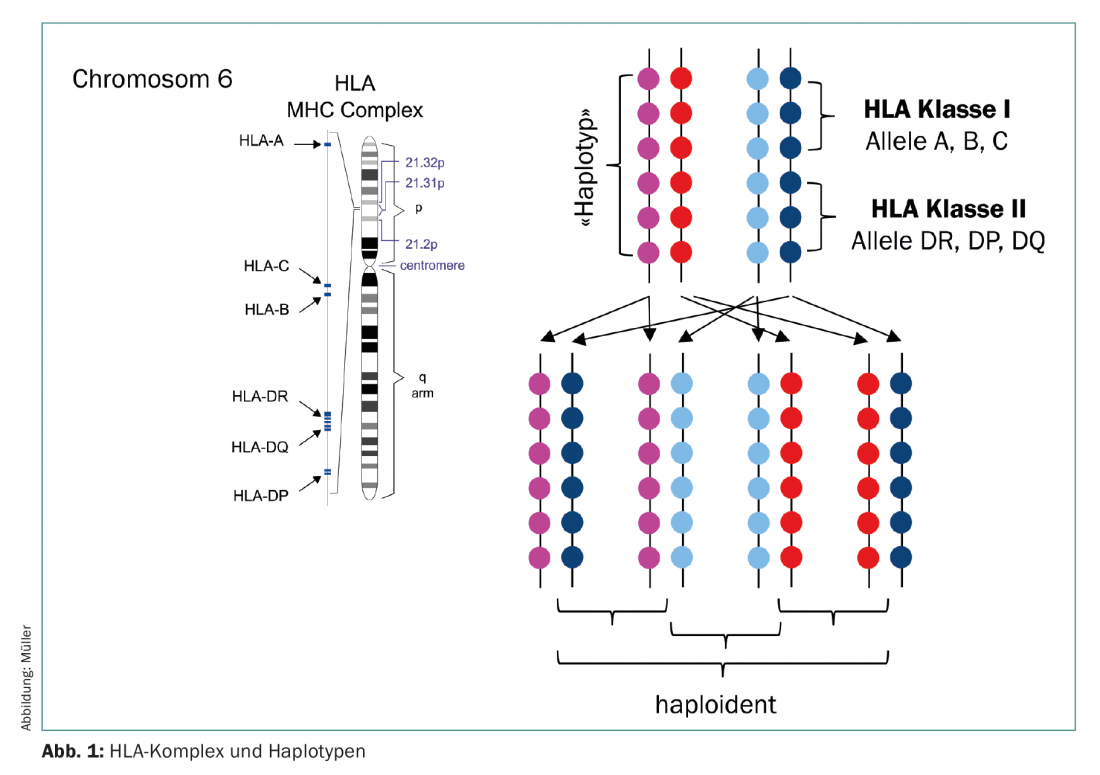
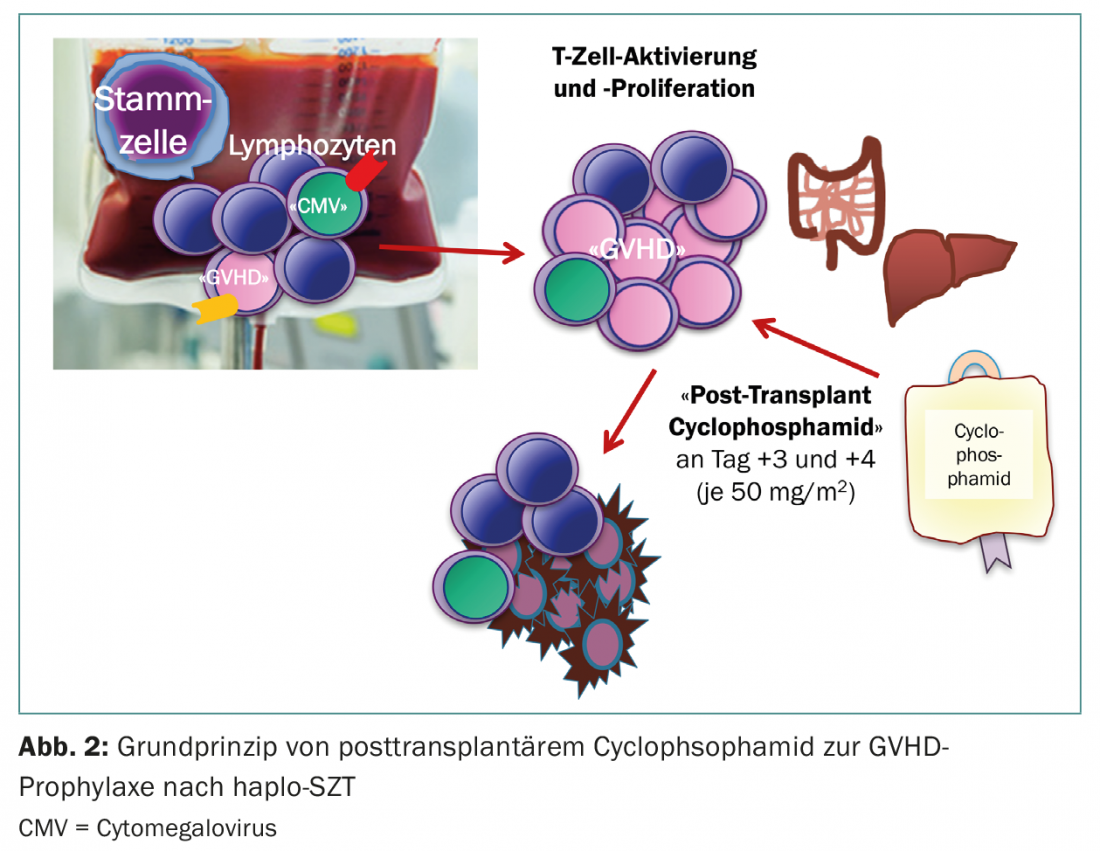
Una fuente alternativa de células madre son los donantes haploidénticos (semiamparejados) (Fig. 1) . Hasta hace unos años, los trasplantes haploidénticos se utilizaban con la misma reticencia que los de cordón umbilical, ya que ambos se asociaban a un alto riesgo de complicaciones graves. Sin embargo, desde aproximadamente 2012, el haplo-SCT ha ido ganando popularidad como una nueva maniobra terapéutica que ha entrado en la clínica. El grupo dirigido por E. Fuchs y L. Luznik desarrolló un régimen de acondicionamiento en el que la médula ósea no manipulada de donantes haploidénticos con un contenido total de células T se infunde en pacientes sin inmunosupresión concomitante. Se sabe que en los primeros días tras el trasplante, debido a la linfopenia del receptor, se produce una proliferación y expansión masiva de linfocitos (expansión homeostática). Aquí proliferan principalmente los linfocitos activados, es decir, las células que han encontrado su antígeno diana en los tejidos receptores y que, en consecuencia, provocarían una EICH aguda. En este supuesto, se administran dosis altas de ciclofosfamida los días 3 y 4 después de la haplo-SZT, lo que a su vez mata a los linfocitos que se están dividiendo. Los linfocitos en reposo, por el contrario, quedan a salvo, al igual que las propias células madre, por lo que la regeneración hematopoyética tiene lugar sin restricciones (Fig. 2) [5,6]. El éxito de este régimen está ahora demostrado, tanto en estudios como en la práctica clínica [7,8]. Puesto que los padres y los hijos están seguros, y los hermanos tienen una probabilidad del 50% de ser haploidénticos, ahora puede identificarse un donante para casi todos los pacientes, incluso para aquellos cuyo origen étnico no está suficientemente representado en el registro, o en países en los que no puede financiarse una costosa donación externa.
Acondicionamiento, efectos secundarios y mortalidad
Hay menos noticias en el ámbito del acondicionamiento y sus complicaciones. Al comprender que el trasplante alogénico es una inmunoterapia y que no es tanto la quimioterapia de acondicionamiento como la alorreactividad de las células T dirigida contra las células malignas lo que puede lograr un control inmunológico a largo plazo de la neoplasia subyacente, se redujo la intensidad de la quimioterapia preparatoria (“acondicionamiento de intensidad reducida”, RIC), lo que redujo significativamente su toxicidad y mortalidad. Como resultado, el trasplante alogénico es ahora también accesible para pacientes de edad avanzada y con comorbilidades. Esto se refleja claramente en las cifras de trasplantes, ya que las neoplasias mieloides en particular son enfermedades de edad avanzada. El acondicionamiento RIC se ha ganado un lugar permanente en la clínica en los últimos 10-15 años y ahora representa aproximadamente la mitad de los TSC alogénicos. La cuestión de si se producen más recaídas tras el CIR que tras el acondicionamiento mieloablativo (MAC) aún no se ha aclarado para todas las entidades patológicas y sigue siendo objeto de debate.
Un componente muy extendido de los regímenes de acondicionamiento tanto reducido como mieloablativo es ahora la globulina antitimocítica (ATG), que sirve como depleción in vivo de células T para la profilaxis de la EICH. Varios estudios han demostrado que la ATG no sólo puede reducir la tasa de EICH aguda, sino también la EICH crónica. Sin embargo, las experiencias relativas a la probabilidad de recidiva tras el TCS son contrarias, por lo que la ATG se utiliza con más precaución en EE.UU. que en Europa.
Se asocia una menor EICH crónica (pero no aguda) con el uso de médula ósea (MO) en lugar de sangre periférica movilizada como fuente de células madre [9], lo que se atribuye al menor contenido de células T de la médula ósea. Sin embargo, debido a los gastos significativamente más elevados para el donante y el centro de recogida, actualmente parece poco probable que el número de trasplantes de BM a expensas de los trasplantes de células madre de sangre periférica gane en importancia en un futuro próximo.
En la EICH establecida, dos “nuevas” sustancias prometedoras se encuentran actualmente en ensayos clínicos: por un lado, el inhibidor JAK1/2 ruxolitinib, que también puede inhibir la actividad de las células T a través de las vías de señalización STAT [10], por otro, el ibrutinib ha sido aprobado en EE.UU. para el tratamiento de la EICH crónica. El ibrutinib es un inhibidor irreversible de molécula pequeña de la tirosina quinasa Bruton y de la quinasa inducible por interleucina 2 (ITK). Esta última quinasa está implicada de forma significativa en la activación de las células T y, por tanto, en el desarrollo de la alorreactividad y la EICH [11].
Nuevas estrategias terapéuticas celulares contra las recidivas
La supervivencia global tras un TCM alogénico ha mejorado significativamente en las últimas dos o tres décadas. La mortalidad asociada a la terapia ha descendido significativamente debido a la mejora de los agentes antimicrobianos (especialmente los antifúngicos y antivirales). Sin embargo, a pesar de todos los avances, la tasa de recurrencia tras el TCM alogénico no ha mejorado, lo que en última instancia conduce a la muerte en más del 25% de los pacientes [12]. Los enfoques para prevenir las recurrencias postrasplante en el futuro incluyen las siguientes consideraciones: El efecto del TCM alogénico y su superioridad sobre la quimioterapia de dosis alta con transfusión autóloga de células madre (TCM autólogo) se basan en el efecto GVL. Esto puede ser duradero y proteger contra la reaparición de la enfermedad, pero requiere cierto tiempo para “establecerse”. En las leucemias agresivas en particular, a menudo se produce una renovación de la actividad de la enfermedad muy pronto tras el TCM alogénico, incluso antes de que pueda producirse un efecto de VG. Por este motivo, se están probando estrategias que prevén la continuación profiláctica de la terapia farmacológica poco después del TCM alogénico, por ejemplo con sustancias hipometilantes, y combinarlas con linfocitos del donante, si es necesario, con el fin de controlar la enfermedad hasta que se establezca un efecto GVL suficiente.
Una estrategia alternativa para curar las neoplasias inmunológicamente o mediante la actividad de las células T es la manipulación genética de las células T para convertirlas en las denominadas células T quiméricas receptoras de antígenos (CAR-T) (Fig. 3). Para las neoplasias linfoproliferativas CD19-positivas, ya se dispone clínicamente de células CAR-T comerciales, pronto también en Suiza. Estas células CAR-T modificadas reconocen su antígeno diana con la sensibilidad de un anticuerpo, independientemente del CMH, y actúan con la eficacia potenciada de una célula T [13,14]. A diferencia de las transferencias celulares convencionales de células T frescas o expandidas in vitro, incluso pequeñas cantidades de estas células CAR-T modificadas genéticamente son capaces de producir respuestas inmunitarias masivas. La desventaja es que las células CAR-T sólo pueden desarrollarse contra antígenos tumorales conocidos y “exclusivos” o que los inevitables daños colaterales a las células sanas deben ser tolerables. En el caso de las células CAR-T dirigidas a CD19 para linfomas agresivos y leucemia linfoblástica B aguda, también se eliminan inevitablemente las células B sanas. La consecuencia es la hipogammaglobulinemia, que puede sustituirse de forma pragmática desde el punto de vista clínico. La situación es más compleja en el caso de la leucemia mieloide aguda, por ejemplo. La célula madre leucémica no puede distinguirse fenotípicamente con claridad de la célula madre sanguínea sana. La inmunoterapia dirigida contra la célula madre leucémica requiere, por tanto, células CAR-T modificadas e innovadoras que, o bien tengan una vida corta segura (y, sin embargo, ejerzan su función efectora con la suficiente fuerza y selectividad), o bien puedan eliminarse de nuevo de forma selectiva. Es de esperar que se produzcan graves daños colaterales en la célula madre hematopoyética sana con una aplasia prolongada, por lo que es posible que estas terapias sólo sean clínicamente viables con el concepto de seguimiento de la TCS.
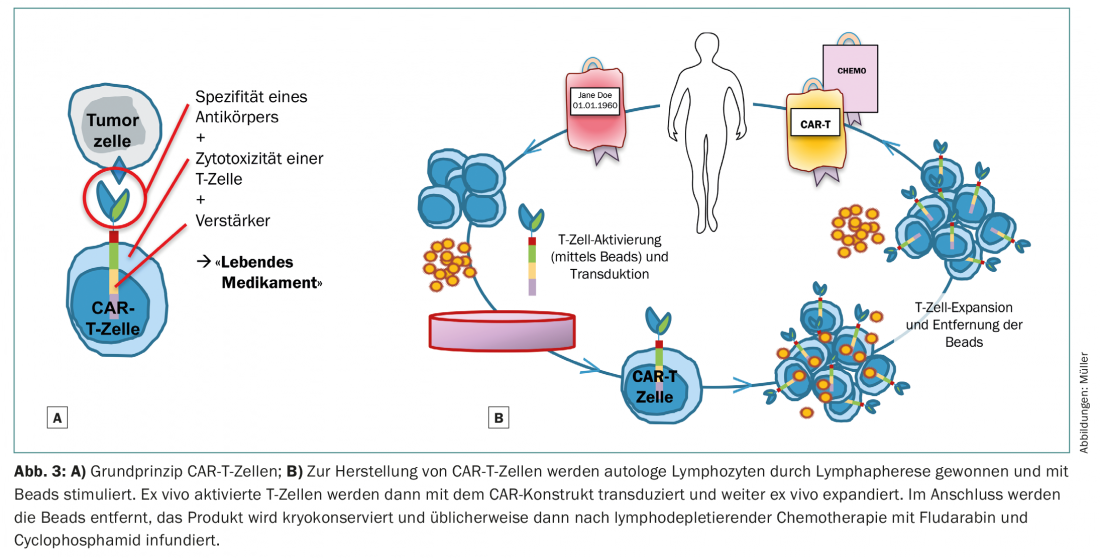
Aún no está al alcance de la mano que las terapias con células CAR-T sustituyan por completo al alo-SCT en un futuro próximo. Sin embargo, para unas pocas entidades como los linfomas agresivos de células B y posiblemente también los mielomas, parece concebible que las terapias con células CAR-T puedan ser superiores tanto al TSC autólogo como al alogénico.
Autolog – nuevo en viejos caminos
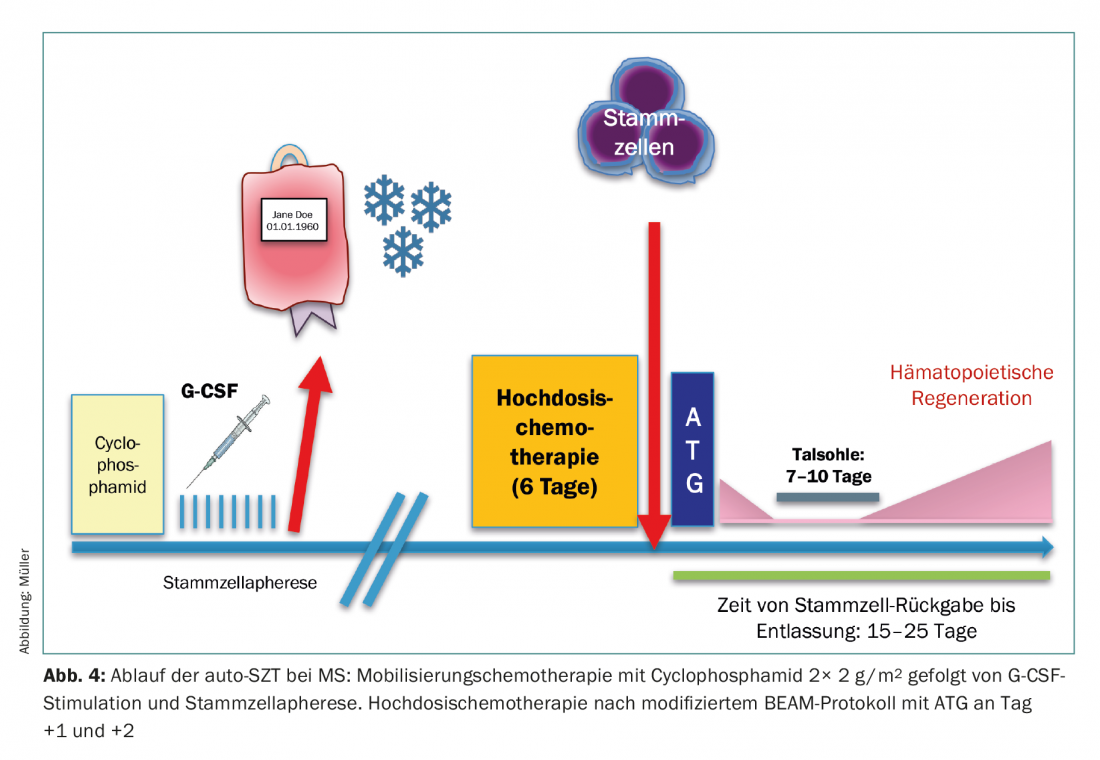
El uso del auto-TCP se está ampliando actualmente en el Hospital Universitario de Zúrich en forma de estudio de registro para pacientes con esclerosis múltiple (EM). La movilización de las células madre se lleva a cabo mediante la ciclofosfamida, fuertemente linfodepletora, con el fin de mantener la contaminación linfocitaria del aféresis lo más baja posible. Tras la quimioterapia de dosis alta, se realiza una nueva depleción de células T in vivo tras el trasplante utilizando ATG (día 1 y 2) para eliminar las células T residuales. Tras la erradicación completa del sistema hematopoyético y linfático, se produce el “reinicio” a partir de la célula madre sanguínea (Fig.4). Se dispone de datos biológicos sobre la eficacia de este principio en forma de numerosas observaciones bien fundadas en modelos preclínicos, pero también en estudios clínicos de fase II, que han podido demostrar que esta maniobra terapéutica puede detener por completo la progresión de la EM en muchos casos [15,16].
¿Se convertirá el trasplante clásico de células madre en una forma superflua de tratamiento en un futuro próximo? Ciertamente no por el momento – pero es de esperar que el campo avance en la dirección de terapias celulares innovadoras, hechas a medida, que tengan menos efectos secundarios o que sean mejor controlables, de menor duración y que ataquen más eficazmente a las células tumorales en lugar de al tejido sano.
Mensajes para llevarse a casa
- A pesar de las nuevas sustancias dirigidas e inmunoterapias, el número de trasplantes de células madre realizados cada año sigue aumentando de forma constante.
- El aumento del número de donantes voluntarios registrados y los regímenes de acondicionamiento de intensidad reducida permiten ahora el acceso al trasplante alogénico de células madre a una población de pacientes significativamente mayor.
- Las recurrencias tras el trasplante alogénico de células madre siguen siendo la principal causa de muerte y requieren nuevas estrategias para la profilaxis de las recurrencias y el refuerzo de los efectos del injerto contra la leucemia.
- Las células T receptoras de antígenos quiméricos son la forma más moderna de terapia celular, pero actualmente sólo se utilizan clínicamente para unas pocas entidades patológicas.
- Los trasplantes autólogos de células madre no sólo se utilizan en el tratamiento de enfermedades hematológicas malignas, sino que
- también puede detener el curso de las enfermedades autoinmunes reiniciando el sistema inmunitario.
Literatura:
- Passweg JR, et al: ¿Se está estabilizando el uso de trasplantes de donantes no emparentados en Europa? Informe de la encuesta de actividad de la Sociedad Europea de Trasplante de Sangre y Médula Ósea de 2016. Trasplante de médula ósea 2018. DOI: 10.1038/s41409-018-0153-1 [Epub ahead of print].
- Petersdorf EW, et al: Alta expresión de HLA-DP y enfermedad de injerto contra huésped. N Engl J Med 2015; 373(7): 599-609.
- Venstrom JM, et al: Prevención dependiente del HLA-C de la recaída de la leucemia mediante la activación del donante KIR2DS1. N Engl J Med 2012; 367(9): 805-816.
- Gragert L, et al: Probabilidades de compatibilidad HLA para injertos de células madre hematopoyéticas en el registro estadounidense. N Engl J Med 2014; 371(4): 339-348.
- Robinson TM, et al: Trasplante haploidéntico de médula ósea y células madre: experiencia con ciclofosfamida postrasplante. Semin Hematol 2016; 53(2): 90-97.
- Luznik L, O’Donnell PV, Fuchs EJ: Ciclofosfamida postrasplante para la inducción de tolerancia en el trasplante de médula ósea HLA-haploidéntico. Semin Oncol 2012; 39(6): 683-693.
- McCurdy SR, et al: Comparable composite endpoints after HLA-matched and HLA-haploidentical transplantation with post-transplantation cyclophosphamide. Haematologica 2017; 102(2): 391-400.
- Kasamon YL, et al: Estudio prospectivo del TMO no mieloablativo, no emparentado con HLA con dosis altas de ciclofosfamida postrasplante. Blood Adv 2017; 1(4): 288-292.
- Anasetti C, et al: Células madre de sangre periférica frente a médula ósea de donantes no emparentados. N Engl J Med 2012; 367(16): 1487-1496.
- Zeiser R, et al: Ruxolitinib en la enfermedad de injerto contra huésped refractaria a los corticosteroides tras el trasplante alogénico de células madre: un estudio multicéntrico. Leucemia 2015; 29(10): 2062-2068.
- Miklos D, et al: Ibrutinib para la enfermedad crónica de injerto contra huésped tras el fracaso de una terapia previa. Sangre 2017; 130(21): 2243-2250.
- Appelbaum FR: Mejora de los resultados con el trasplante alogénico de células hematopoyéticas. Best Pract Res Clin Haematol 2012; 25(4): 465-471.
- Dai H, et al: Células T modificadas con receptores de antígenos quiméricos para la terapia del cáncer. J Natl Cancer Inst 2016; 108(7).
- Curran KJ, Pegram HJ, Brentjens RJ: Receptores quiméricos de antígenos para la inmunoterapia de células T: conocimientos actuales y orientaciones futuras. J Gene Med 2012; 14(6): 405-415.
- Muraro PA, et al: Resultados a largo plazo tras el trasplante autólogo de células madre hematopoyéticas para la esclerosis múltiple. JAMA Neurol 2017; 74(4): 459-469.
- Mancardi GL, et al: Trasplante autólogo de células madre hematopoyéticas en la esclerosis múltiple: un ensayo de fase II. Neurología 2015; 84(10): 981-988.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2018; 6(5): 26-30.











