Si la colonización por biopelículas persiste en las heridas crónicas a pesar del mejor tratamiento posible de la enfermedad subyacente, la cicatrización de la herida se estancará. El desbridamiento mecánico es muy importante, pero no es suficiente como única medida y en algunos casos tampoco es práctico. Para que las soluciones antimicrobianas de irrigación de heridas y los apósitos sean eficaces contra la biopelícula, es fundamental que logren penetrar en la sustancia polimérica extracelular. En consecuencia, la eficacia de los distintos preparados varía.
Las heridas que siguen abiertas después de 30 días se consideran crónicas, independientemente de su causa, y son propensas a la infección debido a una serie de factores [1]. Así, el entorno cálido y húmedo de la herida es un caldo de cultivo ideal para bacterias y hongos, y el retraso en el cierre de la herida aumenta el riesgo de exposición continua a patógenos con el riesgo de formación de biopelículas. Con motivo del Congreso de Heridas de este año en Núremberg, la Prof. Dra. med. Ewa Klara Stürmer, Directora Médica del Centro Integral de Heridas y Jefa de Investigación Traslacional de Heridas del Centro Médico Universitario de Hamburgo-Eppendorf, habló sobre la práctica clínica y los nuevos hallazgos en el tratamiento de la biopelícula de heridas [2].

El biofilm se encuentra en más de tres cuartas partes de todas las heridas crónicas
Una biopelícula se desarrolla cuando la colonización bacteriana en la herida da lugar a colonias o asociaciones bacterianas en las que las bacterias maduran y se propagan (recuadro) [16]. Según un metaanálisis, alrededor del 78% de todas las heridas crónicas están colonizadas por microorganismos patógenos en forma de biopelículas [3]. El biofilm de la herida proporciona una respuesta inmunitaria o inflamación duradera, más o menos pronunciada localmente [4]. Si la biopelícula no se rompe y elimina, la cicatrización de la herida se estanca, lo que da lugar a la persistencia de la cronicidad de una herida – a pesar del mejor tratamiento posible de la enfermedad subyacente [2,4,5]. Las principales especies bacterianas en las biopelículas de heridas, tomando como ejemplo las úlceras de las piernas, son (Resumen 1): Staphylococcus aureus, su variante resistente a la meticilina (SARM), Pseudomonas aeruginosa, Enterobacteriaceae y Proteus mirabilis [6].

La sustancia polimérica extracelular como punto de adherencia crítico
La comunidad simbiótica e interespecífica de microorganismos de la que se forman las biopelículas produce una sustancia polimérica extracelular (EPS) en la que se “amurallan” [2,4]. El EPS se compone esencialmente de polisacáridos, así como de una variedad de proteínas, lípidos, glicoproteínas y glicolípidos, lo que hace que se adhiera firmemente al lecho de la herida [7]. Esta mezcla de azúcar y proteínas representa un “escudo protector” bacteriano contra los antisépticos y los antibióticos [2]. Después de 2-4 días, se habla de “biopelícula madura”. Un biofilm o una fuerte colonización bacteriana de la herida pueden hacerse visibles al ojo humano con luz ultravioleta cercana (por ejemplo, MolecuLight®, MolecuLight Corp., Toronto, Canadá) [4].
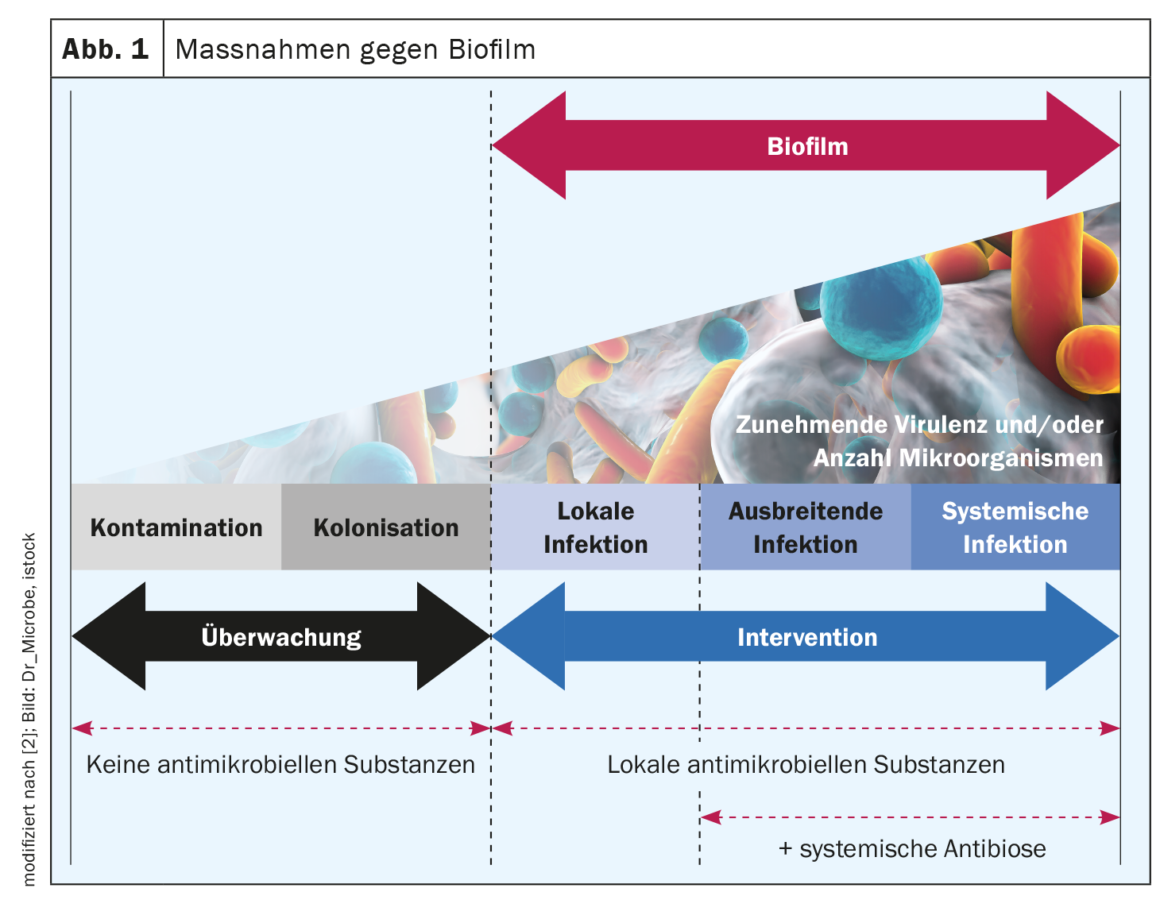
Eficacia de las irrigaciones y apósitos antimicrobianos para heridas
El desbridamiento mecánico es actualmente el único tratamiento para la biopelícula de la herida recomendado por consenso de expertos, pero, por un lado, el desbridamiento por sí solo no elimina toda la biopelícula y, por otro, no siempre es una opción viable en el entorno de la atención domiciliaria (por ejemplo, higiene limitada, pacientes anticoagulados terapéuticamente con medicación) [4,8]. Las soluciones antimicrobianas para la irrigación de heridas abordan y destruyen las paredes bacterianas, las membranas y las proteínas de transporte bacterianas o inhiben su función [4]. Si no consiguen atravesar el EPS -que funciona como una barrera bioquímica contra el sistema inmunitario del huésped y especialmente contra los agentes antimicrobianos- no pueden actuar eficazmente. En consecuencia, la eficacia de las distintas soluciones de irrigación de heridas contra las biopelículas bacterianas varía [4]. Las pruebas traslacionales sistemáticas realizadas con el modelo de biopelícula humana hpBIOM demuestran que Octenisept® es capaz de escindir las biopelículas y eliminar las bacterias que contienen en un plazo de 72 h [4,9,10,17]. La PHMB tiene un éxito limitado en el mismo periodo, pero no se consigue una erradicación completa ni siquiera después de 72 horas. Las soluciones hipoclorosas de irrigación de heridas y la clorhexidina no consiguen eliminar eficazmente las bacterias en biopelícula [4,10].

En lo que respecta a la importancia de los apósitos para heridas, resulta algo difícil derivar recomendaciones terapéuticas diferenciadas a partir de la pequeña base de pruebas de estudios clínicos comparativos con apósitos para heridas (antimicrobianos), ya que no sólo varían las sustancias activas (iones de plata, plata nanocristalina, PHMB, derivados del yodo, etc.) y sus concentraciones, sino también la base respectiva de los apósitos para heridas (espuma de PU, alginatos, fibras, etc.). [4,11]. Pero múltiples pruebas in vitro con un modelo de biopelícula humana demostraron que un producto combinado de yodo y almidón (Cadexomer yodo) era capaz de erradicar por completo las bacterias de la biopelícula en seis días [2,4]. Otros apósitos para heridas que contenían PHMB o plata sólo redujeron la carga bacteriana [12]. Los análisis correspondientes se llevaron a cabo tras un periodo de seis días sin cambios de apósito y cabe suponer que se puede conseguir una mayor eficacia de todos los apósitos probados con cambios diarios o cada dos días [4].
El mecanismo de acción del producto combinado de yodo y almidón (Iodosorb™) se basa en las microesferas de Cadexomer, que destruyen la estructura de la biopelícula o la sustancia polimérica extracelular bacteriana por deshidratación como requisito previo para que el yodo elimine fácilmente las bacterias así expuestas en la biopelícula [12,18].
Congreso: Wound Congress Nuremberg
Literatura:
- Hunt S, Elg F: La eficacia clínica del aerosol de hemoglobina como terapia coadyuvante en el tratamiento de heridas crónicas. J Wound Care 2017; 26(9): 558-568.
- “Biofilm – Die Herausforderung des Jahrzehntes in der Wundversorgung – Wundbiofilm erkennen, verstehen und nachhaltig beseitigen”, Prof. Dr. med. Stürmer, Industriesymposium Smith & Nephew GmbH, Wundkongress Nürnberg, 1.12.2022.
- Malone M, et al: La prevalencia de las biopelículas en las heridas crónicas: una revisión sistemática y metaanálisis de los datos publicados. J Wound Care 2017; 26(1): 20-25.
- Stürmer EK, Rembe J-D: Reconocimiento y comprensión del biofilm de la herida: Posibilidades terapéuticas y sus límites. Formación continua CME, DERMATOLOGIE PRAXIS 2/2022, 6-11.
- James GA, et al: Biopelículas en heridas crónicas. Wound Repair Regen 2008; 16(1): 3-44.
- Jockenhofer F, et al.: Espectro bacteriológico patógeno de las úlceras crónicas de la pierna: Resultados de un ensayo multicéntrico en centros dermatológicos de atención de heridas diferenciados por regiones. J Dtsch Dermatol Ges 2013; 11(11): 1057-1063.
- Flemming HC, Wingender J: La matriz de la biopelícula. Nat Rev Microbiol 2010; 8(9): 623-633.
- Schwartz JA, et al: El desbridamiento quirúrgico por sí solo no reduce adecuadamente la carga biológica planctónica en las heridas crónicas de las extremidades inferiores. J Wound Care. 2014 Sep; 23(9): S4, S6, S8 passim. doi: 10.12968/jowc.2014.23.Sup9.S4.
- Besser M, et al.: Eficacia de los antisépticos en un novedoso modelo tridimensional de biopelícula plasmática humana (hpBIOM). Sci Rep 2020; 10(1): 4792.
- Rembe JD, et al: Las soluciones antimicrobianas hipocloradas para la irrigación de heridas demuestran una menor eficacia antibiofilm contra la biopelícula bacteriana en un modelo in vitro complejo de biopelícula de plasma humano (hpBIOM) que los antimicrobianos comunes para heridas. Front Microbiol 2020; 11: 564513.
- Schwarzer S, et al: La eficacia de los agentes tópicos utilizados en heridas para el tratamiento de las infecciones crónicas por biopelículas: una revisión sistemática. J Infect 2020; 80(3): 261-270.
- Stuermer EK, et al: Actividad in vitro de los apósitos antimicrobianos sobre la biopelícula de heridas de P. aeruginosa. Front Microbiol 2021; 12: 664030.
- Stuermer EK, et al: Infiltración bacteriana en heridas colonizadas por biopelículas: análisis en el modelo de herida ex vivo hpBIOM y posible impacto en el hisopado y el desbridamiento. Int Wound J 2022 (en revisión)
- 14. “Principios del cuidado de heridas, técnicas de limpieza/desbridamiento de heridas”, www.bk-trier.de/media-bkt/docs/Bildung/Handouts-Wundmanagement/Basisseminar-Handouts/03_Debridement.pdf,(última consulta: 20.01.2023).
- Rembe JD, Stürmer EK: Antisepsia moderna de heridas: indicaciones y limitaciones, entre el conocimiento, el deseo y la incertidumbre. Cirugía vascular 2020; 25, 272-276.
- Percival SL, McCarty SM, Lipsky B: Biopelículas y heridas: una visión general de las pruebas. En: Advances in wound care 2015; 4(7): 373-381.
- Compendio suizo de medicamentos,
https://compendium.ch,(última consulta: 20.01.2023) - Apósito Iodosorb™, www.smith-nephew.com/switzerland/fachgebiete/wundmanagement/iodosorb-dressing,(última consulta: 20.01.2023).
DERMATOLOGIE PRAXIS 2023; 33(1): 32-33 (publicado el 16.2.23, antes de impresión).