Los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) son susceptibles a las infecciones pulmonares, que exacerban significativamente los síntomas (especialmente la disnea). Sin embargo, apenas se dispone de datos epidemiológicos.
Los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) son susceptibles a las infecciones pulmonares, que exacerban significativamente los síntomas, especialmente la disnea. Sin embargo, los datos epidemiológicos sobre esta EPOC exacerbada por infecciones (AECOPD) son escasos [1].
La EPOC (GOLD II-IV) tiene una prevalencia (>40 años) de aproximadamente el 5,9%. Cada uno de estos pacientes experimenta entre 0,6 y 2,7 exacerbaciones agudas al año [2]. El deterioro respiratorio agudo supone un importante riesgo de mortalidad para los pacientes con EPOC; alrededor del 10% de los pacientes con AECOPD que son hospitalizados fallecen. En la mayoría de los casos (aproximadamente el 60%), la AECOPD está desencadenada por infecciones, de las que aproximadamente la mitad son víricas y la otra mitad bacterianas. En aproximadamente el 30% de los casos no se encuentra ningún factor desencadenante. Es importante recordar que la inhalación de sustancias nocivas como la nicotina y los óxidos de nitrógeno pueden desencadenar una exacerbación.
Por supuesto, el deterioro respiratorio agudo también puede estar desencadenado por otros factores, por lo que los diagnósticos diferenciales pueden incluir la insuficiencia cardiaca, el neumotórax, el derrame pleural, los émbolos pulmonares o nuevas arritmias, además de la neumonía aguda [3]. En un estudio de 1016 pacientes, los motivos de ingreso hospitalario por sospecha de AECOPD fueron un 48% infecciones respiratorias, un 26% insuficiencia cardiaca, un 3% carcinoma bronquial, un 1% embolia pulmonar y un 1% neumotórax [4]. Las opciones terapéuticas durante la AECOPD no están actualmente estandarizadas y en algunos casos sólo son eficaces de forma limitada. Por lo tanto, la prevención de una exacerbación es de gran importancia.
Los pacientes con EPOC que sufren exacerbaciones repetidas ven reducida su calidad y esperanza de vida (alrededor del 10% de los pacientes con AECOPD hospitalizados fallecen). La prevención de una exacerbación puede lograrse, por ejemplo, mediante micolíticos orales y broncodilatadores. Es interesante en este contexto que se reduzca la gravedad de una exacerbación, pero no la mortalidad [5]. A continuación se analizan las opciones de diagnóstico por imagen para la AECOPD. Sin embargo, uno de los puntos centrales será la evaluación del riesgo diagnóstico de AECOPD en pacientes con EPOC.
Imágenes
Los pacientes con EPOC, en particular, no pueden aguantar la respiración durante mucho tiempo y tienen dificultades para tumbarse boca arriba. Por lo tanto, para seguir obteniendo imágenes “nítidas” del tórax, la imagen debe tomarse lo más rápidamente posible. Dos modalidades de examen cumplen estos requisitos: los rayos X y la tomografía computarizada (TC). En el estudio PROVIDI se investigaron en detalle las posibilidades de la TC para predecir la AECOPD [6].
Radiografía de tórax
El examen radiológico inicial de un paciente con AECODP es una radiografía de tórax, a ser posible en posición de pie en 2 planos [2]. Puede utilizarse para descartar enfermedades de diagnóstico diferencial como la neumonía, el neumotórax, el derrame pleural o la insuficiencia cardiaca. En aproximadamente una quinta parte de los pacientes con presunta AECOPD, el diagnóstico cambia, principalmente por neumonía, y en consecuencia la terapia [3,7–9].
Las radiografías del tórax en pacientes con EPOC muestran cambios característicos en comparación con los individuos sanos. En particular, es evidente una marcada hiperinsuflación, con diafragmas bajos, agrandamiento del espacio retroesternal y de los espacios intercostales. La silueta cardiaca suele ser bastante estrecha y existe un patrón vascular pulmonar enrarecido. En el curso de una exacerbación infecciosa, a menudo se produce un engrosamiento de las paredes bronquiales, lo que conduce a una reducción significativa de la ventilación de las secciones pulmonares situadas periféricamente (Fig. 1).
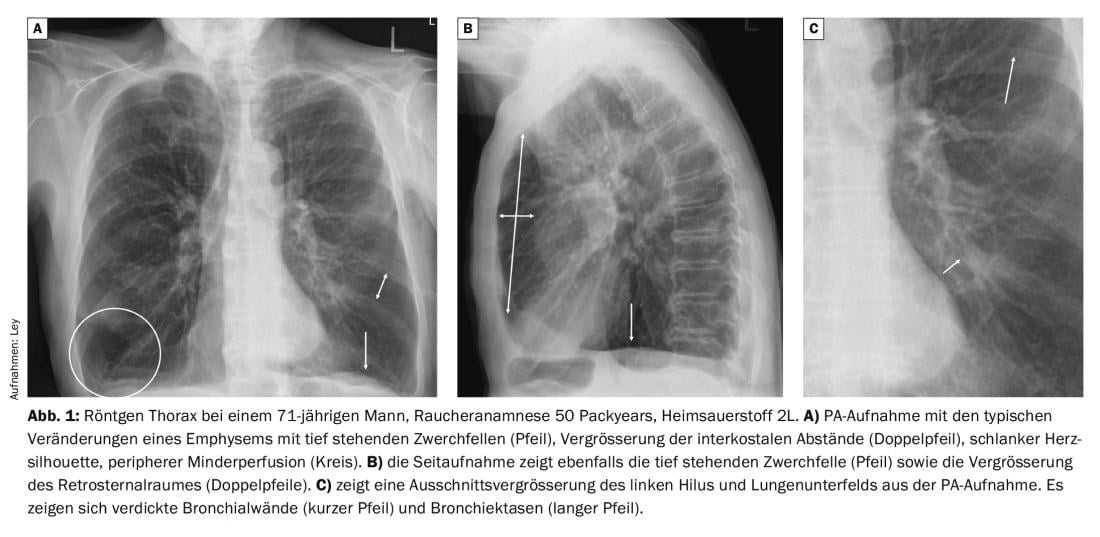
Como ya se ha mencionado anteriormente, los hallazgos relevantes como la neumonía se encuentran en alrededor del 20% de los pacientes. En el caso de una infección bacteriana típica, se observa una compresión bidimensional de un segmento, lóbulo o de todo el pulmón (Fig. 2).

Un estudio reciente de pacientes de AECOPD no hospitalizados mostró un infiltrado en el 20% de los casos [10]. Se han identificado muchos patógenos, por ejemplo Haemophilus y Streptococcus. Curiosamente, no hubo diferencias en la colonización pulmonar entre los pacientes con EPOC con exacerbación y los que no. Por otro lado, la neumonía fue más frecuente en los meses de invierno. Por lo tanto, se concluyó que las exacerbaciones y las neumonías en pacientes con EPOC comparten desencadenantes infecciosos comunes y representan un continuo en lugar de entidades separadas.
Tomografía computarizada (TC)
Se puede realizar una TC del tórax centrada en el parénquima pulmonar sin administración de contraste intravenoso. El ingreso en parada respiratoria es deseable, pero no siempre puede realizarse en pacientes con AECOPD. A veces, una posición supina plana en la mesa de exploración del TAC apenas es posible, y entonces aguantar la respiración durante 4-10 segundos (dependiendo del aparato de TAC) también supone un enorme reto para los pacientes. Cuando se trata de descartar una embolia de la arteria pulmonar, la administración i.v. de KM es indispensable. Las capas de 1 mm se han establecido como el grosor de capa para ambas cuestiones.
Los cambios fenotípicos de la EPOC pueden clasificarse en un fenotipo de enfisema y un fenotipo respiratorio [11]. La dilatación bronquial se produce cuando el lumen del bronquio es del 110-150% del lumen de la arteria pulmonar acompañante. Más del 150% se denomina ectasia. Además, en las bronquiectasias se observa una falta de estrechamiento hacia la periferia. Las bronquiectasias pueden tener una configuración cilíndrica, varicosa y quística.
La pared bronquial se evalúa en función de la relación entre el diámetro interior y el exterior: Si la relación es de 0,5-0,8, se denomina engrosamiento leve de la pared, <0,5 denota un engrosamiento grave de la pared. Además, los pacientes con EPOC con antecedentes de tabaquismo suelen tener los bronquios obstruidos por la mucosidad.
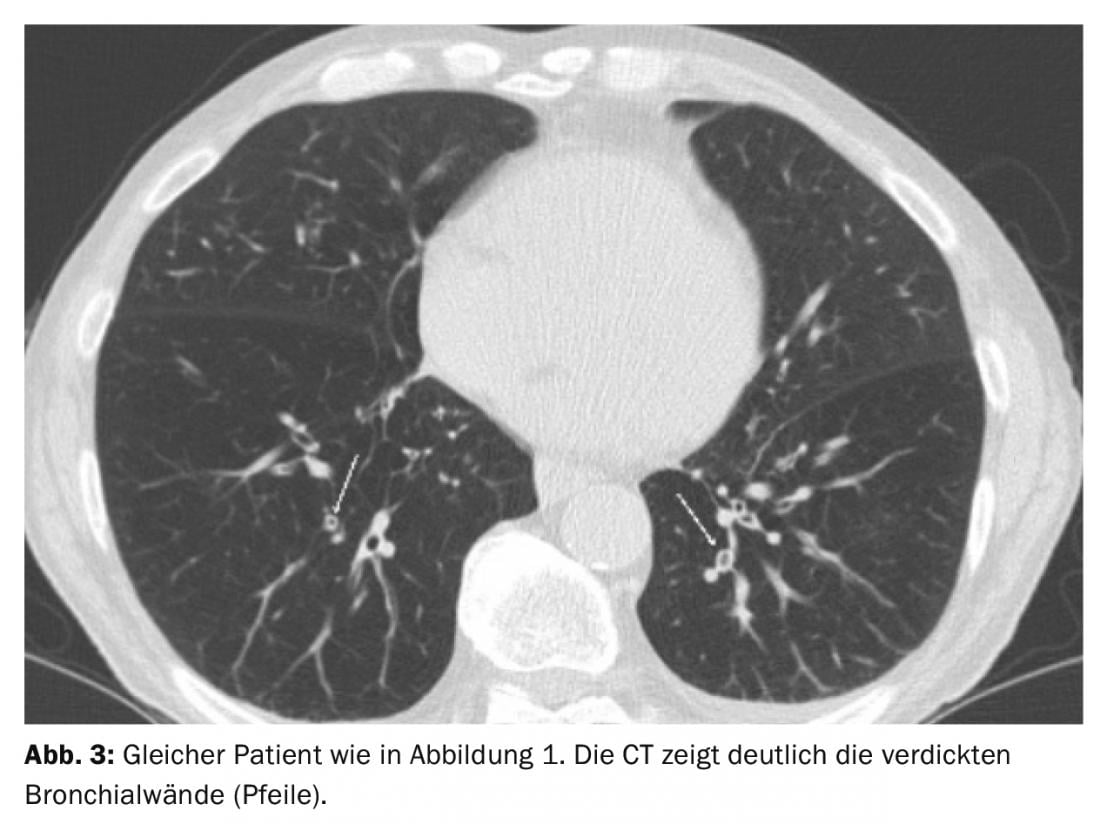
Los pacientes con un tipo de vía aérea parecen especialmente susceptibles a la AECOPD. La TC mostró que el engrosamiento de la pared bronquial era significativamente más frecuente en la AECOPD que en el intervalo “normal” (Fig. 3) [12]. Sin embargo, la concordancia entre lectores para la evaluación del engrosamiento de la pared bronquial es escasa.
Como se mencionó inicialmente, la prevención de una exacerbación es un objetivo importante. Para ello, hay que identificar a los pacientes con una mayor susceptibilidad a sufrir una exacerbación. El Estudio Genético de la EPOC identificó a 833 pacientes que tuvieron de 0 a 1 exacerbaciones y a 169 pacientes con más de 2 exacerbaciones [13]. Esto demostró que con cada mm de aumento del grosor de la pared bronquial a nivel de segmento, la tasa anual de exacerbación aumentaba en un factor de 1,84. Los pacientes con más de un 35% de enfisema mostraron un aumento de 1,18 veces en la tasa de exacerbación por cada aumento del 5% en el enfisema. Estos datos sugieren que el fenotipado rutinario de los pacientes con EPOC mediante TC es apropiado.
Además del grosor de la pared, la dilatación bronquial también es muy relevante para la exacerbación. Las bronquiectasias aumentaron significativamente el riesgo de exacerbación (odds ratio de 4,99) y fueron el factor predictivo más potente entre varios parámetros (Fig. 4) [14]. La detección o el conocimiento de bronquiectasias también tiene una clara relevancia terapéutica, ya que, por ejemplo, la antibiosis i.v. para P. aeroginosa puede estar indicada si hay bronquiectasias [1]. La colonización bacteriana en estas bronquiectasias durante la exacerbación suele sugerir la presencia de patógenos atípicos, especialmente micobacterias. Aquí se demostró que las micobacterias se detectaban con mayor frecuencia en pacientes con exacerbaciones poco frecuentes de EPOC que en pacientes con exacerbaciones frecuentes [14].

Además de las vías respiratorias periféricas, las vías respiratorias centrales, tráquea y bronquios principales, también desempeñan un papel importante en la limitación del flujo aéreo. Los pacientes con EPOC crean una presión negativa importante en la tráquea y los bronquios principales durante la inspiración. Dos factores (individualmente o juntos) provocan el colapso espiratorio central de las vías respiratorias (ECAC) [15].
Con el tiempo, los cartílagos ortopédicos pueden reblandecerse, dando lugar a la malacia. Dicha traqueobroncomalacia tiene una prevalencia del 5-10% en pacientes con EPOC [16]. Además, hay un aumento de la curvatura de la pars membranacea. Si esto conduce a una reducción del lumen de >50%, se habla de un “colapso dinámico excesivo de las vías respiratorias” (EDAC) (Fig. 5).
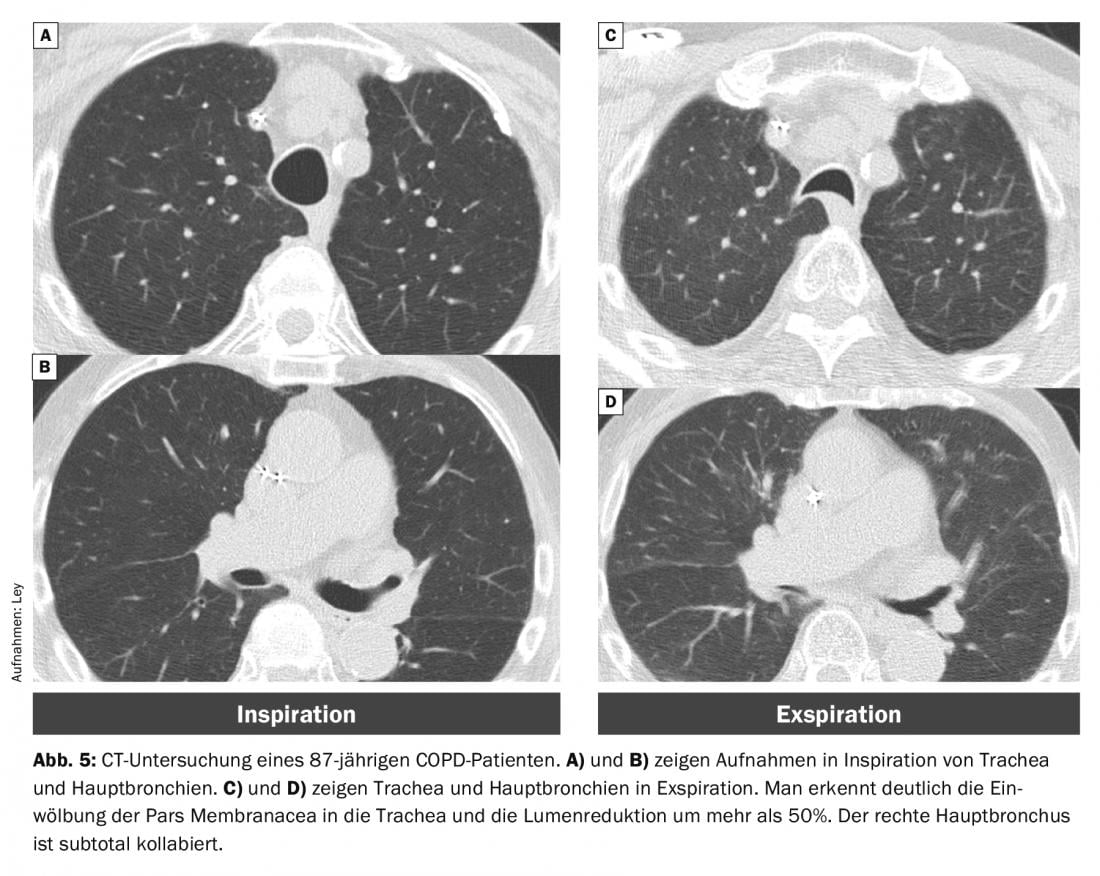
Es bien sabido que los pacientes con EPOC muestran un colapso respiratorio significativamente mayor que los pacientes normales. Sin embargo, esto no desempeña un papel relevante en la génesis de una exacerbación, ya que la inestabilidad de las vías respiratorias no difiere entre la EPOC estable y la exacerbada [15].
Sin embargo, también parece existir una correlación entre la gravedad del enfisema y las exacerbaciones [17]. Los pacientes fueron reclutados de una población de cribado de cáncer de pulmón. Se determinó el fenotipo de EPOC de tipo enfisema o no enfisema. Los pacientes con fenotipo de enfisema presentaban una enfermedad significativamente más grave (FEV1 predicho: 61% frente a 90%) que los pacientes con EPOC sin enfisema. Por lo tanto, no es realmente sorprendente que las exacerbaciones fueran más frecuentes en el grupo de pacientes más gravemente enfermos que en la población casi sana.
Un efecto global es la ventilación de las regiones pulmonares individuales. El helio hiperpolarizado puede utilizarse para visualizar la ventilación regional en la resonancia magnética (RM). Los defectos de ventilación se encuentran regularmente en pacientes con EPOC. En pacientes con EPOC de leve a moderada, la extensión de los defectos de ventilación se correlacionó con el número de exacerbaciones [18]. Los defectos de ventilación volvieron a correlacionarse con la extensión de la destrucción parenquimatosa (enfisema) y la enfermedad de las vías respiratorias, es decir, un fenotipo mixto de EPOC. Dado que los exámenes de resonancia magnética de la ventilación sólo pueden realizarse en centros individuales de todo el mundo y que la evaluación del parénquima pulmonar/vías respiratorias es limitada, se crearon mapas de ventilación mediante TC. Para ello, se examinaron conjuntos de datos de TC inspiratorios y espiratorios de la cohorte COPD Gene [19]. Utilizando un registro no rígido, se superpusieron los datos. De este modo, se podrían elaborar mapas regionales de deformación. Sorprendentemente, los pacientes con más exacerbaciones (≥6/año) tenían una ventilación más homogénea que los pacientes sin exacerbaciones.
Los conjuntos de datos de TC también ofrecen la posibilidad de segmentar estructuras anatómicas, por ejemplo las vías respiratorias, gracias a su alta resolución espacial. Estos datos segmentados pueden utilizarse después, por ejemplo, para simular flujos respiratorios y resistencias regionales. 42 pacientes con EPOC fueron examinados mediante TC durante una exacerbación y de 6 a 8 semanas en el curso [20]. Las vías respiratorias se segmentaron a partir de los datos del TAC y se utilizaron para simular los flujos de las vías respiratorias. Esto demostró que durante una exacerbación se produce un aumento significativo de la resistencia central y periférica de las vías respiratorias. Fue interesante que especialmente la disminución de la resistencia periférica de las vías respiratorias se asociara con la recuperación funcional. Por lo tanto, la inflamación excesiva de las vías respiratorias periféricas parece ser un factor crucial en el desarrollo de una exacerbación (se estudiaron las vías respiratorias de 4ª-8ª generación bronquial). Es decir, estas regiones deben alcanzarse terapéuticamente, pero dado que los flujos respiratorios se alteran significativamente durante una exacerbación, deben administrarse medicamentos orales o agentes inhalados de diámetro extrapequeño.
Excursus Hipertensión pulmonar
Se sabe que la EPOC no sólo afecta a las pequeñas vías respiratorias y los alvéolos, sino también a las pequeñas arterias pulmonares (diámetro <500 µm). Estos cambios vasculares también se encuentran en pacientes con EPOC moderada y en fumadores con una función pulmonar normal. Por lo tanto, cabe esperar que la vasculopatía se produzca en las primeras fases de la enfermedad respiratoria asociada al tabaquismo. Aproximadamente el 4% de los pacientes con EPOC padecen hipertensión pulmonar (HP), la EPOC-HP está incluida en el grupo 3 de la clasificación de la OMS de la HP [21]. En un amplio estudio con más de 54.000 participantes, la PH-COPD fue un factor de riesgo significativo para el tratamiento hospitalario de la AECOPD y la mortalidad. Por otro lado, un estudio ecocardiográfico mostró el efecto de la exacerbación en la función cardiaca derecha: Durante la exacerbación la PASP estimada fue de 40 mmHg y tras la convalecencia de 29 mmHg [22]. Sin embargo, la ecocardiografía resulta a veces difícil a la hora de evaluar la PASP en pacientes con EPOC, y el estándar de referencia, el cateterismo cardiaco derecho invasivo, no puede realizarse en todos los pacientes con EPOC. Una vez más, la TC ayuda con una sencilla medición: una relación entre el diámetro de la arteria pulmonar y la aorta ascendente >1:1 se asoció claramente con la aparición de AECOPD (odds ratio 4,78) (Fig. 6) [23]. Concretamente, los pacientes del estudio genético de la EPOC con una relación PA:A >1 sufrieron una exacerbación en el 53% de los casos. El diámetro de la arteria pulmonar puede determinarse en cortes axiales, justo antes de la bifurcación [24].

Mensajes para llevarse a casa
- Si se sospecha una EPOC exacerbada, la radiografía de tórax es un método importante para identificar diagnósticos diferenciales.
- La evaluación del estado y la caracterización de la EPOC mediante tomografía computarizada es una investigación útil para determinar el riesgo individual de exacerbación.
- Los pacientes con un fenotipo de EPOC en las vías respiratorias (engrosamiento de la pared y dilatación bronquial) son especialmente propensos a la exacerbación.
Literatura:
- Hoffken G, Lorenz J, Kern W, et al: (2005) [S3-guideline on ambulant acquired pneumonia and deep airway infections]. Neumología 59: 612-664.
- Lange CG, Scheuerer B, Zabel P: (2004) [Acute exacerbation of COPD]. Internist (Berl) 45: 527-538.
- McCrory DC, Brown C, Gelfand SE, Bach PB: (2001) Tratamiento de las exacerbaciones agudas de la EPOC: resumen y valoración de las pruebas publicadas. Tórax 119: 1190-1209.
- Connors AF, Jr, Dawson NV, Thomas C, et al: (1996) Resultados tras la exacerbación aguda de la enfermedad pulmonar obstructiva crónica grave. El estudio de los investigadores SUPPORT para comprender los pronósticos y las preferencias por los resultados y los riesgos de los tratamientos). Am J Respir Crit Care Med 154: 959-967
- Wedzicha JA, Calverley PMA, Albert RK, et al: (2017) Prevención de las exacerbaciones de la EPOC: una directriz de la Sociedad Respiratoria Europea/Sociedad Americana del Tórax. Eur Respir J 50.
- Jairam PM, van der Graaf Y, Lammers JW, et al: (2015) Los hallazgos incidentales en la TC torácica se asocian a un aumento de las exacerbaciones de la EPOC y de la mortalidad. Tórax 70: 725-731.
- Emerman CL, Cydulka RK: (1993) Evaluación de criterios de alto rendimiento para la radiografía de tórax en la exacerbación aguda de la enfermedad pulmonar obstructiva crónica. Ann Emerg Med 22: 680-684
- Snow V, Lascher S, Mottur-Pilson C: (2001) The evidence base for management of acute exacerbations of COPD: clinical practice guideline, part 1. Chest 119: 1185-1189.
- Soto FJ, Varkey B: (2003) Enfoque basado en la evidencia de las exacerbaciones agudas de la EPOC. Curr Opin Pulm Med 9:117-124
- Williams NP, Ostridge K, Devaster JM, et al: (2018) Impacto de las exacerbaciones estratificadas radiológicamente: perspectivas sobre la etiología de la neumonía en la EPOC. Respir Res 19: 143.
- Lynch DA, Austin JH, Hogg JC et al (2015) Subtipos definibles por TC de enfermedad pulmonar obstructiva crónica: una declaración de la Sociedad Fleischner. Radiología. 10.1148/radiol.2015141579:141579
- Hackx M, Ghaye B, Coche E, et al: (2015) Exacerbación grave de EPOC: características de la TC. Copd 12: 38-45.
- Han MK, Kazerooni EA, Lynch DA, et al: (2011) Exacerbaciones de la enfermedad pulmonar obstructiva crónica en el estudio COPDGene: fenotipos radiológicos asociados. Radiología 261: 274-282.
- Kawamatawong T, Onnipa J, Suwatanapongched T (2018) Relación entre la presencia de bronquiectasias y la exacerbación aguda en pacientes tailandeses con EPOC. Int J Chron Obstruct Pulmon Dis 13: 761-769
- Leong P, Tran A, Rangaswamy J, et al: (2017) Colapso espiratorio central de las vías respiratorias en la EPOC estable y durante las exacerbaciones. Respir Res 18:163
- Patel R, Irugulapati L, Patel V, et al: (2009) La prevalencia de la traqueobroncomalacia en pacientes con asma o enfermedad pulmonar obstructiva crónica. Revista de Medicina Pulmonar en Internet 12: 1-5.
- Barros MC, Hochhegger B, Altmayer S, et al: (2018) Fenotipos de tomografía computarizada cuantitativa, parámetros espirométricos y episodios de exacerbación en fumadores empedernidos: Un análisis de Sudamérica. PLoS One 13: e0205273.
- Kirby M, Pike D, Coxson HO, et al: (2014) Defectos de ventilación hiperpolarizada (3)He utilizados para predecir las exacerbaciones pulmonares en la enfermedad pulmonar obstructiva crónica de leve a moderada. Radiología 273: 887-896.
- Bragman FJ, McClelland JR, Modat M, et al: (2014) Análisis multiescala de las características de las imágenes y su uso en el estudio de los fenotipos susceptibles de exacerbación de la EPOC. Med Image Comput Assist Interv 17: 417-424.
- Hajian B, De Backer J, Vos W, et al.: (2018) Cambios en la ventilación-perfusión durante y después de una exacerbación de EPOC: una evaluación mediante modelización fluidodinámica. Int J Chron Obstruct Pulmon Dis 13: 833-842.
- Medrek SK, Sharafkhaneh A, Spiegelman AM, et al: (2017) El ingreso por exacerbación de EPOC se asocia con el diagnóstico clínico de hipertensión pulmonar: resultados de un estudio longitudinal retrospectivo de una población de veteranos. Copd 14: 484-489.
- Ozben B, Eryuksel E, Tanrikulu AM, et al.: (2015) La exacerbación aguda deteriora la función ventricular derecha en pacientes con EPOC. Hellenic J Cardiol 56: 324-331.
- Wells JM, Washko GR, Han MK, et al: (2012) Agrandamiento arterial pulmonar y exacerbaciones agudas de la EPOC. N Engl J Med 367: 913-921.
- Rho JY, Lynch DA, Suh YJ, et al: (2018) Mediciones de TC de la vasculatura pulmonar central como predictores de exacerbación grave en EPOC. Medicina (Baltimore) 97: e9542.
- Vogelmeier C, Buhl R, Burghuber O, et al.: (2018) S2k-Leitlinie zur Diagnostik und Therapie von Patienten mit chronisch obstruktiver Bronchitis und Lungenemphysem (COPD). AWMF en línea.
InFo NEUMOLOGÍA Y ALERGOLOGÍA 2019; 1(2): 10-14.