El infarto/lesión perioperatoria de miocardio (IMP) tras cirugía no cardiaca es una complicación cardiaca frecuente. Se necesita urgentemente una mejor comprensión de la etiología subyacente y de sus consecuencias.
El infarto de miocardio perioperatorio o lesión miocárdica (IMP) se reconoce cada vez más como una complicación cardiaca perioperatoria frecuente tras la cirugía mayor no cardiaca y contribuye de forma importante a la mortalidad postoperatoria [2–6]. Debido a la fuerte analgesia administrada en el periodo perioperatorio, la mayoría de las IMP se producen sin síntomas isquémicos típicos y, por tanto, se pasan por alto en la práctica clínica habitual sin una vigilancia activa [2–4,7,8]. Dado que la mortalidad asociada a la PMI asintomática es comparable a la asociada a la PMI sintomática, cada vez se aboga más por la vigilancia activa de la PMI con mediciones de troponina cardiaca (cTn) pre y postoperatorias como parte de la atención clínica rutinaria para permitir la detección precoz y el tratamiento [9–12]. Recientemente, la Sociedad Europea de Cardiología ha emitido una recomendación de clase IB para este seguimiento activo de la PMI [12].
Estudios anteriores en los que se ha realizado una vigilancia activa del PMI han demostrado que el PMI no es una enfermedad homogénea, sino un síndrome heterogéneo con varias etiologías subyacentes diferentes, entre las que se incluyen el infarto de miocardio de tipo 1 (T1MI) causado por la rotura de la placa, el infarto de miocardio de tipo 2 (T2MI) causado por un desajuste entre la oferta y la demanda, la taquiarritmia, la insuficiencia cardiaca aguda y el PMI primario extracardiaco, que puede deberse, por ejemplo, a una sepsis grave. por ejemplo, debido a una sepsis grave o a una embolia pulmonar (EP) [2–4,13–16]. Una mejor comprensión de la etiología subyacente es un requisito previo para realizar intervenciones preventivas y/o terapéuticas específicas para la PMI en pacientes individuales [9,17,18]. Al determinar de forma centralizada la etiología de la PMI, recientemente se observaron diferencias inesperadas en la incidencia y la mortalidad a corto plazo a los 30 días en un estudio piloto, lo que subraya aún más la importancia clínica de un fenotipado detallado [16]. Sin embargo, se sabe poco sobre las consecuencias a largo plazo de las distintas etiologías de la PMI [3]. Por ello, un reciente estudio prospectivo multicéntrico investigó los acontecimientos cardiacos adversos graves (MACE) y la mortalidad por todas las causas asociados a las diferentes etiologías de PMI evaluadas centralmente en el plazo de un año [1].
Población
Entre mayo de 2014 y junio de 2018, se inscribieron un total de 10 772 pacientes, de los cuales 7754 fueron elegibles para este análisis. Se inscribieron prospectivamente pacientes consecutivos sometidos a cirugía mayor no cardiaca con hospitalización en tres hospitales (Hospital Universitario de Basilea, Kantonsspital Aarau, ambos en Suiza, e Instituto do Coracao, InCor, Universidade de Sao Paulo, Brasil) elegibles para el programa institucional de vigilancia y respuesta activa al PMI para pacientes de alto riesgo sometidos a cirugía mayor no cardiaca con hospitalización [2].
Se seleccionó a los pacientes que presentaban un mayor riesgo de mortalidad, tenían ≥65 años o ≥45 años y padecían una enfermedad arterial coronaria, una enfermedad arterial periférica o un ictus y se sometieron a una intervención quirúrgica no cardiaca en régimen de hospitalización con una estancia postoperatoria prevista de ≥24 horas. Las concentraciones plasmáticas de cTn se midieron en los 30 días anteriores a la cirugía y en los días postoperatorios uno y dos como parte de la vigilancia activa y cuando estaba clínicamente indicado después de la cirugía. Se realizó un electrocardiograma (ECG) de doce derivaciones el día en que se detectó un PMI y cuando estaba clínicamente indicado.
Evaluación de la etiología de la PMI
La etiología de la PMI identificada en un programa de vigilancia y respuesta activas fue evaluada de forma centralizada por dos médicos independientes basándose en toda la información obtenida durante la investigación de la PMI indicada clínicamente, incluidas las imágenes cardiacas, en pacientes consecutivos de alto riesgo sometidos a cirugía mayor no cardiaca en un estudio prospectivo multicéntrico. La etiología del IMP se dividió jerárquicamente en “extracardíaca”, cuando estaba causada por una afección principalmente extracardíaca como una sepsis grave o una embolia pulmonar, y “cardíaca”, subdividida a su vez en infarto de miocardio de tipo 1 (IAMT1), taquiarritmia, insuficiencia cardíaca aguda (ICA) o probable infarto de miocardio de tipo 2 (IAMT2).
Puntos finales
Los criterios de valoración primarios fueron la aparición de MACE y muertes de todo tipo según las distintas etiologías de PMI en el plazo de un año. Las muertes se clasificaron como cardiovasculares o no cardiovasculares según las directrices más recientes [19]. Los MACE se definieron como un criterio de valoración compuesto de infarto agudo de miocardio, ICA, arritmias potencialmente mortales y muerte cardiovascular. El seguimiento comenzó después de la cirugía, el mismo día de la intervención. Para evitar el sesgo de definición, el PMI índice no se contabilizó como acontecimiento final en los pacientes con PMI clasificado como T1MI o ICA; en su lugar, el seguimiento del infarto agudo de miocardio o ICA comenzó después del tercer día postoperatorio. Un compuesto de MACE y muerte por todas las causas fue un criterio de valoración secundario.
Para optimizar la relación acontecimiento-ruido para los análisis de tiempo hasta el acontecimiento y de pronóstico, se eligió como criterio de valoración secundario la aparición de MACE y de muerte por cualquier causa a los 120 días y se utilizó para los análisis de pronóstico y de tiempo hasta el acontecimiento porque un estudio anterior sugería un periodo vulnerable de 120 días después de intervenciones no cardiacas [20].
Características de las etiologías de PMI
El PMI se produjo en 1016/7754 pacientes (13,1%), de los cuales 109/1016 (10,7%) se clasificaron centralmente como extracardíacos primarios. Las PMI se clasificaron como T1MI en 71/1016 pacientes (7,0%), taquiarritmia en 47/1016 pacientes (4,6%) e ICA en 39/1016 (3,8%). De los pacientes diagnosticados de T1MI, se realizó una angiografía coronaria en un plazo de siete días en 42/71 pacientes, en un plazo de 30 días en 47/71 pacientes, y se tomó una decisión sin angiografía coronaria en 24 pacientes. Las 750/1016 restantes (73,8%) se clasificaron como lT2MI.
Las características basales diferían entre las etiologías de PMI preespecificadas, siendo, por ejemplo, la cardiopatía coronaria conocida más frecuente en la T1MI y la ICA que en el resto de etiologías de PMI. Los criterios adicionales para el diagnóstico de IAM espontáneo estaban presentes en 260/1016 (25%) de los pacientes con IAMP, por ejemplo, síntomas isquémicos o disnea en 143/1016 (14%), de nuevo con grandes diferencias entre las etiologías del IAMP. En 34/1016 pacientes (3%), el PMI se evaluó sin un valor preoperatorio de cTn basado en el cambio entre los valores postoperatorios.
Seguimiento
El seguimiento se completó en 7754/7833 pacientes (99%) con una duración media de 388 días. Se produjo al menos un MACE en 684/7754 pacientes al cabo de un año (8,8%). Un total de 818/7754 pacientes fallecieron en el plazo de un año (10,5%), y la muerte se produjo en 154/817 pacientes durante la estancia hospitalaria índice. 1160/7754 pacientes (15,0%) experimentaron MACE o muerte como causa general.
MACE según PMI en función de la etiología
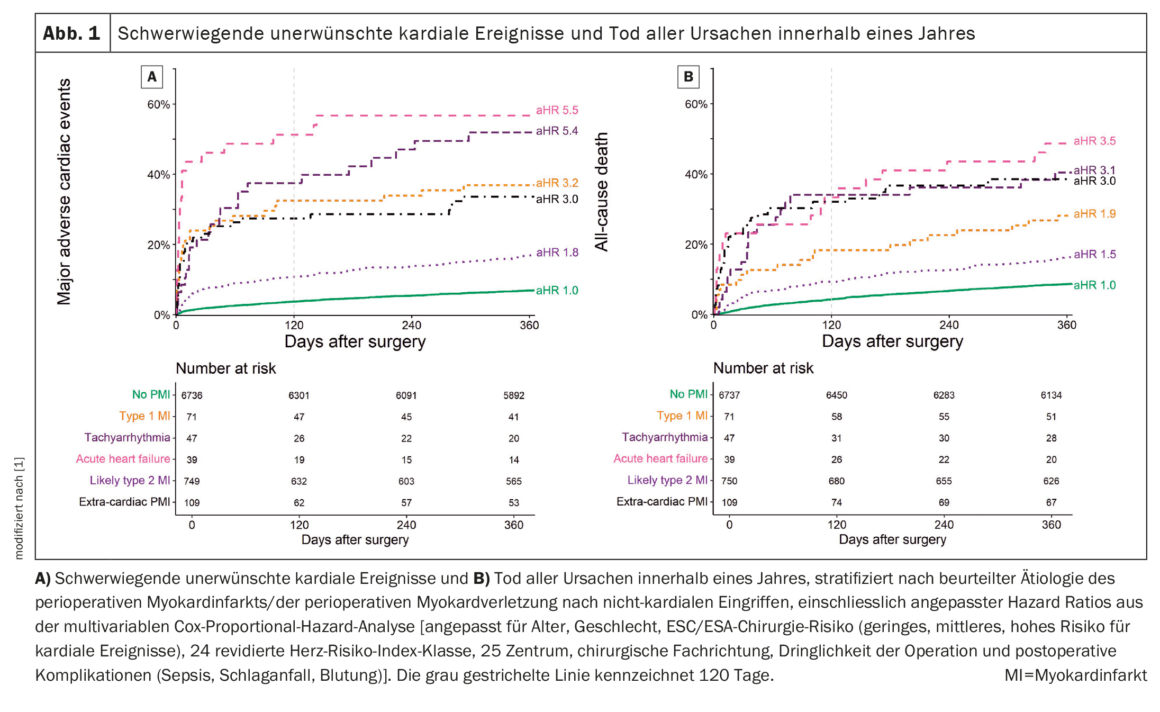
Para todas las etiologías de PMI, la tasa de MACE a 1 año aumentó significativamente en comparación con los pacientes sin PMI. Hubo diferencias significativas en los pacientes sin PMI (7%, IC 95% 6%-8%), y dentro de la etiología del PMI (Fig. 1A) [1]: El PMI extracardíaco, el T1MI, la taquiarritmia y la ICA se asociaron a tasas muy elevadas de MACE [30% (IC 95%: 20-47), 37% (IC 95%: 24-47), 49% (IC 95%: 34-75) y 56% (IC 95%: 38-70), respectivamente], y el lT2MI también se asoció a tasas elevadas de MACE (17%, IC 95%: 22-28). Las asociaciones se confirmaron en el análisis multivariable con cocientes de riesgo ajustados (aHR) de 3,0 (2,0-4,5), 3,2 (IC 95%: 2,1-4,8), 5,4 (3,5-8,4) y 5,5 (3,5-8,7) para PMI extracardiaco, T1MI, taquiarritmia e ICA, y 1,8 (1,5-2,2) para lT2MI.
Se observó una asociación similar para los MACE a los 120 días, con una RCA numéricamente mayor en el análisis multivariable en comparación con las asociaciones a 1 año, pero menor potencia debido al menor número de eventos. El tiempo transcurrido desde la cirugía hasta la aparición de MACE en un plazo de 120 días difirió significativamente entre las etiologías de PMI, desde una mediana de tres días tras ICA hasta 13 días tras lT2MI y 26 días en pacientes sin PMI. Al examinar el número total de MACE estratificados por la etiología del PMI, se produjeron múltiples acontecimientos en el 3% al 23% de los pacientes, en comparación con el 1% en los pacientes sin PMI. La asociación de la etiología del PMI con los MACE fue más fuerte en los primeros 120 días que después de un año.
Mortalidad total según PMI
Todas las etiologías de PMI presentaron una mayor tasa de mortalidad por todas las causas a 1 año en comparación con los pacientes sin PMI. En los pacientes sin PMI (9%, IC 95%: 8-9%), y dentro de las etiologías de PMI, hubo diferencias significativas (Fig. 1B) [1]: el PMI extracardíaco, el T1MI, la taquiarritmia y la ICA se asociaron a tasas de mortalidad elevadas [38% (IC 95%: 29-47), 28% (IC 95%: 17-38), 40% (IC 95%: 25-53) y 49% (IC 95%: 30-62), respectivamente], y el lT2MI también se asoció a tasas de mortalidad elevadas (17%, IC 95%: 14-20). Esta relación se confirmó en el análisis multivariable.
Modelo de predicción para lT2MI
Se produjeron MACE o muerte por todas las causas en 117/750 pacientes con lT2MI en un plazo de 120 días. La presencia de dolor torácico o disnea, un aumento absoluto de cTn de >2 × percentil 99 en comparación con el valor basal, la cirugía de alto riesgo según la puntuación de riesgo quirúrgico de la ESC/ESA y la cirugía no electiva se asociaron a un mayor riesgo de MACE, mientras que la hemorragia se asoció a un menor riesgo de MACE. La validación interna mostró una buena concordancia entre la tasa de eventos predicha y la observada tras un bootstrapping con 1.000 iteraciones y una puntuación Brier de 0,16.
El modelo pronóstico mostró un AUC moderado de 0,71 (IC 95%: 0,66-0,76). En comparación con el RCRI máximo (disponible en 747/750 casos), la clase ASA (disponible en 718/750 casos) y el hs-cTnT-delta absoluto (disponible en 564/750 casos), el modelo pronóstico mostró el AUC numéricamente más alto, que fue estadísticamente diferente de la clase ASA y el hs-cTnT-delta (p=0,003) y comparable al RCRI (p=0,195). La combinación del modelo pronóstico con la clase de ASA o el RCRI aumentó aún más significativamente el AUC en comparación con el RCRI o la clase de ASA por sí solos (modelo+ASA 0,75; IC 95%: 0,71-0,80; p<0,001; modelo+RCRI 0,75; IC 95%: 0,70-0,80; p<0,001). Tras la categorización por el modelo pronóstico, el grupo de PMI de “muy alto riesgo” lT2MI tuvo una tasa de MACE o muerte del 31% (comparable a la PMI de T1MI), mientras que el grupo de “bajo riesgo” tuvo tasas del 7% (comparables a las de los pacientes sin PMI).
Altas tasas de MACE y muertes por todas las causas al cabo de un año
El gran estudio multicéntrico prospectivo internacional evaluó de forma centralizada la etiología del PMI identificado durante la vigilancia activa en pacientes de alto riesgo sometidos a cirugía mayor no cardiaca y controló de cerca los MACE durante el seguimiento a largo plazo. Al cabo de un año, la mayoría de las etiologías de PMI presentan tasas inaceptablemente elevadas de MACE y de muerte por todas las causas, lo que pone de manifiesto la necesidad urgente de tratamientos más intensivos.
Literatura:
- Puelacher C, et al.: Long-term outcomes of perioperative myocardial infarction/injury after non-cardiac surgery. EurHeartJ 2023.
https://doi.org/10.1093/eurheartj/ehac798 - Puelacher C, Lurati Buse G, Seeberger D, et al: Lesión miocárdica perioperatoria tras cirugía no cardíaca: incidencia, mortalidad y caracterización. Circulation 2018;137: 1221-1232. https://doi.org/10.1161/CIRCULATIONAHA.117.030114
- Botto F, Alonso-Coello P, Chan MT V, et al.: Myocardial injury after noncardiac surgery: a large, international, prospective cohort study establishing diagnostic criteria, characteristics, predictors, and 30-day outcomes. Anesthesiology 2014;120: 564–578.
https://doi.org/10.1097/ALN.0000000000000113 - Devereaux PJ, Biccard BM, Sigamani A, et al.: Association of postoperative high-sensitivity troponin levels with myocardial injury and 30-day mortality among patients undergoing noncardiac surgery. JAMA 2017;317: 1642–1651.
https://doi.org/10.1001/jama.2017.4360 - Landesberg G, Mosseri M, Zahger D, et al.: Myocardial infarction after vascular surgery: the role of prolonged stress-induced, ST depression-type ischemia. J Am Coll Cardiol 2001;37:1839–1845. https://doi.org/10.1016/S0735-1097(01)01265-7
- Landesberg G, Shatz V, Akopnik I, et al.: Association of cardiac troponin, CK-MB, and postoperative myocardial ischemia with long-term survival after major vascular surgery. J Am Coll Cardiol 2003;42: 1547–1554. https://doi.org/10.1016/j.jacc.2003.05.001
- Devereaux PJ, Xavier D, Pogue J, et al.: Characteristics and short-term prognosis of perioperative myocardial infarction in patients undergoing noncardiac surgery: a cohort study. Ann Intern Med 2011;154: 523–528. https://doi.org/10.7326/0003-4819-154-8-201104190-00003
- Devereaux PJ, Chan MT V, Alonso-Coello P, et al.: Association between postoperative troponin levels and 30-day mortality among patients undergoing noncardiac surgery. JAMA 2012;307: 2295–2304. https://doi.org/10.1001/jama.2012.5502
- Thygesen K, Alpert JS, Jaffe AS, et al.: Fourth universal definition of myocardial infarction (2018). Eur Heart J 2019;40: 237–269. https://doi.org/10.1093/eurheartj/ehy462.
- Duceppe E, Parlow J, MacDonald P, et al.: Canadian Cardiovascular Society guidelines on perioperative cardiac risk assessment and management for patients who undergo noncardiac surgery. Can J Cardiol 2017;33: 17–32. https://doi.org/10.1016/j.cjca.2016.09.008
- Gualandro DM, Yu PC, Caramelli B, et al.: 3rd guideline for perioperative cardiovascular evaluation of the Brazilian society of cardiology. Arq Bras Cardiol 2017;109: 1-104. https://doi.org/10.5935/abc.20170140
- Halvorsen S, Mehilli J, Cassese S, et al: 2022 ESC guidelines on cardiovascular assessment and management of patients undergoing non-cardiac surgery. Eur Heart J 2022;43: 3826-3924. https://doi.org/10.1093/eurheartj/ehac270.
- Gualandro DM, Campos CA, Calderaro D, et al.: Coronary plaque rupture in patients with myocardial infarction after noncardiac surgery: frequent and dangerous. Atherosclerosis 2012;222: 191–195. https://doi.org/10.1016/j.atherosclerosis.2012.02.021
- Duvall WL, Sealove B, Pungoti C, et al.: Angiographic investigation of the pathophysiology of perioperative myocardial infarction. Catheter Cardiovasc Interv 2012;80: 768–776. https://doi.org/10.1002/ccd.23446
- Sheth T, Natarajan MK, Hsieh V, et al.: Incidence of thrombosis in perioperative and non-operative myocardial infarction. Br J Anaesth 2018;120: 725–733. https://doi.org/10.1016/j.bja.2017.11.063
- Puelacher C, Gualandro DM, Lurati Buse G, et al.: Etiology of peri-operative myocardial infarction/injury after noncardiac surgery and associated outcome. J Am Coll Cardiol 2020;76: 1910–1912. https://doi.org/10.1016/j.jacc.2020.08.043
- Landesberg G, Beattie WS, Mosseri M, et al.: Perioperative myocardial infarction. Circulation 2009;119: 2936–2944. https://doi.org/10.1161/CIRCULATIONAHA.108.828228.
- Howell SJ, Brown OI, Beattie WS: Aetiology of perioperative myocardial injury: a scientific conundrum with profound clinical implications. Br J Anaesth 2020;125: 642-646. https://doi.org/10.1016/j.bja.2020.08.007.
- Hicks KA, Tcheng JE, Bozkurt B, et al.: 2014 ACC/AHA key data elements and definitions for cardiovascular endpoint events in clinical trials. Circulation 2015;132: 302–361.
- Sazgary L, Puelacher C, Lurati Buse G, et al.: Incidence of major adverse cardiac events following non-cardiac surgery. Eur Heart J Acute Cardiovasc Care 2020;10: 550–558. https://doi.org/10.1093/ehjacc/zuaa008.
CARDIOVASC 2023; 22(1): 46–48