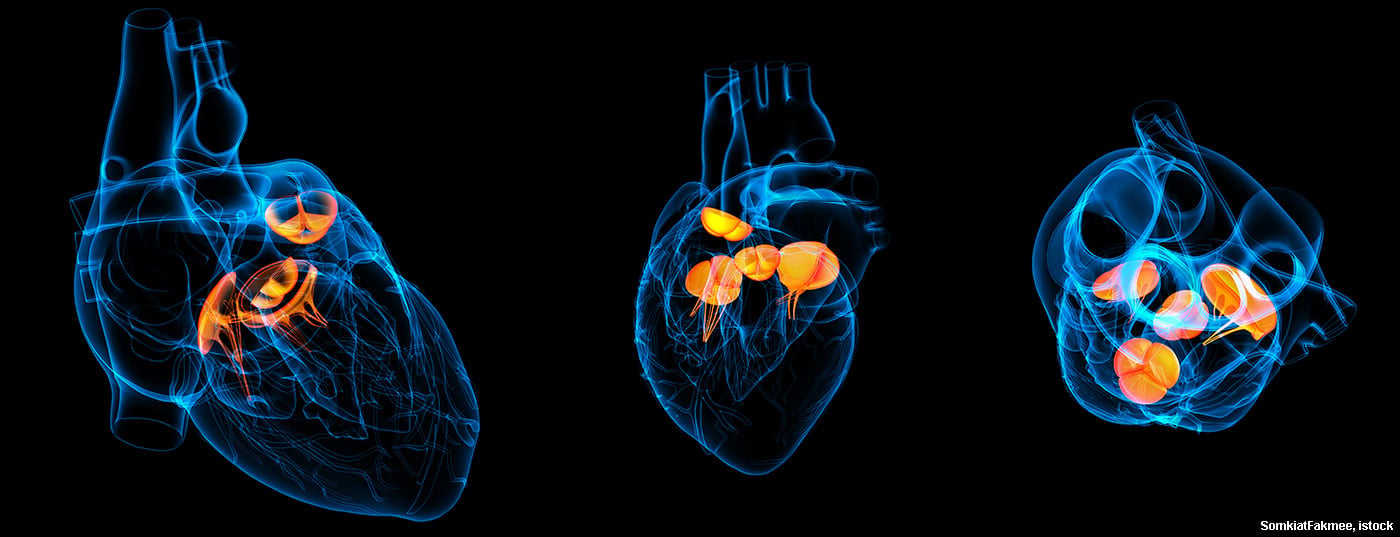
Los avances médicos también influyen en la epidemiología de la endocarditis infecciosa. Los implantes de válvulas con catéter (TAVI), en particular, constituirán un reto importante en el futuro.
La endocarditis infecciosa se refiere a una infección del endocardio (especialmente de las válvulas cardiacas) o de implantes intracardiacos (por ejemplo, válvulas cardiacas artificiales, prótesis aórticas y electrodos de marcapasos y desfibriladores) causada por bacterias en más del 90% de los casos. En la práctica clínica diaria, son principalmente las válvulas aórtica y mitral las que se ven afectadas. Las válvulas cardiacas derechas sólo están implicadas en un 5-10% de los casos, en este caso sobre todo la válvula tricúspide. Los factores de riesgo de endocarditis derecha son principalmente el abuso de drogas intravenosas, así como de dispositivos intracardíacos como cables de marcapasos y catéteres intravasculares (especialmente catéteres venosos centrales). Los defectos cardíacos congénitos individuales (especialmente aquellos con patología valvular y/o con una derivación) también suponen un riesgo para la aparición de endocarditis [1,2]. La endocarditis de válvula protésica representa alrededor del 5% de todas las endocarditis infecciosas [1–4].
Profilaxis
La endocarditis infecciosa fue descrita por primera vez por William Osler [5] en 1885. En la década de 1920, se sospechó por primera vez que las bacterias que circulaban por el torrente sanguíneo tras los procedimientos dentales eran la causa de la infección valvular y, en consecuencia, la AHA (Asociación Americana del Corazón) publicó en 1955 las primeras recomendaciones para la profilaxis antibiótica [6]. Desde entonces, las recomendaciones para la administración profiláctica de antibióticos se han adaptado varias veces. Se trata sobre todo de sopesar los beneficios de la profilaxis frente al riesgo de fomentar la resistencia a los antibióticos. En la última revisión de 2007, las recomendaciones para la profilaxis antibiótica en situaciones de riesgo eran muy restrictivas (Tab. 1) [7,8].

Sobre todo, se restringió el número y el tipo de intervenciones y acciones para las que debía administrarse profilaxis. La profilaxis antibiótica sigue estando indicada para los procedimientos dentales que impliquen la manipulación del surco gingival o la perforación de la mucosa, así como para los procedimientos en la región orofaríngea si se perfora la mucosa. Por otro lado, se ha retirado la recomendación de profilaxis durante los procedimientos y manipulaciones del tracto urogenital, los procedimientos ginecológicos y los procedimientos gastrointestinales, como las endoscopias, siempre que no exista una infección activa en estos sistemas orgánicos. Por lo demás, la profilaxis y la terapia adecuada son, por supuesto, necesarias.
Los grupos de riesgo de pacientes que deberían seguir recibiendo profilaxis también se definieron de forma mucho más estricta. En la actualidad, sólo los pacientes de mayor riesgo deben recibir profilaxis y, en este caso, especialmente los pacientes con un alto riesgo de evolución desfavorable cuando se produce una endocarditis infecciosa. Esto incluye a todos los pacientes tras una sustitución valvular (ya sea quirúrgica con prótesis mecánicas o biológicas o intervencionista con válvulas transcatéter). Los grupos de riesgo también incluyen a los pacientes que ya han sufrido endocarditis, los pacientes con vitia congénita (véanse las listas separadas en las directrices [7,8]) y los pacientes tras un trasplante de corazón con nueva aparición de valvulopatía. En pacientes con afección tras una reconstrucción valvular, se recomienda la profilaxis durante 6 meses hasta la endotelización. En cambio, la profilaxis antibiótica ya no está indicada en pacientes con un defecto valvular, como la estenosis aórtica o la regurgitación mitral.
El riesgo de que aumente la resistencia a los antibióticos de los tipos de gérmenes más comunes se citó como la razón de la actitud significativamente más restrictiva hacia la administración profiláctica de antibióticos. De hecho, hay informes que muestran una disminución de los gérmenes resistentes a cerca del 10% desde la introducción de las nuevas directrices, aunque la causalidad es difícil de probar [10]. El factor económico y la seguridad del paciente tampoco deben subestimarse, ya que pueden producirse reacciones alérgicas graves incluso durante la profilaxis antibiótica. Como justificación adicional de la postura más restrictiva, se destacan los estudios que muestran bacteriemia en la higiene dental incluso durante el cepillado normal de los dientes, que es de una magnitud similar a las intervenciones dentales sin implicación del aparato gingival. Por lo tanto, la profilaxis no está justificada en situaciones que no superen el nivel de riesgo cotidiano normal.
Incidencia
La incidencia de la endocarditis infecciosa es de 3-10 por cada 100.000 personas al año. En la actualidad, casi el 40% de las infecciones de válvulas protésicas están asociadas a los hospitales. Asociada al hospital significa que la infección surge en relación con una estancia hospitalaria (por ejemplo, debido a catéteres venosos, infecciones de heridas, neumonía, infecciones del tracto urinario). Además, existen numerosas publicaciones que informan de un aumento de la incidencia en los últimos años [1,2,9,10]. Podemos confirmar muy bien esta observación basándonos en nuestra propia experiencia. Sin embargo, interpretar el aumento de casos con endocarditis protésica es difícil, ya que son muchos los factores que pueden influir en estas cifras. En un estudio realizado en Inglaterra, se analizó el número de infecciones y de prescripciones de antibióticos mediante un registro nacional tras la restricción de la profilaxis de la endocarditis. Se observó un descenso drástico de las prescripciones de antibióticos, pero al mismo tiempo un rápido aumento de los casos de endocarditis [9].
Otros estudios realizados en otros países no pudieron demostrar un aumento igual de rápido de los casos de endocarditis, por lo que los propios autores del estudio inglés relativizan la referencia al cambio de las directrices de profilaxis [6].
Es probable que el aumento de la edad de los pacientes, combinado con unas comorbilidades cada vez más complejas, sea uno de los cambios más importantes que expliquen el aumento significativo de los casos de endocarditis infecciosa. En el pasado, los pacientes más jóvenes con valvulopatías reumáticas estaban predispuestos a la endocarditis, pero hoy en día, en las regiones con una buena atención médica, son sobre todo los pacientes de más edad con valvulopatías degenerativas los que se ven afectados. Sin embargo, debido a la migración, también se observa en nuestros hospitales un nuevo aumento de la prevalencia de las valvulopatías reumáticas con la correspondiente predisposición. Otros factores de riesgo importantes son el uso creciente de procedimientos como la diálisis y la inmunosupresión, así como el aumento de pacientes a los que se les han colocado catéteres intravasculares (catéteres venosos centrales), implantes intracardíacos como marcapasos, otros materiales extraños como prótesis de cadera y rodilla y, por supuesto, válvulas protésicas [1,2,6,11,12]. En los pacientes más jóvenes, se trata sobre todo de personas con administración de fármacos por vía intravenosa.
Diagnóstico
A la hora de realizar un diagnóstico, deben combinarse los hallazgos clínicos, los resultados microbiológicos y los resultados de las pruebas de imagen. Deben utilizarse los criterios de Dukes (Tab. 2) [1,2,7,13], que permiten interpretar diferentes modalidades y estimar la probabilidad de endocarditis. Se atribuye un papel cada vez más importante al diagnóstico por imagen, en el que la ecocardiografía transesofágica se ha convertido en el patrón oro; con los avances técnicos y el aumento cualitativo de la resolución de imagen, cabe esperar un aumento de la tasa de detección y, por tanto, también del número de casos. El diagnóstico por PET-TAC se utiliza cada vez más en casos de sospecha de infección de prótesis vasculares, aunque aún queda mucha experiencia por adquirir en la evaluación de los hallazgos de estos exámenes.

Para los exámenes microbiológicos, es importante tomar 3 series de hemocultivos, que deben realizarse rápidamente a la menor sospecha. Con este triple cultivo, se detectan hasta el 98% de los gérmenes de la bacteriemia [7,14].
Microbiología
En los últimos años, el espectro de patógenos ha cambiado de los patógenos anteriormente más comunes de la zona orofaríngea a los patógenos asociados a los hospitales. El Staphylococcus aureus ha superado a los estreptococos como patógeno más común. En la década de 1960, la proporción de Staphylococcus aureus era del 18%, pero desde entonces ha aumentado hasta alcanzar el 38% (Tab. 3) [1,2,4,15].
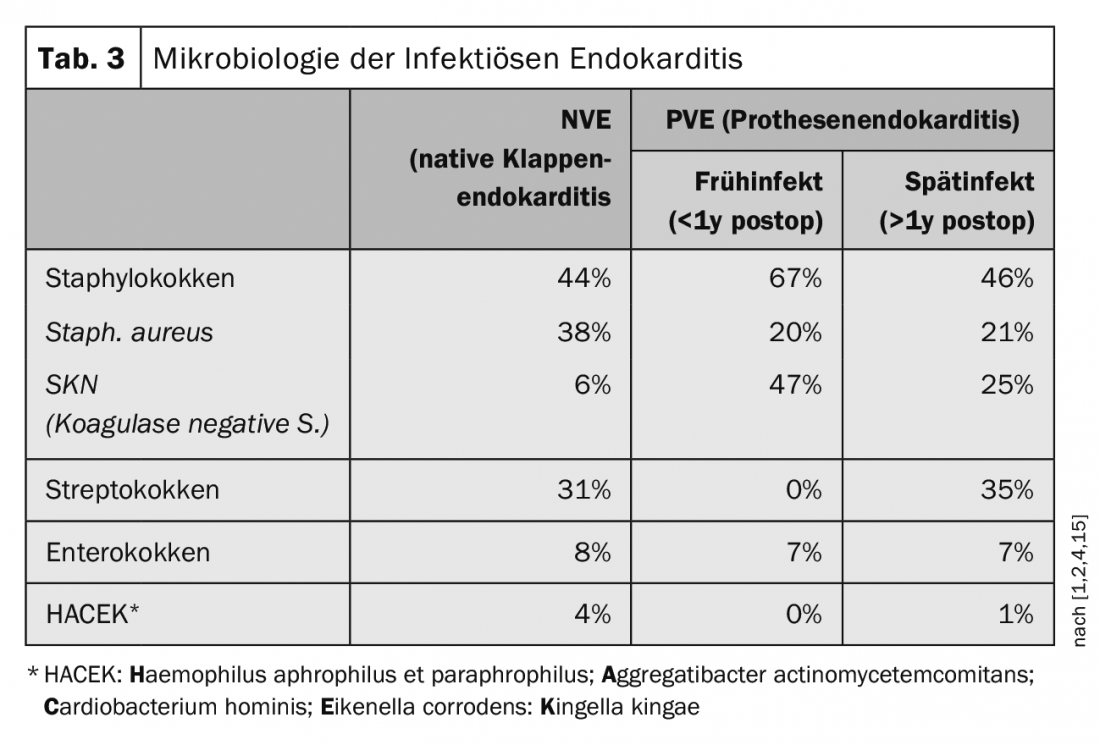
La endocarditis infecciosa de las válvulas protésicas, la llamada endocarditis protésica (EVP), se divide en infección temprana en el plazo de un año tras la implantación e infección tardía, que se produce después de un año de la implantación [7,14]. Las infecciones tempranas se producen hasta en un 16% de las infecciones de prótesis. Las primeras infecciones directamente relacionadas con la cirugía suelen producirse en un plazo de 2 a 3 meses y suelen estar causadas por un estafilococo coagulasa negativo (SKN) o un estafilococo áureo. En los implantes de válvulas por catéter transfemoral (TAVI), por otra parte, los enterococos se aíslan con mayor frecuencia en las infecciones tempranas, aunque la situación de los datos en este caso es aún relativamente escasa [1,2]. Las infecciones de prótesis que se producen después de un año son infecciones de causa hematógena y corresponden al espectro germinal de la endocarditis de válvula nativa [16]. Tras la implantación de una prótesis valvular transfemoral (TAVI), existe un riesgo del 5-6% de endocarditis en un plazo de 5 años. En comparación, tras la implantación de un marcapasos, existe un riesgo del 2% de desarrollar endocarditis en un plazo de 5 años. En el caso de las prótesis valvulares quirúrgicas, ya sean biológicas o mecánicas, el riesgo es de aproximadamente un 3-4% en un plazo de 5 años.
A pesar de todos los avances en cirugía cardiaca, enfermedades infecciosas y medicina intensiva, la mortalidad no ha cambiado significativamente en las últimas décadas: la endocarditis infecciosa sigue siendo una enfermedad sistémica grave con una morbilidad y mortalidad correspondientemente altas. La tasa de mortalidad de la endocarditis infecciosa es del 20% y aumenta a más del 50% en el caso de la endocarditis protésica.
Cuando se ve afectada una válvula cardiaca nativa, suele haber en primer lugar depósitos, las llamadas vegetaciones, que, dependiendo de su tamaño, pueden embolizar y, en el peor de los casos, provocar una lesión cerebrovascular séptica. Además, puede producirse una insuficiencia aguda de la válvula afectada -por destrucción de la estructura- que provoque un deterioro hemodinámico agudo. Las estenosis se observan con mucha menos frecuencia, ocasionalmente en conexión con grandes vegetaciones.
En la endocarditis protésica, las vegetaciones pueden causar tanto estenosis como insuficiencia en las válvulas mecánicas al bloquear una valva. Las válvulas biológicas conducen a menudo a la destrucción de las bolsas valvulares y, por tanto, a insuficiencias graves. Una complicación temida de la endocarditis protésica es la insuficiencia paravalvular debida a un absceso alrededor del anillo valvular. Esto puede provocar un aflojamiento completo de la válvula con el correspondiente fenómeno de “válvula basculante”. La abscesión se observa principalmente en la endocarditis por Staphylococcus aureus.
No es infrecuente que se produzca un absceso valvular izquierdo en la unión aortomitral, con la correspondiente destrucción de la continuidad ventrículo-aórtica y en la región del tabique membranoso, con la correspondiente alteración de la conducción AV hasta el bloqueo AV de tercer grado incluido.
Cirugía
La terapia quirúrgica para la endocarditis de válvulas nativas es necesaria en un 40-50% de los casos; la terapia conservadora con antibiosis puede conducir a la curación de la válvula afectada hasta en un 60%. Con las válvulas protésicas, la situación es mucho más peligrosa y la reparación quirúrgica es necesaria con mucha más frecuencia. Los sistemas de marcapasos también deben retirarse en estos pacientes. La reimplantación de un nuevo sistema de marcapasos depende de la indicación respectiva y actual y puede realizarse en la misma operación utilizando electrodos epicárdicos. Debido a su curso extravascular, estos últimos son menos susceptibles a la reinfección.
Para los pacientes que requieren cuidados intensivos, es importante el traslado al centro con el tratamiento y la evaluación interdisciplinarios adecuados. Además, los estudios demuestran que una indicación lo más rápida posible con una realización adecuada de la operación da como resultado una supervivencia significativamente mejor perioperatoriamente, pero también en el curso a largo plazo [17,18].
Las directrices europeas proporcionan orientación sobre la indicación de la terapia quirúrgica (Tab. 4) [7]. La terapia quirúrgica está especialmente indicada en las siguientes situaciones: [2,3,7]
- Disfunción valvular con inestabilidad hemodinámica,
- Infección incontrolable a pesar de una terapia antibiótica adecuada,
- Absceso creciente con insuficiencia paravalvular,
- Prevención de la embolización
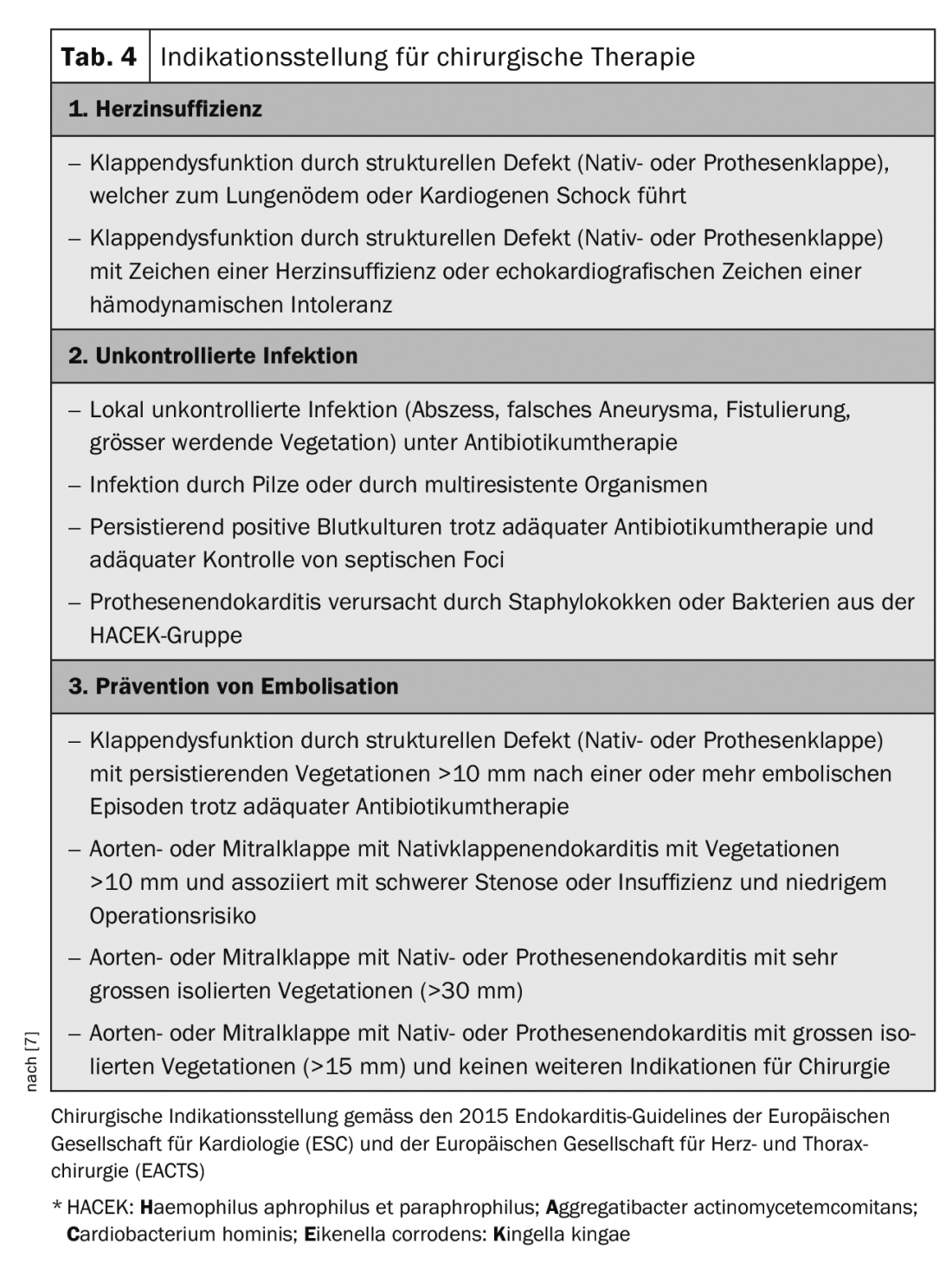
En cuanto a la prevención de la embolización, también hay posibilidades de mejora en las directrices. Para las vegetaciones del lado izquierdo mayores de 10 mm, la cirugía precoz debe indicarse de forma más generosa [17]. En los pacientes con apoplejía, la cirugía suele retrasarse demasiado, aceptando así un mayor deterioro del paciente con un mayor riesgo de embolia. Tras un ictus sin hemorragia intracraneal y sin deterioro neurológico grave, la cirugía debe realizarse sin demora. En caso de gran isquemia o hemorragia cerebral, debe considerarse la conveniencia de esperar al menos 3-4 semanas.
La sustitución valvular es el tratamiento de elección para la endocarditis de la válvula aórtica nativa. Si la válvula mitral nativa está afectada, puede intentarse la reconstrucción, siempre que el tejido no esté completamente reblandecido y/o destruido. Las prótesis valvulares infectadas deben sustituirse en cualquier caso. Las cavidades abscesales suelen cerrarse con parches de pericardio.
En el futuro, es probable que la endocarditis de las válvulas transcatéter se convierta en un problema cada vez mayor. Hasta hace poco, estas válvulas se implantaban principalmente en pacientes ancianos e inoperables que a menudo morían antes de desarrollar una endocarditis. Y si se producía endocariditis, estos pacientes recibían un tratamiento conservador. Dado que se espera que en el futuro se coloquen válvulas de catéter a un número mayor de pacientes jóvenes, también aumentará el número de endocarditis protésicas tras TAVI. De hecho, cabe suponer que la incidencia será al menos igual a la de las prótesis quirúrgicas convencionales.
Técnicamente, las intervenciones tras la implantación de una prótesis TAVI pueden ser todo un reto, ya que estas válvulas contienen mucho más material extraño y, en particular, malla metálica, que a menudo se extiende hasta la raíz aórtica o incluso más allá de ella. En ocasiones pueden resultar extremadamente difíciles de eliminar. En cambio, tras la sustitución quirúrgica de la válvula, normalmente se puede desprender el anillo valvular e implantar una nueva válvula en el mismo lugar. Con las válvulas de catéter, el riesgo de daños en la zona de la raíz aórtica es mayor. Además, si al final hay que implantar un injerto compuesto, el esfuerzo es significativamente mayor. La tasa de recurrencia tras una endocarditis de válvula protésica es del 6-15% [2].
La lección más importante en pacientes con un cuadro febril poco claro y una constelación de riesgo potencial (portador de prótesis valvular, vitium valvular) es pensar en la posibilidad de una endocarditis infecciosa, aunque los síntomas no sean del todo típicos. Especialmente en pacientes con prótesis valvulares, la endocarditis debe descartarse en cualquier caso de fiebre poco clara. Si hay signos de infección o un estado general reducido con un nuevo soplo cardíaco, también es esencial buscar una endocarditis. En el futuro, es probable que el número de pacientes de riesgo (aquellos con TAVI, prótesis vasculares de las grandes arterias o con injertos endovasculares de stent en la aorta) aumente significativamente.
También es importante cuidar a los pacientes con implantes cardiovasculares, en lo que respecta a la instrucción sobre la profilaxis de la endocarditis -no sólo mediante antibióticos cuando estén indicados, sino también en lo que respecta a medidas higiénicas como la higiene dental, pero también la prevención y el tratamiento de lesiones cutáneas recurrentes o heridas crónicas.
Mensajes para llevarse a casa
- Los avances médicos están cambiando la epidemiología de la endocarditis infecciosa.
- En general, esperamos un aumento de los casos de endocarditis. El diagnóstico sigue siendo un reto.
- Las infecciones asociadas a los hospitales también se han convertido en un problema importante en la endocarditis infecciosa.
- El tratamiento quirúrgico de la endocarditis infecciosa resulta cada vez más complejo cuanto más material extraño haya ya en el paciente.
- La endocarditis tras la implantación de válvulas por catéter (TAVI) será un reto importante en el futuro.
- La indicación de la administración de antibióticos debe estar siempre bien justificada.
- Por lo tanto, la administración de profilaxis contra la endocarditis sólo se recomienda de forma muy restrictiva.
Literatura:
- Cahill TJ, et al: Desafíos en la endocarditis infecciosa. JACC 2017; 69: 325-344.
- Cahill TJ, Prendergast BD: Endocarditis infecciosa. Lancet 2016; 387: 882-893.
- Wang A, et al: Perfil clínico contemporáneo y resultado de la endocarditis de válvula protésica. JAMA 2007; 297: 1354-1361.
- Moreillon P, Que YA: Endocarditis infecciosa. Lancet 2004; 363: 139-149.
- Osler W.: Las conferencias gulstonianas, sobre la endocarditis maligna. BMJ 1985; 1: 577-579.
- Dayer M, Thornhill M: Pautas de profilaxis antibiótica y endocarditis infecciosa: ¿motivo de preocupación? JACC 2015; 65: 2077-2078.
- Habib G, et al.: 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Apoyado por: Asociación Europea de Cirugía Cardio-Torácica (EACTS), la Asociación Europea de Medicina Nuclear (EANM). Eur Heart J 2015; 36: 3075-3128.
- Flückiger U, Jaussi A: Directrices suizas revisadas para la profilaxis de la endocarditis. Medicina cardiovascular 2008; 11: 392-400.
- Dayer MJ, et al: Incidencia de la endocarditis infecciosa en Inglaterra, 2000-13: una tendencia secular, análisis de series temporales interrumpidas. Lancet 2015; 385: 1219-1228.
- Ostovar R, et al: Endocarditis: un problema cada vez mayor en cirugía cardiaca. Thorac Cardiovasc Surg 2019; publicación electrónica antes de impresión
- Slipczuk L, et al: Epidemiología de la endocarditis infecciosa a lo largo de cinco décadas: una revisión sistemática. PLoS One 2013; 8:e82665.
- Fefer P, et al: Epidemiología cambiante de la endocarditis infecciosa: un estudio retrospectivo de 108 casos, 1990-1999. Eur J Microbiol Infect Dis 2002; 21: 432-437.
- Li JS, et al: Modificaciones propuestas a los criterios de Duke para el diagnóstico de la endocarditis infecciosa. Clin Infect Dis 2000; 30: 633-638.
- Vongpatanasin W, et al: Válvulas cardiacas protésicas. NEJM 1996; 335: 407-416.
- Murdoch DR, et al: Presentación clínica, etiología y resultado de la endocarditis infecciosa en el siglo XXI: la Colaboración Internacional sobre Endocarditis – Estudio prospectivo de cohortes. Arch Intern Med 2009; 169: 463-473.
- Butt JH, et al: Riesgo a largo plazo de endocarditis infecciosa tras la sustitución transcatéter de la válvula aórtica. JACC 2019; 73: 1646-1655.
- Carrel T.: La reparación o sustitución valvular precoz no suele estar contraindicada en pacientes con endocarditis infecciosa e ictus con o sin hemorragia intracraneal. Eur J Cardiothorac Surg 2016; 50: 383-384.
- Carrel T, et al: ¿Qué hay de nuevo en el tratamiento quirúrgico de la endocarditis infecciosa? Intensive Care Med 2016; 42: 2052-2054.
CARDIOVASC 2019; 18(4): 9-13