A pesar de la evolución demográfica conocida, en la actualidad sabemos muy poco con respecto a los pacientes ancianos o incluso muy ancianos sobre si podemos adaptar e individualizar la radioterapia (RT) y cómo hacerlo, especialmente si forma parte de un concepto de terapia multimodal. Los cribados como el G8 pueden ser útiles para detectar la mayor “vulnerabilidad” de un paciente mayor en una fase temprana. La cooperación interdisciplinar y la estrecha implicación del paciente y su familia en los procesos de toma de decisiones son la base de los conceptos de terapia sostenible. Los nuevos avances técnicos en radiooncología abren muy buenas opciones, especialmente para el grupo de pacientes de edad avanzada y con comorbilidades relevantes, de modo que también se pueden perseguir enfoques curativos.
El fenómeno del envejecimiento de la población se observa en todos los países desarrollados: En Suiza, la esperanza de vida media aumentó en 5,1 años hasta los 85,2 años para las mujeres y hasta en 7,6 años hasta los 81,0 años para los hombres entre 1984 y 2014. Dado que la incidencia de muchas entidades tumorales aumenta con la edad, debemos suponer que veremos un mayor número absoluto de casos de cáncer en el futuro. En EE.UU., se prevé que el número de casos de cáncer aumente un 45% entre 2010 y 2030, y este incremento se producirá casi exclusivamente en el grupo de edad >65 años [1]. Existen diferencias entre los sexos: En el caso de los hombres, se describe que la tasa de enfermedad en el grupo de edad designado en Suiza es casi el doble que la de las mujeres, mientras que la situación es exactamente la contraria en el caso de los pacientes de <55 años [2].
¿Son útiles las evaluaciones?
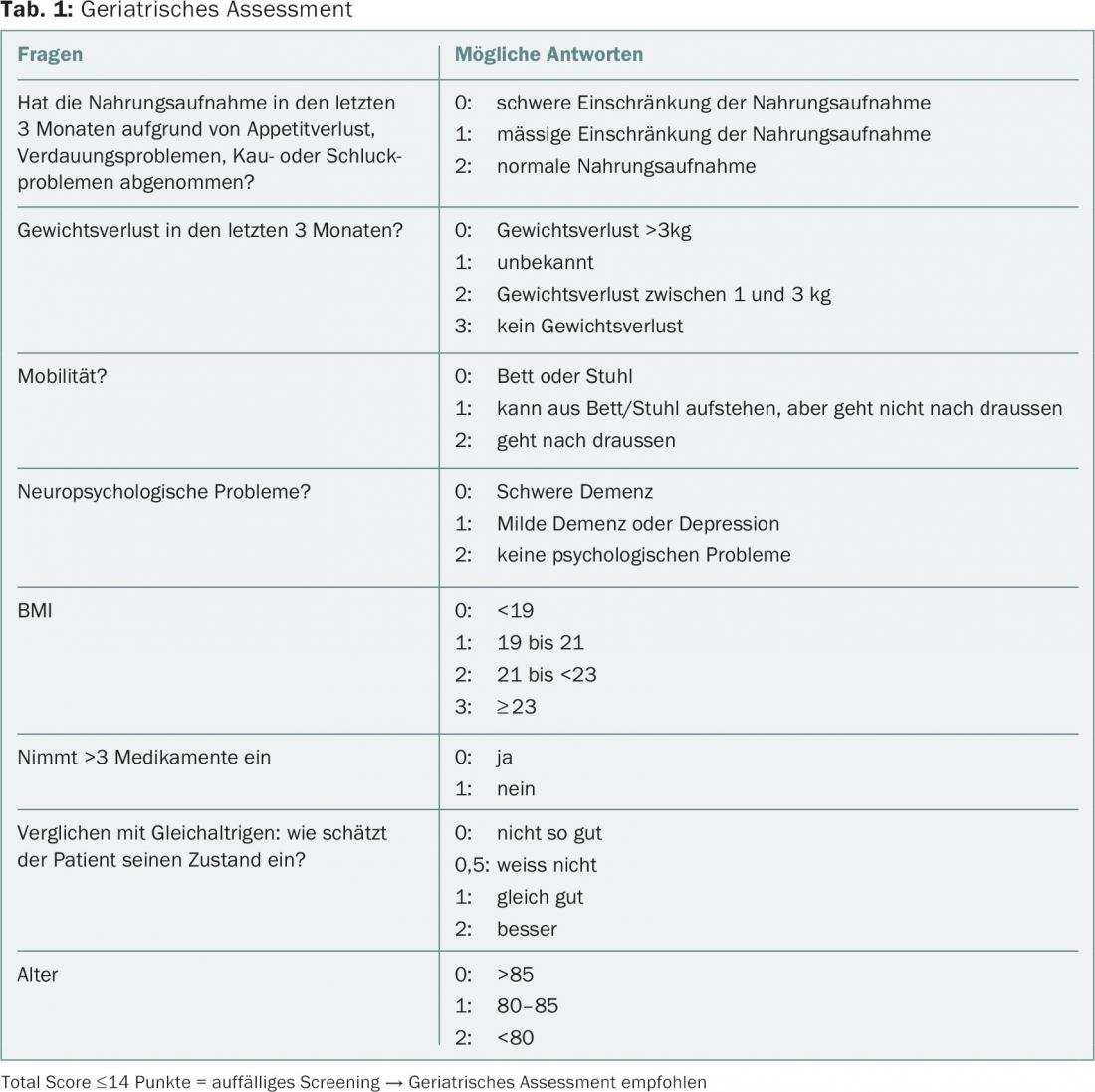
La cuestión de cuándo un paciente es un anciano aún no se ha definido de forma vinculante. Los geriatras suelen elegir el límite de edad de 70 años porque se supone que las personas de esta edad pueden tener una vulnerabilidad mayor por término medio. Sin embargo, sabemos que la edad biológica de una persona puede diferir significativamente de su edad cronológica. Un estudio realizado el año pasado mostró una variación de la edad biológica de 28 a 61 años en personas de 38 años [3]. Por lo tanto, a menudo no es fácil decidir si se debe suponer que un paciente “mayor” tiene un riesgo individualmente mayor de sufrir efectos secundarios relevantes debido a la terapia oncológica. Las evaluaciones geriátricas pueden ayudar a recopilar parámetros objetivos y relevantes sobre la función y la cognición, pero consumen mucho tiempo y, por lo tanto, son inadecuadas para su uso inespecífico en la práctica clínica diaria para todos los pacientes de un grupo de edad definido. Por ello, la Sociedad Internacional de Oncología Geriátrica (SIOG) recomienda el uso de herramientas de cribado, además del registro del estado funcional y las comorbilidades, que pueden dar indicaciones sobre si un paciente podría beneficiarse de una evaluación detallada. Debido a su alta sensibilidad para detectar la fragilidad, el G8 (Tab. 1 ) tiene una prioridad ligeramente superior a otras evaluaciones breves [4].
¿Y las pruebas?
Otro problema con respecto a las decisiones terapéuticas en pacientes de edad avanzada es la falta de pruebas, porque los estudios suelen excluir sistemáticamente a estos pacientes. Un estudio de 2015 mostró que en el 47% de todos los pacientes de una clínica de oncología radioterápica de Seattle, las decisiones de tratamiento debían tomarse sin pruebas de nivel I basadas en ensayos aleatorizados [5]. La aplicabilidad directa de los resultados de estudios generados en poblaciones más jóvenes a una población de pacientes de mayor edad no es posible por muchas razones. Para numerosas entidades tumorales, se ha podido demostrar que la edad de los pacientes y la comorbilidad concomitante influyen: 1) el pronóstico de supervivencia, así como el curso natural de la enfermedad; 2) la tolerabilidad de la radioterapia o del tratamiento multimodal en términos de calidad de vida, morbilidad y mortalidad; 3) la eficacia de la radioterapia y la terapia multimodal en términos de supervivencia y ausencia de recidiva; 4) la indicación de nosotros los oncólogos y radiooncólogos [9 –11]. A continuación, para las cuatro enfermedades tumorales más comunes, se dan ejemplos de cómo la edad desempeña un papel en las decisiones clínicas actuales.
Carcinoma de mama
En el carcinoma de mama, la radioterapia del resto de la mama, incluida la saturación del lecho tumoral local (boost), reduce significativamente la tasa de recidiva local independientemente de la edad, aunque el riesgo absoluto de recidiva local también disminuye con el aumento de la edad. Por lo tanto, con el aumento de la edad y los parámetros favorables del pronóstico tumoral (por ejemplo, el tamaño del tumor, la gradación), la influencia del control local y, por lo tanto, de la radioterapia local en la supervivencia se hace menor. Por lo tanto, la radioterapia debe evaluarse de forma crítica en pacientes de edad avanzada sin factores de riesgo específicos del tumor ni enfermedades concomitantes relevantes. La radiación debería hipofraccionarse en sólo 20 en lugar de 25 sesiones de tratamiento. Del mismo modo, en pacientes mayores sin factores de riesgo, puede prescindirse de la saturación del lecho tumoral. Otro enfoque para este grupo de riesgo podría ser la irradiación parcial de la mama; sin embargo, los resultados a largo plazo sobre esta cuestión aún están pendientes [12].
Carcinoma de próstata
Los pacientes ancianos con comorbilidad de moderada a grave mueren muy raramente de cáncer de próstata si se detecta sin factores de riesgo (valor alto de PSA, puntuación de Gleason alta, crecimiento más allá de la cápsula) [13]. En este caso, una estrategia de “vigilancia activa” tiene sentido. Por otro lado, las pacientes de más edad con poca comorbilidad y un estadio tumoral de riesgo intermedio o alto se benefician de la radioterapia en combinación con terapia hormonal (TH) a corto plazo. Para la comorbilidad grave, la ventaja de la TH en los grupos de riesgo intermedio y alto desaparece [14].
Carcinoma de bronquio
En los pacientes ancianos con cáncer de pulmón no microcítico localmente avanzado, la RT tiene una alta prioridad, ya que estos pacientes suelen ser inoperables. La radioterapia y la quimioterapia simultáneas mejoran la supervivencia global pero se asocian a un aumento significativo de la toxicidad aguda. En pacientes seleccionados, la RT aún puede combinarse con quimioterapia concomitante a dosis bajas [15]. En un estudio japonés, la esperanza de vida mejoró significativamente con el tratamiento combinado, sin que aumentara la mortalidad relacionada con la terapia.
Cáncer rectal
En el cáncer rectal, la radioterapia preoperatoria mejora la tasa de recidiva locorregional independientemente del estadio tumoral y también de la edad. Por ello, en pacientes de edad avanzada con un estado funcional muy bueno, no debe prescindirse de la terapia multimodal sin una buena razón [16]. Sin embargo, si existen comorbilidades relevantes, debe optarse por un procedimiento diferenciado, que bien puede permitir prescindir de una resección rectal en caso de remisión clínica completa tras radio(quimio)terapia en la resonancia magnética y rectoscopia. En la clínica, se utiliza la radioquimioterapia combinada (45-50 Gy en fracciones de 1,8 Gy combinada con capecitabina p.o.) para los tumores localmente avanzados o, alternativamente, el régimen corto consistente en 5 sesiones de 5 Gy cada una, que debería preferirse en pacientes de edad avanzada con el mismo resultado oncológico y una calidad de vida comparable [17].
Importancia de la radioterapia de precisión en el paciente anciano
Hoy en día, los avances técnicos y metodológicos en radiooncología permiten concentrar la dosis de radiación en el tumor preservando el tejido normal circundante. La radioterapia estereotáctica en la zona del tronco corporal (SBRT) agrupa estos avances técnicos y permite una radiación tumoral altamente precisa en unas pocas sesiones de tratamiento. Esta terapia es especialmente adecuada para pacientes de edad avanzada debido a su perfil de toxicidad favorable, la ausencia de invasividad y la corta duración del tratamiento ambulatorio.
En el CPNM estadio I, la SBRT ya ocupa un lugar firme en las directrices internacionales (ESMO, NCCN) cuando la resección quirúrgica con colgajo no es posible con seguridad debido a la edad y las comorbilidades. La SBRT puede utilizarse con seguridad y eficacia incluso en pacientes de >80 años: En >300 pacientes con una mediana de edad de 79-85 años, no se ha producido ni una sola toxicidad de grado V inducida por la SBRT y se han observado toxicidades de grado III-IV en <3% de los pacientes. La muy buena tolerabilidad combinada con un elevado control tumoral local han conducido a una mejora significativa del pronóstico de estos pacientes con SBRT, a pesar de la edad avanzada o las comorbilidades [18]. En un análisis recientemente muy publicado de dos estudios de fase III, la SBRT se estableció incluso como una posible alternativa a la cirugía en la situación operable. También es significativo que estos excelentes resultados de la SBRT pudieran confirmarse fuera de estudios prospectivos en países de habla alemana en 582 pacientes [19].
Aunque hasta ahora sólo se dispone de pruebas tan elevadas para el CPNM en estadio inicial, esta experiencia puede extrapolarse sin duda si la terapia local se indica en general sobre la base de la evaluación oncológica. En el contexto de las denominadas oligometástasis, la SBRT representa una terapia suave, no invasiva y localmente muy eficaz que se ha utilizado con éxito para las metástasis de pulmón, hígado, suprarrenales y ganglios linfáticos [20]. Actualmente se están evaluando científicamente otras indicaciones como la radiación estereotáctica primaria del carcinoma de próstata, los tumores primarios de hígado y los pequeños carcinomas de células renales inoperables.
Literatura:
- Smith BD, et al: Futuro de la incidencia del cáncer en Estados Unidos: cargas sobre una nación que envejece y cambia. J Clin Oncol 2009; 27(17): 2758-2765.
- Oficina Federal de Estadística (OFS), Instituto Nacional de Epidemiología y Registro del Cáncer (NICER), Registro Suizo de Cáncer Infantil (SCRC). Informe suizo sobre el cáncer 2015. Situación y evolución. Neuchâtel 2016.
- Belsky DW, et al: Cuantificación del envejecimiento biológico en adultos jóvenes. Proc. Natl. Acad. Sci. U.S.A 2015; 112 (30): E4104-E4110.
- Decoster L, et al: Herramientas de detección de problemas de salud multidimensionales que justifican una evaluación geriátrica en pacientes mayores con cáncer: una actualización de las recomendaciones de la SIOG. Ann Oncol 2015; 26: 288-300.
- Apisarnthanarax S, et al: Aplicabilidad de los ensayos aleatorios en oncología radioterápica a la práctica clínica habitual. Cáncer 2013; 119(16): 3092-3099.
- Poortmans PM, et al: Irradiación mamaria interna y supraclavicular medial en el cáncer de mama. N Engl J Med 2015; 373(4): 317-327.
- Whelan TJ, et al: Irradiación ganglionar regional en el cáncer de mama en estadio inicial. N Engl J Med 2015; 373(4): 307-316.
- Bradley JD, et al: Radioterapia conformada de dosis estándar frente a radioterapia conformada de dosis alta con carboplatino más paclitaxel concurrente y de consolidación con o sin cetuximab para pacientes con cáncer de pulmón no microcítico en estadio IIIA o IIIB (RTOG 0617): un estudio de fase 3 aleatorizado y factorial de dos por dos. Lancet Oncol 2015; 16(2): 187-199.
- Elomrani F, et al: Gestión del cáncer de mama precoz en mujeres mayores: del cribado al tratamiento. Cáncer de mama (Dove Med Press) 2015; 7: 165-171.
- Blanco R, et al: Una revisión del tratamiento de los pacientes ancianos con cáncer de pulmón no microcítico. Ann Oncol 2015; 26(3): 451-463.
- Droz JP, et al: Tratamiento del cáncer de próstata en pacientes de edad avanzada: recomendaciones actualizadas de un grupo de trabajo de la Sociedad Internacional de Oncología Geriátrica. The Lancet Oncology 2014; 15(9): e404-414.
- Vaidya JS, et al: Radioterapia intraoperatoria dirigida adaptada al riesgo frente a radioterapia de toda la mama para el cáncer de mama: resultados a 5 años para el control local y la supervivencia global del ensayo aleatorizado TARGIT-A. Lancet 2014; 383(9917): 603-613.
- Daskivich TJ, et al: Sobretratamiento de hombres con cáncer de próstata de bajo riesgo y comorbilidad significativa. Cáncer 2011; 117(10): 2058-2066.
- Nguyen PL, et al: Radiación con o sin 6 meses de terapia de supresión androgénica en cáncer de próstata clínicamente localizado de riesgo intermedio y alto: un análisis postrandomización por grupos de riesgo. Int J Radiat Oncol Biol Phys 2010; 77(4): 1046-1052.
- Atagi S, et al: Radioterapia torácica con o sin dosis bajas diarias de carboplatino en pacientes ancianos con cáncer de pulmón no microcítico: un ensayo aleatorizado, controlado y de fase 3 del Grupo de Oncología Clínica de Japón (JCOG0301). Lancet Oncol 2012; 13(7): 671-678.
- Bhangu A, et al: Resultados de supervivencia de pacientes ancianos con cáncer rectal operados y no operados: un análisis de Vigilancia, Epidemiología y Resultados Finales. Revista europea de oncología quirúrgica : la revista de la Sociedad Europea de Oncología Quirúrgica y la Asociación Británica de Oncología Quirúrgica 2014; 40(11): 1510-1516.
- Guckenberger M, et al.: Comparación de la radioterapia preoperatoria de corta duración y la radioquimioterapia de larga duración para el cáncer de recto localmente avanzado. Strahlentherapie und Onkologie : Organ der Deutschen Röntgengesellschaft [et al] 2012; 188(7): 551-557.
- Haasbeek CJ, et al: Cáncer de pulmón en estadios iniciales en pacientes de edad avanzada: un estudio basado en la población sobre los cambios en los patrones de tratamiento y la supervivencia en los Países Bajos. Ann Oncol 2012; 23(10): 2743-2747.
- Guckenberger M, et al.: Seguridad y eficacia de la radioterapia corporal estereotáctica para el cáncer de pulmón no microcítico en estadio i en la práctica clínica habitual: un análisis de patrones de atención y resultados. J Thorac Oncol 2013; 8(8): 1050-1058.
- Widder J, et al: Oligometástasis pulmonares: ¿metastasectomía o radioterapia ablativa estereotáctica? Radiother Oncol 2013; 107(3): 409-413.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2016; 4(7-8): 6-10