El conocimiento de los marcadores moleculares de la leucemia podría ayudar a identificar a los pacientes de alto riesgo en el futuro. Además, existe la posibilidad de desarrollar más enfoques terapéuticos dirigidos. Algunas terapias ya aprobadas demuestran hasta qué punto merece la pena este camino hacia la terapia personalizada.
Si se estudia la patogénesis de las leucemias, lo primero que se suele observar es que el proceso es muy heterogéneo, al igual que la variedad de enfermedades leucémicas que se derivan de él. Principalmente, las leucemias se producen como resultado de cambios genéticos moleculares. Se ven afectados con especial regularidad los genes y productos génicos de, por ejemplo, BCR-ABL, p53, DNMT3A, etc. Pero, ¿qué papel diagnóstico y, sobre todo, terapéutico desempeñan estas mutaciones genéticas?
Las mutaciones genéticas y las aberraciones cromosómicas se producen de forma natural en todas las personas sanas a medida que aumenta la edad. En las personas mayores de 70 años, estos cambios genéticos pueden encontrarse en el 10-50% de todas las personas sometidas a la prueba. Sin embargo, no todas estas personas mayores desarrollan leucemia. En muchos casos, la enfermedad se desencadena por una acumulación clonal de mutaciones en la hematopoyesis. Esto significa que las células sanguíneas alteradas forman un clon numéricamente ampliado y se convierten así en determinantes del cuadro sanguíneo. Esta denominada hematopoyesis clonal (“hematopoyesis clonal de potencial indeterminado”, CHIP) es, según los conocimientos actuales, un factor de riesgo decisivo para la neoplasia hematológica. Además, las aberraciones cromosómicas en la sangre periférica y, en los hombres mayores, la pérdida del cromosoma Y en las células sanguíneas se consideran factores de riesgo para el desarrollo de la leucemia.
De marcadores genéticos y genes marcadores
La leucemia mieloide aguda (LMA) sigue asociándose con frecuencia a un pronóstico muy desfavorable. Para los pacientes de edad avanzada en particular, a menudo no existen opciones de terapia dirigida o sólo unas pocas. Sin embargo, las dianas genéticas (como FLT3, IDH1/2, BCL2) permiten ahora clasificar mejor a los pacientes y sus respectivos pronósticos (favorable, intermedio, malo) y también tratarlos con ayuda de las primeras terapias dirigidas.
Un cambio genético que se produce con no poca frecuencia es la mutación FLT3. Alrededor del 25% de los pacientes con LMA presentan uno o más alelos de este gen. La mutación se considera inestable y, por tanto, provoca diferentes sensibilidades terapéuticas, lo que sin duda desempeña un papel importante para los futuros regímenes de tratamiento. No obstante, el primer ensayo mundial de fase III específico de genotipo, denominado RATIFY [1], en pacientes con LMA y mutación FLT3 demostró que la midostaurina, un inhibidor multiobjetivo de la tirosina cinasa, aumentaba la supervivencia en combinación con la quimioterapia. Además, la supervivencia libre de acontecimientos aumentó de 3,2 a 8,2 meses. Así, después de más de 30 años, la ahora aprobada midostaurina se considera un verdadero avance en la terapia de la LMA.
Un “blockbuster” de futuras opciones terapéuticas en la LMA es el venetoclax, un fármaco que actúa como diana de células madre para BCL2 y que se encuentra actualmente en fase III de posible aprobación. Incluso en monoterapia, se han mostrado hasta ahora buenas tasas de respuesta (20% ORR) en ensayos con venetoclax en pacientes con LMA R/R. Además, el 70% de los encuestados vivieron más de doce meses. La respuesta al venetoclax fue rápida y duradera, con pocas recidivas.
Al igual que la LMA, la leucemia linfoblástica aguda (LLA) también es muy heterogénea desde el punto de vista molecular (más de diez subgrupos diferentes), por lo que la quimioterapia estándar según el enfoque “uno para todos” no puede ser realmente útil. En el futuro, sin duda habrá más movimiento en el tratamiento de estas entidades tumorales, por ejemplo en la búsqueda de TKI adecuados y, sobre todo, de enfoques procedentes de la inmunoterapia o la terapia celular CAR-T. Con el blinatumomab (anti-CD19) y la inotuzumab ozogamicina (anti-CD22), ya están en el mercado las primeras terapias aprobadas.
Después de la supervivencia viene la calidad de vida
Tras la introducción de los TKI en el tratamiento de la leucemia mieloide crónica (LMC), la tasa de supervivencia a 10 años de esta enfermedad es ahora de hasta el 83%, por lo que las posibilidades de supervivencia con LMC son aproximadamente las mismas que en la población general. Sin embargo, esto significa que para los pacientes con LMC ya no es sólo una cuestión de supervivencia. La supervivencia sin progresión, el perfil de efectos secundarios, la toxicidad a largo plazo y, sobre todo, la calidad de vida también desempeñan un papel importante para ellos. Para los oncólogos, sin embargo, la posibilidad de conseguir una remisión sin terapia en pacientes con LMC con medicación está en primer plano, porque esto conlleva efectivamente una mejor calidad de vida, menos efectos secundarios y menos toxicidad a largo plazo.
En la actualidad existen cinco fármacos originales en todo el mundo, de los cuales el imatinib, que también ha sido aprobado en este país, es sin duda uno de los conocidos “platos fuertes” del tratamiento moderno de la LMC. Por ejemplo, el imatinib mostró una supervivencia a 5 años en la LMC de más del 95%. Sin embargo, las aberraciones citogenéticas (cromosómicas) adicionales pueden reducir el éxito de la terapia. Por lo tanto, además de la PCR, se sigue recomendando la aspiración de médula ósea para la detección de alteraciones en pacientes con LMC.
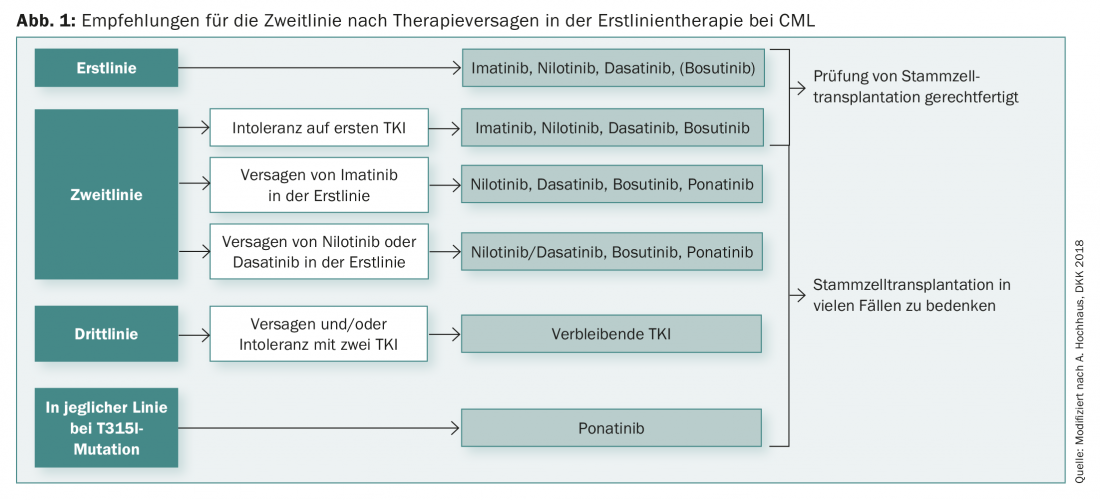
Sin embargo, la elección de la terapia de primera línea para la LMC no depende únicamente de la genética. Además, los objetivos terapéuticos individuales deben desempeñar un papel, así como cualquier enfermedad concomitante (comorbilidades). Para muchos pacientes, la cuestión de la deducibilidad de la terapia también es muy importante. También existen recomendaciones iniciales al respecto que, según los estudios actuales, permiten interrumpir la terapia en casos de remisión molecular profunda superiores a 18 meses para reducir los efectos secundarios, por ejemplo.
La duración de la remisión molecular profunda (durante al menos dos años) es entonces también un factor decisivo para la prevención de recaídas. Sin embargo, en muchos casos, la terapia es posible de nuevo incluso después de una recaída y el paciente puede alcanzar de nuevo la remisión con la terapia. Tras el fracaso de la terapia de primera línea, en la actualidad existe toda una gama de diversas opciones de segunda línea para la LMC (Fig. 1).
Fuente: 33º Congreso Alemán sobre el Cáncer, 21-24 de febrero de 2018, Berlín
Literatura:
- Stone RM, et al: N Engl J Med 2017; 377: 454-464.











