El estudio SOLO-1 fue uno de los temas “candentes” de la ESMO de este año. Una mejora de la SLP del 70% con buena tolerancia y eficacia no sólo en las recidivas hablan de una innovación relevante en la terapia del cáncer de ovario avanzado.
Pero desde el principio: Olaparib es un inhibidor de PARP (poli-[ADP-Ribose] polimerasas 1, 2 y 3). Las enzimas PARP son necesarias para reparar las roturas de cadena sencilla en el ADN. Si esta vía de reparación se bloquea en cierto modo, concretamente mediante el efecto del olaparib, se producen roturas de doble cadena en las células que se replican que, en presencia simultánea de mutaciones patógenas como BRCA1/2, tampoco pueden repararse y activan mecanismos alternativos propensos a errores. La falta de reparación en el ADN conduce finalmente a una inestabilidad insostenible del genoma a lo largo de varias rondas de replicación con la muerte de las células tumorales (que están más cargadas de daños en el ADN que las células normales). Lynparza® comprimidos recubiertos con película está aprobado en Suiza como monoterapia para pacientes con cáncer de ovario seroso de alto grado avanzado, sensible al platino y en recaída tras quimioterapia con platino (en presencia de remisión completa o parcial).
SOLO-1
La pregunta que SOLO-1 pretendía responder en la fase III era: ¿Es el olaparib también eficaz en el mantenimiento de carcinomas avanzados recién diagnosticados (es decir, no sólo en la situación de recaída)? ¿Es razonable y apropiado utilizar el nuevo agente en determinadas pacientes ya como estándar tras una quimioterapia con platino de primera línea exitosa y no sólo cuando la enfermedad recidiva?
Podría abreviar y decir: Sí, lo es – al menos para las mujeres con la enfermedad mutada BRCA. Se asignaron aleatoriamente al estudio 391 pacientes de este tipo con mutación (principalmente germinal) en BRCA1, -2 o ambos, con enfermedad serosa o endometrioide de “alto grado”, avanzada y recién diagnosticada, y que habían completado con éxito la quimioterapia con platino (respuesta parcial o completa). Al igual que en otros estudios, las pacientes con cáncer de trompa de Falopio y cáncer peritoneal formaron parte de la muestra debido a la similitud en el desarrollo del tumor y al comportamiento biológico tumoral común. Tras una mediana de seguimiento de más de tres años, más de la mitad del grupo de mantenimiento con olaparib seguía vivo y libre de progresión (60,4%), mientras que la proporción en el grupo placebo era menos de la mitad, con un 26,9% (HR 0,3, IC 95% 0,23-0,41; p<0,001). La diferencia en la mediana de supervivencia libre de progresión entre el placebo y el olaparib fue de unos tres años según el análisis de sensibilidad. La tabla 1 muestra otros resultados del estudio. De especial relevancia es la llamada SLP2, que también mejoró significativamente con olaparib. Concretamente, esto significa: También se amplió el tiempo hasta la progresión renovada o la muerte tras la terapia posterior. Por lo tanto, no cabe suponer un efecto perjudicial del olaparib precoz en las líneas de terapia posteriores.
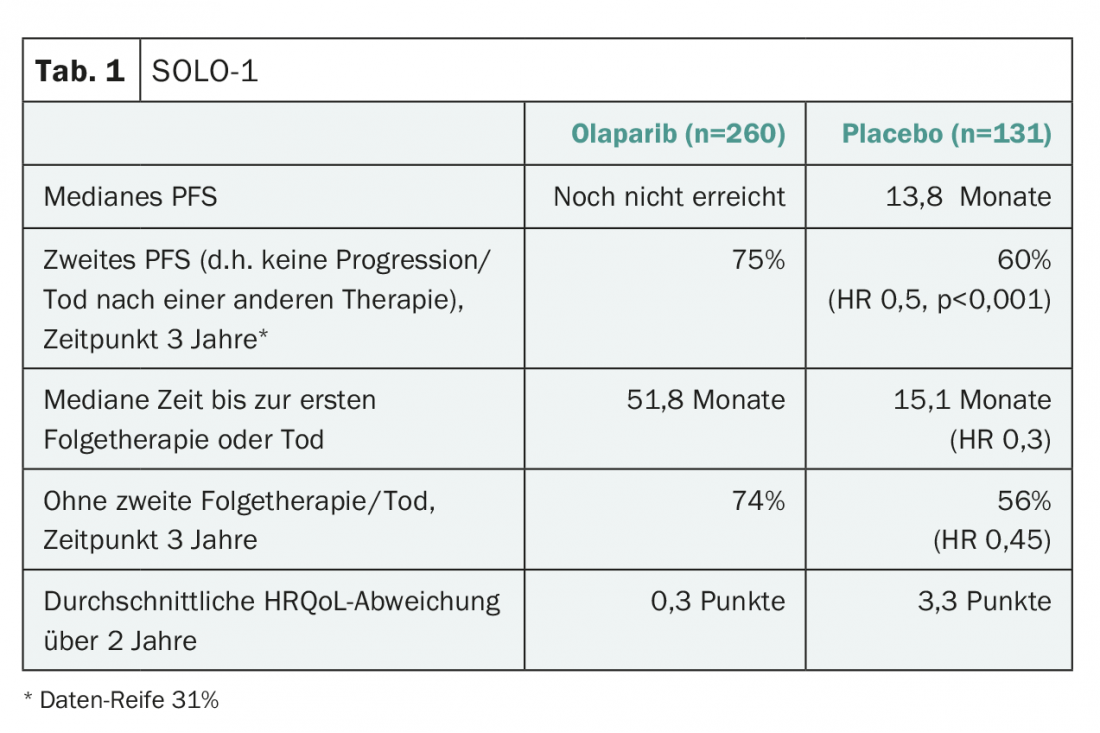
Los dos brazos de comparación estaban bien equilibrados al inicio, aproximadamente el 80% de los pacientes habían mostrado una respuesta completa a la quimioterapia y el estado de rendimiento ECOG era bueno. La mayoría se habían sometido a cirugía, aproximadamente el 60% a cirugía inicial (más del 70% de las cuales no presentaban enfermedad macroscópica residual), aproximadamente el 30% a cirugía citorreductora a intervalos (más del 80% de las cuales no presentaban enfermedad macroscópica residual). Los autores subrayaron en el congreso que se trataba de un grupo que tenía una probabilidad relativamente alta de “curarse” sólo con la terapia de primera línea. Así pues, el obstáculo para obtener un resultado significativo era probablemente relativamente alto.
El carcinoma ovárico
Una reducción del 70% del riesgo de progresión o muerte es un resultado asombrosamente bueno, teniendo en cuenta las características de la enfermedad: el cáncer de ovario es el quinto nuevo diagnóstico de cáncer más frecuente entre las mujeres europeas, y la mayoría de las afectadas tienen en ese momento entre 55 y 64 años. Alrededor del 16% de los tipos más comunes de cáncer de ovario presentan una mutación BRCA.
Dado que la detección en fases tempranas es un reto, alrededor de tres cuartas partes de las mujeres diagnosticadas ya presentan formas avanzadas. La quimioterapia (tras la cirugía) puede interferir en el crecimiento del tumor y ralentizarlo o detenerlo, pero rara vez evita que la enfermedad reaparezca a largo plazo. Aunque la terapia estándar se lleva a cabo con intención curativa, sólo unos pocos pacientes con enfermedad avanzada recién diagnosticada tienen la posibilidad de dicha curación. Al cabo de tres años, más del 70% de los tumores tratados recidivan. A partir de este momento, la enfermedad suele considerarse incurable en la actualidad. Por lo tanto, la tasa de supervivencia a largo plazo (aunque en aumento) sigue siendo baja, de poco más del 20% cinco años después del diagnóstico en el estadio III, y del 5% en el estadio IV.
¿Curación?
La muestra de SOLO-1 son mujeres con enfermedad avanzada. Este cuadro se encuentra con frecuencia en la práctica clínica diaria. El objetivo es proteger a estos pacientes lo mejor y durante el mayor tiempo posible de las consecuencias de una recidiva (temprana). Al menos para las pacientes con tumores con mutación BRCA, el estudio parece representar un gran avance en el desarrollo práctico. Una nueva norma está en el punto de partida. Por primera vez, la atención se centra en los carcinomas recién diagnosticados y no en la situación de las recidivas, en la que, además del olaparib, otros inhibidores de PARP también han progresado en los últimos años -en parte dependientes y en parte independientes de la mutación BRCA- y han sido aprobados en Europa (para las recidivas que se produjeron al menos seis meses después de interrumpir la terapia con platino).
La mortalidad, que se considera una de las más elevadas en comparación con otros tipos de cáncer en las mujeres, podría reducirse masivamente, es decir, retrasar la muerte, mediante el uso precoz del inhibidor de PARP. Por último, en SOLO-1, casi dos tercios de las mujeres estaban vivas y libres de progresión a los tres años y todavía algo más de la mitad estaban vivas y libres de progresión a los cuatro años (frente al 11% con placebo). En este contexto, es relevante que la terapia del estudio se interrumpiera al cabo de dos años en ausencia de evidencia de enfermedad. En caso de respuesta parcial (estable), se podía continuar; en caso de progresión, también se interrumpía. La duración del efecto se demostrará en observaciones de seguimiento a largo plazo. Lo cierto es que las curvas de Kaplan-Meier se mantuvieron prácticamente sin cambios (es decir, no convergieron más) incluso después de dos años y, por lo tanto, tras la interrupción de la terapia.
Por tanto, las esperanzas son grandes. Algunos expertos no temen utilizar la palabra “curación” en un ensayo (que, sin embargo, puede definirse de forma diferente para el cáncer y se declara principalmente en función de un determinado tiempo de supervivencia). ¿Aumenta realmente el principio activo el número de pacientes curados, y cómo de alta es esta proporción a largo plazo? En el futuro, ¿no será sólo el 20% de las mujeres en estadios avanzados las que sigan vivas cinco años después del diagnóstico, sino (significativamente) más? Por el momento, es imposible predecirlo con seguridad.
Así que tenemos que esperar, también hasta que los datos sobre la supervivencia global estén “maduros”, es decir, hasta que se disponga de un número de casos suficientemente elevado. Esto podría -en interés de los pacientes- llevar aún algún tiempo (en vista de que tampoco se ha alcanzado aún la mediana de la SLP). Actualmente, la madurez de los datos del sistema operativo es del 21%.
Ya se puede sacar una conclusión: Las pruebas genéticas tempranas, concretamente ya en el momento del diagnóstico, son cada vez más importantes y podrían plantear ciertos problemas logísticos en algunas regiones.
Los interrogantes siguen abiertos en cuanto a la evolución de los demás inhibidores de PARP, si las pacientes sin mutación BRCA también se beneficiarán y si el mantenimiento combinado con olaparib y bevacizumab podría aportar más ventajas. Sobre este último tema, el ensayo PAOLA-1 está en curso, y se esperan resultados en 2019.
Tolerabilidad buena
Los resultados son tanto más relevantes cuanto que la terapia fue en general bien tolerada. Esto se refleja sobre todo en la calidad de vida relacionada con la salud (CVRS) sin cambios desde el inicio del estudio con olaparib (tab. 1) . Por lo demás, los efectos secundarios correspondieron al perfil de seguridad conocido, fueron en su mayoría leves, bien controlados y, en torno al 12%, condujeron relativamente poco a la interrupción del tratamiento. De relevancia fueron principalmente la anemia y la neutropenia, que fueron de grado 3 o superior en el 22% y el 9%, respectivamente.
El estudio se publicó en la prestigiosa revista New England Journal of Medicine al mismo tiempo que se presentaba en el congreso [1].
Fuente: ESMO, 19-23 de octubre de 2018, Múnich
Literatura:
- Moore K, et al: Olaparib de mantenimiento en pacientes con cáncer de ovario avanzado recién diagnosticado. NEJM 2018 octubre 21. DOI: 10.1056/NEJMoa1810858 [Epub ahead of print].
InFo ONCOLOGÍA Y HEMATOLOGÍA 2018; 6(6); publicado el 25 de octubre de 2018 (antes de impresión).










