En el congreso de la ESMO celebrado en Ámsterdam, ponentes de varios países debatieron los últimos resultados y recomendaciones terapéuticas en el campo de la leucemia linfocítica crónica. En general, la quimioinmunoterapia con fludarabina, ciclofosfamida (FC) y el anticuerpo CD20 rituximab (R) muestra una buena eficacia, pero los métodos de tratamiento deben ser más específicos en el futuro y, sobre todo, aplicables también a las formas recurrentes, concluyen los expertos.
Según el Prof. Paolo Ghia, MD, Milán, en los últimos años se han realizado nuevos descubrimientos sobre la genética de la leucemia linfocítica crónica (LLC): “Por ejemplo, los estudios destacan la relevancia del empalme del pre-ARNm, un proceso celular crítico que puede contribuir a la leucemia linfocítica crónica [1, 2]. Además, las mutaciones periódicas de NOTCH1, MYD88 y XPO1 favorecen el desarrollo clínico de la enfermedad [3]”. En última instancia, sin embargo, la influencia de algunas mutaciones parece desaparecer cuando la terapia consiste en un trasplante alogénico de células madre hematopoyéticas [4].

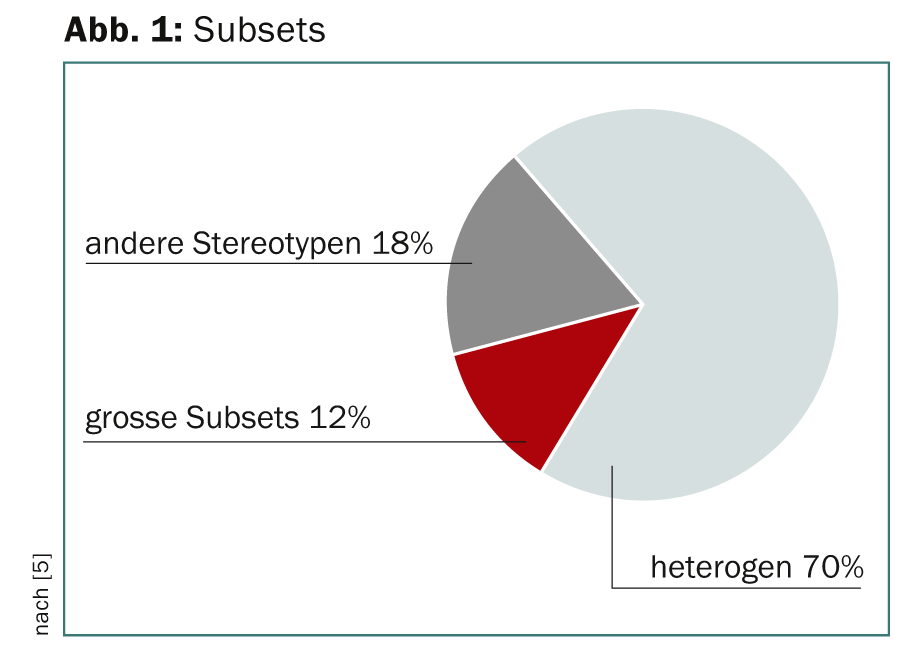
Desde el punto de vista funcional y pronóstico es relevante la suposición de que la LLC puede dividirse en diferentes subconjuntos con receptores de células B (BCR) estereotipados. Esto permitiría la clasificación molecular y las intervenciones terapéuticas dirigidas que se aplican a un gran número de pacientes del mismo subconjunto. Un análisis de secuencias reveló dos grupos supraordenados para los pacientes de LLC: Uno con BCR estereotipado y otro con BCR no estereotipado, con una proporción de 1:2 [5]. El 12% del grupo estereotipado formó grandes subconjuntos (Fig. 1).
Tratamiento de primera línea
El Dr. Peter Hillmen, de Leeds, presentó las vías de la terapia de primera línea de la LLC: “Los ensayos aleatorizados de fase III [6] concluyen que la terapia quimioinmune con fludarabina, ciclofosfamida y rituximab (FCR) mejora la supervivencia libre de progresión y global. Tres años después de la aleatorización (el segundo grupo se sometió a quimioterapia con fludarabina, ciclofosfamida), el 65% del primer grupo estaba libre de progresión, y sólo el 45% en el segundo. Los autores concluyen que una terapia específica de primera línea puede cambiar el curso natural de la LLC. Estos resultados definieron el nuevo estándar en el tratamiento de la LLC”. Si alguno de los siguientes criterios se aplica a un paciente, no se recomienda la combinación de dosis completa (FCR):
- Edad: 75 años o más
- Estado funcional 2 ó 3 de la OMS
- Restricciones cardiacas (clase II de la NYHA), respiratorias (bronquiectasias o EPOC moderada) o problemas renales.
Otras opciones terapéuticas
La cuestión de si la fludarabina es más eficaz que el clorambucil como monoterapia (primera línea) en pacientes mayores de 65 años es controvertida. Aunque la fludarabina consigue tasas de remisión significativamente superiores, no mejoran ni las tasas de supervivencia sin progresión ni las de supervivencia global en comparación con el clorambucilo [7].
El ofatumumab, un anticuerpo monoclonal humano (anti-CD20), muestra una buena eficacia y tolerancia en monoterapia en pacientes insensibles a la fludarabina, incluidos los tratados previamente con rituximab [8]. “Aún faltan estudios comparativos entre el ofatumumab y el rituximab. Lo que se sospecha es que la combinación de ofatumumab con clorambucil podría mejorar la supervivencia libre de progresión en comparación con la monoterapia con clorambucil”, afirmó el Dr. Hillmen.
Un nuevo anticuerpo anti-CD20 de tipo II llamado obinutuzumab (GA-101) también parece ofrecer un enfoque prometedor para una nueva terapia [9].
¿La terapia actual no es suficientemente eficaz?
A pesar de las muchas posibilidades: El Dr. Hillmen concluye que las vías de tratamiento actuales son ineficaces para la LLC. Esto se debe a varias razones:
Toxicidad: En primer lugar, se producen daños en las células normales. Además, las células de LLC desarrollan cada vez más resistencia. “Las terapias actuales no están dirigidas”, subrayó el Dr. Hillmen.
Eficacia: Sólo un pequeño número de pacientes logra una remisión verdadera y completa. Por tanto, las recaídas son inevitables y la mayoría acaba muriendo de LLC.
Por lo tanto, se necesitan urgentemente nuevos enfoques que traten de comprender mejor la fisiopatología, por ejemplo mediante el inhibidor de la tirosina cinasa ibrutinib, que en estudios multicéntricos iniciales de fase Ib/II permitió obtener tasas de remisión sostenidas en pacientes con LLC recidivante o persistente, incluidos aquellos con lesiones genéticas de alto riesgo [10].
Recurrencias LLC
En la LLC recurrente, el trasplante alogénico de células madre hematopoyéticas es la regla de oro porque conduce a un buen control de la enfermedad independientemente de las mutaciones [4].
El Prof. Dr. med. Stephan Stilgenbauer, de Ulm, describió la vía de tratamiento óptima del siguiente modo: “La LLC recidivante es una enfermedad biológica y clínicamente heterogénea, que debe abordarse inicialmente con una repetición del régimen de tratamiento inicial tras una remisión de >24 (-36) meses. Los estándares aquí son las terapias FCR, R-bendamustina, R-clorambucil. Desgraciadamente, no existe ningún tratamiento estándar satisfactorio para las recaídas después de 24-36 meses. El trasplante alogénico de células madre hematopoyéticas es una opción para los pacientes jóvenes de alto riesgo. Los nuevos agentes biológicos (antagonistas de la señalización BCR, inhibidores de BCL2, anticuerpos de tipo II, etc.) y las futuras combinaciones sin quimioterapia o al menos con quimioterapia reducida ofrecen esperanzas”.
Fuente: “Tratamiento de la leucemia linfocítica crónica”, sesión del 38º Congreso de la ESMO, del 27 de septiembre al 1 de octubre de 2013, Ámsterdam.
Literatura:
- Wang L, et al: N Engl J Med 2011; 365: 2497-2506. doi: 10.1056/NEJMoa1109016.
- Quesada V, et al: Nat Genet 2011 dic 11; 44(1): 47-52. doi: 10.1038/ng.1032.
- Puente XS, et al: Nature 2011 Jun 5; 475(7354): 101-105. doi: 10.1038/nature10113.
- Dreger P, et al: Blood 2013 Apr 18; 121(16): 3284-3288. doi: 10.1182/blood-2012-11-469627. epub 2013 Feb 22.
- Agathangelidis A, et al: Blood 2012; 119(19): 4467-4475.
- Hallek M, et al: The Lancet 2010; 376(9747): 1164-1174.
- Eichhorst BF, et al: Blood 2009 Oct 15; 114(16): 3382-3391. doi: 10.1182/blood-2009-02-206185. epub 2009 Jul 15.
- Wierda WG, et al: Publicado en línea antes de la impresión Blood 2011. doi: 10.1182/blood-2011-04-348656.
- Mössner E, et al: Blood 2010 Jun 3; 115(22): 4393-4402. doi: 10.1182/blood-2009-06-225979.
- Byrd JC, et al: N Engl J Med 2013; 369: 32-42. doi: 10.1056/NEJMoa1215637.
InFo Oncología y Hematología 2013; 1(1): 39-40
CongresoEspecial 2014; 6(1): 19-20