Los posibles tratamientos para los sarcomas de tejidos blandos incluyen cirugía, radioterapia y quimioterapia. Recientemente, se ha intentado intensificar los efectos exponiendo las células cancerosas al calor, con éxito.
En los adultos, los sarcomas de partes blandas son poco frecuentes en comparación con otros tipos de cáncer (en total, representan menos del 1% de todos los tumores malignos). La terapia se planifica individualmente y depende, entre otras cosas, de la localización, el tamaño del sarcoma y las metástasis. Las formas localizadas suelen someterse a cirugía combinada con radiación pre o postoperatoria, y la quimioterapia perioperatoria también se recomienda como opción para los pacientes de alto riesgo.
“Crisol” para las células cancerosas
En ensayos preclínicos, pero también en los primeros ensayos clínicos aleatorizados, se observaron efectos sinérgicos cuando la radio y la quimioterapia se combinaban con una exposición regional al calor de 40 a 43°C. El calor no sólo mata las células cancerosas por toxicidad térmica directa, sino que también aumenta el efecto de los fármacos o de las células cancerosas. sensibilización del tejido a la quimio o la radiación y, en última instancia, induce una respuesta inmunitaria (antitumoral) a través de proteínas de estrés y otros mecanismos de señales de alerta [1].
Un grupo de investigadores de Múnich demostró la viabilidad y eficacia del procedimiento para los sarcomas de alto riesgo ya en 1990 [2]. Pasaron muchos años más. El primer autor en aquel momento y uno de los científicos más activos en este campo, el Prof. Dr. med. Rolf D. Issels, del Hospital Universitario de Múnich, se quedó en el tema. En colaboración con centros universitarios de Noruega, Austria y EE.UU., así como con seis hospitales alemanes bajo la reciente dirección de Múnich, en 2010 se presentaron por primera vez los resultados de un ensayo aleatorizado de fase III que comparaba la hipertermia regional en combinación con quimioterapia neoadyuvante con la quimioterapia sola [3].
Para ello se utilizó el sistema de hipertermia BSD-2000. En un dispositivo reclinable en forma de anillo, la energía térmica de alta frecuencia se concentra selectivamente en la región diana del tratamiento, en el interior de las extremidades, la pelvis, el abdomen o el tórax. La llamada configuración phased array agrupa la energía de radiación mediante la disposición de radiadores individuales. Con las antenas phased array se consigue una fuerte directividad. En el lugar objetivo, la temperatura aumenta (el tejido que contiene agua se calienta por el acoplamiento de las ondas electromagnéticas), mientras que el sistema suprime la radiación en otros lugares. Todo está supervisado y controlado por ordenador y mediante sensores o “termostato”. La temperatura objetivo del estudio fue de 42°C (es decir, fiebre muy alta) durante una hora los días 1 y 4 de cada ciclo de quimioterapia.
De los 341 adultos aleatorizados con sarcomas de partes blandas localizados de alto riesgo, casi todos se sometieron a una (re)resección y unos dos tercios por grupo recibieron radioterapia. Por término medio, los pacientes recibieron dosis de radiación de 53,2 frente a 52,7 Gy. La terapia neoadyuvante consistió en los dos agentes quimioterapéuticos más activos en este campo, la doxorrubicina y la ifosfamida. Este último funciona con mayor eficacia a temperaturas de 40,5 a 43°C. Además, se administró etopósido, que, según los autores, podría omitirse en el futuro, ya que sólo tiene una baja actividad en los sarcomas de tejidos blandos. Se utilizaron los mismos agentes para la terapia postinducción (de nuevo con o sin hipertermia) tras la resección y/o la radiación, a la que se sometieron por completo aproximadamente la mitad de los pacientes de cada grupo (más en el grupo de hipertermia).
Eficacia a largo plazo confirmada
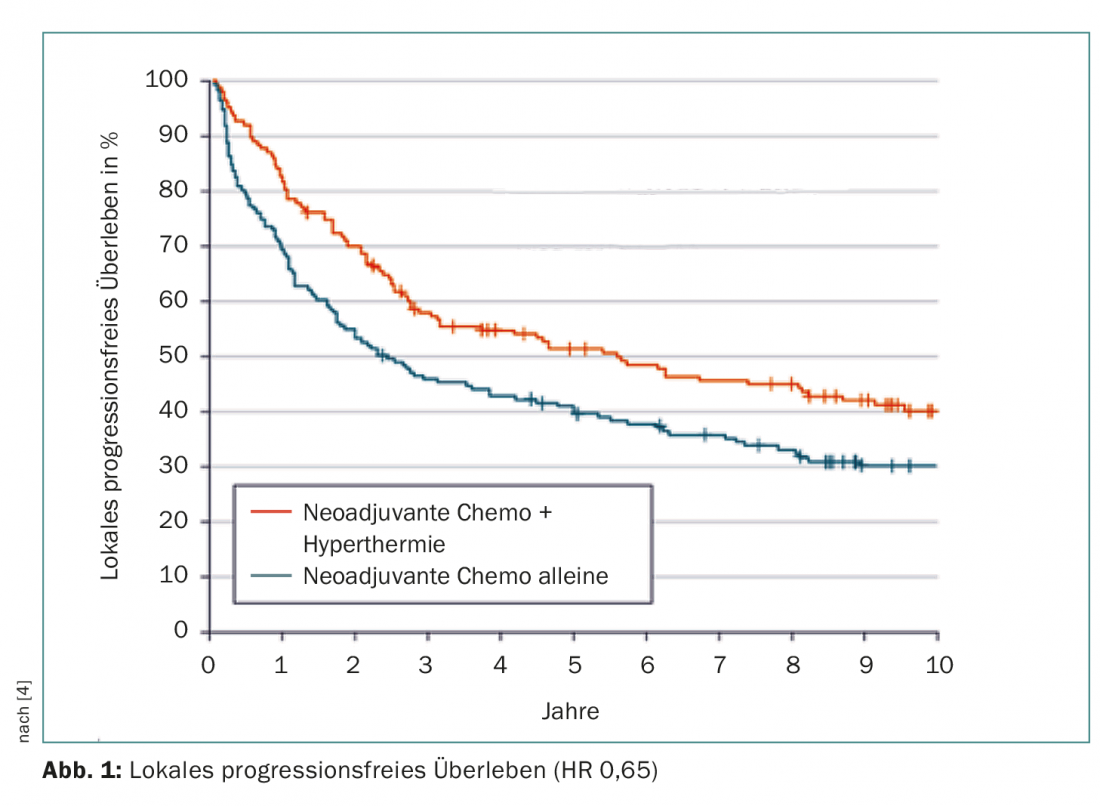
En diciembre de 2014 finalizó la recopilación de datos. En este punto, tras una mediana de más de once años de seguimiento, la adición de hipertermia había reducido la probabilidad de progresión local o muerte en un 35% (HR 0,65; IC 95% 0,49-0,86; p=0,002). Este fue el criterio de valoración principal. Las curvas divergieron rápidamente desde el inicio del estudio, se evitó eficazmente la progresión temprana (Fig. 1). El riesgo de mortalidad mejoró de forma similar, con una reducción significativa del 27% en el grupo de estudio (en el que sólo se analizaron los casos asociados a la enfermedad o al tratamiento), es decir, de unos buenos seis a unos 15 años. A los cinco años, el 62,7% frente al 51,3% y a los diez años, el 52,6% frente al 42,7% de las personas tratadas estaban vivas. Nueve pacientes necesitaron ser tratados con hipertermia para salvar a uno de la muerte en cinco años (Número Necesario a Tratar).
Los resultados a largo plazo [4] confirman la evaluación inicial que tuvo lugar en 2010. En ese momento, el criterio de valoración primario había mostrado una reducción del riesgo de más del 40% y un beneficio para la supervivencia en aquellos que habían completado la quimioterapia de inducción con hipertermia. El 28,8% frente al 12,7% respondió al tratamiento respectivo. El ensayo fue más eficaz en los sarcomas retroperitoneales y abdominales (no de extremidades).
Seguridad aceptable
En términos de seguridad, los resultados de la estrategia de tratamiento combinado fueron mixtos. Los autores hablaron de una “toxicidad moderada” y, en general, el tratamiento podía llevarse a cabo con seguridad. La terapia comparativa ya representa una carga para los pacientes, que sólo aumenta de forma limitada con la hipertermia. Si hubo una muerte asociada al tratamiento con quimioterapia sola, hubo dos con hipertermia simultánea. Las leucopenias graves fueron significativamente más frecuentes, también se encontraron trombocitopenias en el 17% frente al 13,8% de los casos (posiblemente debido al tratamiento térmico conjunto de la médula ósea, especialmente en tumores abdominales o pélvicos grandes). Los pacientes pueden haber sido más susceptibles a estos efectos de la quimioterapia debido al calor. También hubo varios efectos secundarios específicos, como dolor y diversos grados de quemaduras en la piel. La presión de las “almohadas” de silicona/agua que rodean al paciente en el aplicador (y que tienen por objeto dirigir las ondas a la zona de cobertura) resultó a veces incómoda y puede haber promovido vómitos y neurotoxicidad local en algunos casos, especialmente en pacientes tras cirugía y radioterapia.
Sigue siendo cuestionable si el balance riesgo-beneficio del enfoque terapéutico sería así también positivo en pacientes con menor riesgo. La hipertermia también se está probando actualmente en un gran ensayo de fase III en carcinomas pancreáticos resecados.
Literatura:
- Issels RD: La hipertermia se suma a la quimioterapia. Eur J Cancer 2008 Nov; 44(17): 2546-2554.
- Issels RD, et al: Ifosfamida más etopósido combinado con hipertermia regional en pacientes con sarcomas localmente avanzados: un estudio de fase II. J Clin Oncol 1990; 8(11): 1818-1829.
- Issels RD, et al: Quimioterapia neoadyuvante sola o con hipertermia regional para el sarcoma de tejidos blandos localizado de alto riesgo: un estudio multicéntrico aleatorizado de fase 3. Lancet Oncol 2010 Jun; 11(6): 561-570.
- Issels RD, et al: Effect of Neoadjuvant Chemotherapy Plus Regional Hyperthermia on Long-term Outcomes Among Patients With Localized High-Risk Soft Tissue Sarcoma. El ensayo clínico aleatorizado EORTC 62961-ESHO 95. JAMA Oncol 2018. DOI:10.1001/jamaoncol.2017.4996 [Epub ahead of Print].
InFo ONCOLOGÍA & HEMATOLOGÍA 2018; 6(3): 5-6.