Los inhibidores de la poli-ADP-ribosa polimerasa (PARP) han añadido valiosas opciones al panorama del tratamiento del cáncer de ovario avanzado y ya se han hecho un hueco en las directrices de la ASCO y la NCCN. [1–3]. Con la incorporación de otro inhibidor de PARP a la lista de especialidades, ahora más pacientes pueden beneficiarse de la terapia de mantenimiento de primera línea [4].
Desde octubre de 2021, los costes de la terapia de mantenimiento de primera línea del cáncer de ovario avanzado con el inhibidor de PARP niraparib (Zejula®) están cubiertos por los fondos del seguro de enfermedad* [4, 5]. La ampliación de la indicación se basa en los datos positivos del ensayo doble ciego de fase III PRIMA, en el que 733 pacientes con cáncer de ovario avanzado fueron aleatorizadas al tratamiento con niraparib o placebo tras haber respondido a la quimioterapia basada en platino. El niraparib duplicó con creces la mediana de supervivencia libre de progresión (SLP) en pacientes con deficiencia de recombinación homóloga (HRD) y redujo el riesgo de progresión o muerte en un 57%. Tanto las pacientes con mutación BRCA como las que no la tenían se beneficiaron de este tratamiento(tabla) [6].
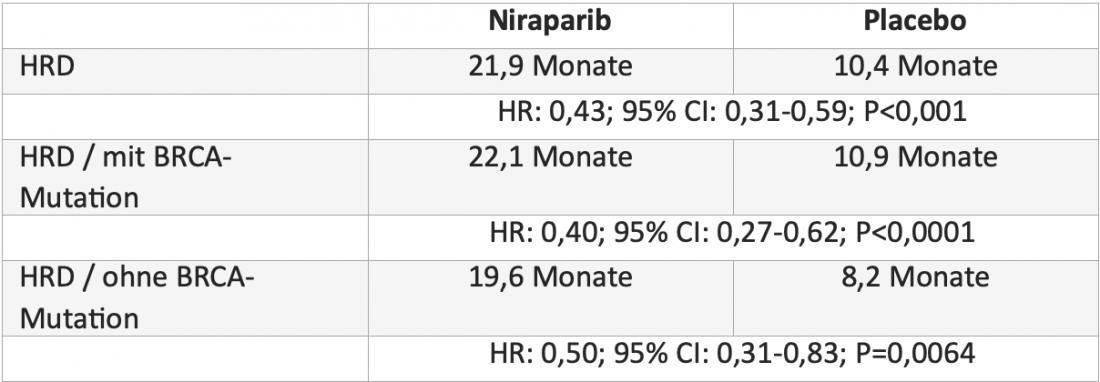 Mesa: Mediana de supervivencia libre de progresión con niraparib frente a placebo en pacientes con deficiencia de recombinación homóloga (HRD) en el ensayo aleatorizado doble ciego de fase III PRIMA [6].
Mesa: Mediana de supervivencia libre de progresión con niraparib frente a placebo en pacientes con deficiencia de recombinación homóloga (HRD) en el ensayo aleatorizado doble ciego de fase III PRIMA [6].
Compatibilidad establecida y facilidad de uso [5, 7].
Los efectos secundarios del niraparib podrían reducirse en su mayor parte interrumpiendo la terapia o reduciendo la dosis. En este contexto, la dosificación inicial individualizada basada en el peso corporal y el recuento de plaquetas contribuye a reducir los efectos secundarios sin disminuir la eficacia [5, 8]. La calidad de vida relacionada con la salud tampoco se ve afectada por el niraparib [6]. Con la ingesta oral una vez al día, que puede tomarse independientemente de las comidas en cualquier momento del día, el tratamiento también resulta práctico y sin complicaciones para los pacientes [5].
Niraparib recomendado por las directrices [3].
Según las directrices actuales de la ASCO sobre el uso de inhibidores de PARP, a todas las pacientes con cáncer de ovario epitelial seroso de alto grado en estadio III a IV de diagnóstico reciente que hayan tenido una respuesta completa o parcial a la quimioterapia de primera línea basada en platino se les debe ofrecer terapia de mantenimiento con niraparib, independientemente del estado BRCA [3]. El tratamiento con niraparib también se recomienda en las directrices de la NCCN independientemente del estado del BRCA [2].
Conclusión
El niraparib es la única monoterapia oral con inhibidor de PARP una vez al día aprobada para el tratamiento de mantenimiento de primera línea de pacientes con cáncer de ovario avanzado y DRH, independientemente del estado BRCA [5, 9]. Con su perfil de seguridad establecido y su manejabilidad práctica, el inhibidor de PARP ofrece una opción de tratamiento fácil de usar para el paciente con una eficacia demostrada [5, 6].
El anticuerpo anti-PD-1 dostarlimab ya está aprobado como opción de tratamiento para el cáncer de endometrio (CE) recurrente o avanzado. [10]El dostarlimab (Jemperli) está aprobado en Suiza desde febrero de 2022 como la primera inmunoterapia para el tratamiento de pacientes con CE en recaída o avanzado con reparación defectuosa de los errores de emparejamiento del ADN (dMMR)/alta inestabilidad de microsatélites (MSI-H) que fue progresivo durante o después de la terapia basada en platino [10,11]. La aprobación se basa en los datos del estudio de fase I multicéntrico y de un solo brazo GARNET, en el que dostarlimab produjo una respuesta duradera y clínicamente significativa (tasa de respuesta objetiva: 42,3%) en el total de 104 pacientes con dMMR/ MSI-H estudiados. El perfil de efectos secundarios era manejable. Las reacciones adversas de tercer grado o superior más frecuentes fueron anemia (2,9%), colitis (1,9%) y diarrea (1,9%) [12]. |
*con limitatio
Literatura:
Responsable del contenido y financiado por GlaxoSmithKline AG, Talstr. 3-5, 3053 Münchenbuchsee.
Las marcas registradas pertenecen a sus respectivos propietarios. 2022 Grupo de empresas GSK o su licenciante.
Breve información técnica Zejula
Breve información temática Jemperli