El trabajo en equipo entre el médico de cabecera, el nefrólogo, el centro de trasplantes y el paciente es esencial. El 50% de los pacientes trasplantados mueren con un trasplante de riñón en funcionamiento. En la fase inicial tras el trasplante, la atención se centra en ajustar la inmunosupresión y registrar el rechazo y las infecciones en particular. El tratamiento de las complicaciones no inmunológicas, especialmente los factores de riesgo cardiovascular, es extremadamente importante. Deben realizarse controles tumorales regulares, especialmente de la piel. Sea siempre consciente de las interacciones entre medicamentos, especialmente en el caso de los inmunosupresores.
El trasplante renal es el procedimiento de sustitución renal preferido para la mayoría de los pacientes con insuficiencia renal crónica y se asocia con la mejor calidad y esperanza de vida para el paciente. La supervivencia a los 5 años del trasplante de riñón es actualmente superior al 70% para los órganos procedentes de donantes fallecidos, e incluso superior al 80% para las donaciones en vida [1].
En la actualidad, cerca del 50% de los receptores de trasplantes con injertos funcionales mueren debido a complicaciones cardiovasculares, seguidas de tumores e infecciones graves. Por lo tanto, el seguimiento regular y el tratamiento de las comorbilidades desempeñan un papel crucial. El resultado a largo plazo de un trasplante depende en gran medida de la calidad y la regularidad de los cuidados de seguimiento. Aquí es crucial una buena cooperación entre el médico de familia y el centro de trasplantes.
Fase temprana tras el trasplante
La fase inicial del seguimiento (primer año postoperatorio) se realiza predominantemente de forma directa en el centro de trasplantes, con intervalos de tiempo para el control que se amplían hasta tres meses después de la fase inicial. Tras el primer año, el nefrólogo cercano al domicilio del paciente se hace cargo de la mayor parte de los cuidados regulares en colaboración con el médico de cabecera, complementados con revisiones anuales en el centro de trasplantes.
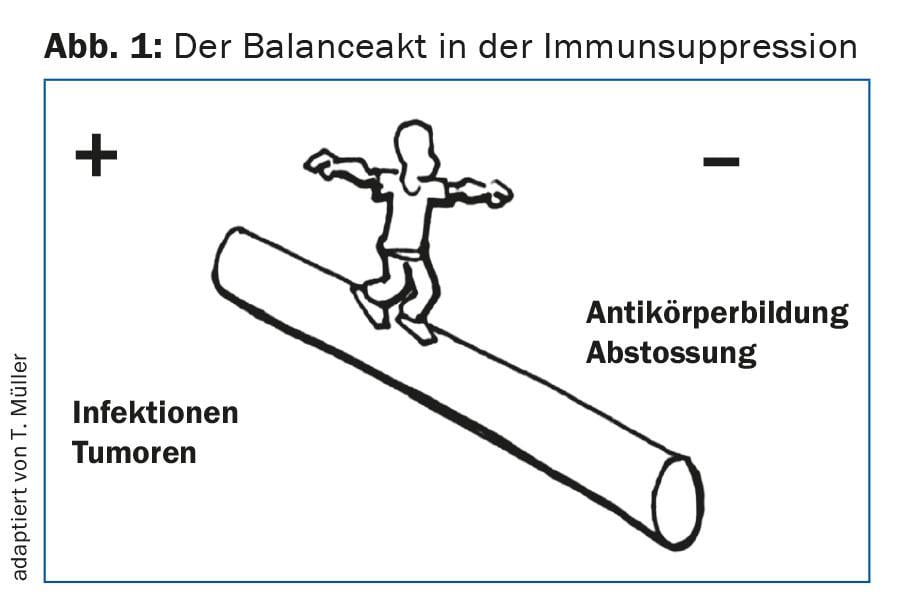
El seguimiento estrecho inicial es necesario para la detección precoz de complicaciones inmunológicas agudas como las reacciones agudas de rechazo. Para prevenirlo, es decir, para evitar la subinmunosupresión o la sobreinmunosupresión, es necesario un ajuste muy individualizado de la inmunosupresión (Fig. 1) . Además, es importante reconocer las infecciones, especialmente las víricas, en su fase inicial. Entre ellas se incluyen, en particular, la reactivación del CMV o las primoinfecciones por CMV, que pueden tener graves consecuencias si no se tratan [2]. Además, es necesaria una estrecha vigilancia para detectar una posible replicación del VKB (poliomavirus), ya que una viremia significativa por VKB puede provocar una nefropatía por VKB y ésta, si no se trata, puede conducir a una rápida pérdida de la función del injerto.
Controles en el curso a largo plazo
En el curso a largo plazo, se concede mayor importancia al registro en de las complicaciones no inmunológicas, incluido el control y el ajuste de la presión arterial, así como los posibles trastornos lipometabólicos y del metabolismo óseo.
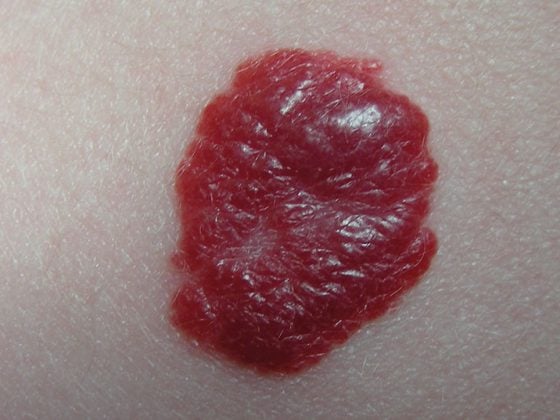
Debido a la mejora de la supervivencia a largo plazo de los pacientes de trasplante renal, ahora nos enfrentamos a las consecuencias de la terapia inmunosupresora a largo plazo. En este caso, debe mencionarse sobre todo el mayor riesgo de tumores cutáneos malignos. El cáncer de piel no melanoma (CPNM) representa la mayor proporción de todas las neoplasias malignas postrasplante, con un 40%. En el caso de los CPNM, el 90-95% son carcinomas de células escamosas y basales. El riesgo de padecer un carcinoma de este tipo es significativamente mayor en los pacientes inmunodeprimidos que en la población general [3], y el riesgo tumoral general es de aprox. aumentó de dos a tres veces [4]. Por esta razón, es crucial una estrecha vigilancia de la piel y puede ser necesario un cambio en la terapia inmunosupresora si se produce una NMSC.
Un factor importante en la fase tardía de los cuidados es el problema de los cambios crónicos en el injerto, que casi siempre se producen por razones que aún no están claras y acortan la vida funcional del injerto. La evolución de la creatinina y la proteinuria es crucial en el diagnóstico funcional. Un aumento de la creatinina superior al 15% requiere una aclaración. Para la excreción de proteínas, la determinación del cociente proteína-creatinina o albúmina-creatinina en la orina espontánea suele ser suficiente. También en este caso, la evolución en el tiempo y el aumento de la excreción de proteínas son determinantes. Los cambios significativos deben discutirse con el centro de trasplantes. Si es necesario, deberá tomarse entonces una decisión sobre exámenes adicionales como la detección de anticuerpos contra el trasplante o una biopsia renal.
En la fase a largo plazo, es importante que en caso de enfermedad, deterioro de la función renal, fiebre, dolor o intolerancia a los medicamentos, se contacte una y otra vez con el centro de trasplantes, incluso fuera de las citas acordadas, ya que en estas situaciones a menudo se requiere una rápida aclaración, en cuyo contexto también podría ser necesario un tratamiento hospitalario.
Las automediciones de los pacientes son también una parte muy importante del seguimiento estándar. Esto incluye la medición de la tensión arterial, el pulso, la temperatura y el peso corporal, primero a diario y después de forma intermitente. En particular, un aumento de la temperatura corporal (normalmente un aumento de más de 0,5°C por encima del rango normal individual) y/o un aumento de peso significativo de un día para otro de más de 1 kg son signos de alarma que los pacientes deben comunicar.
Fármacos inmunosupresores
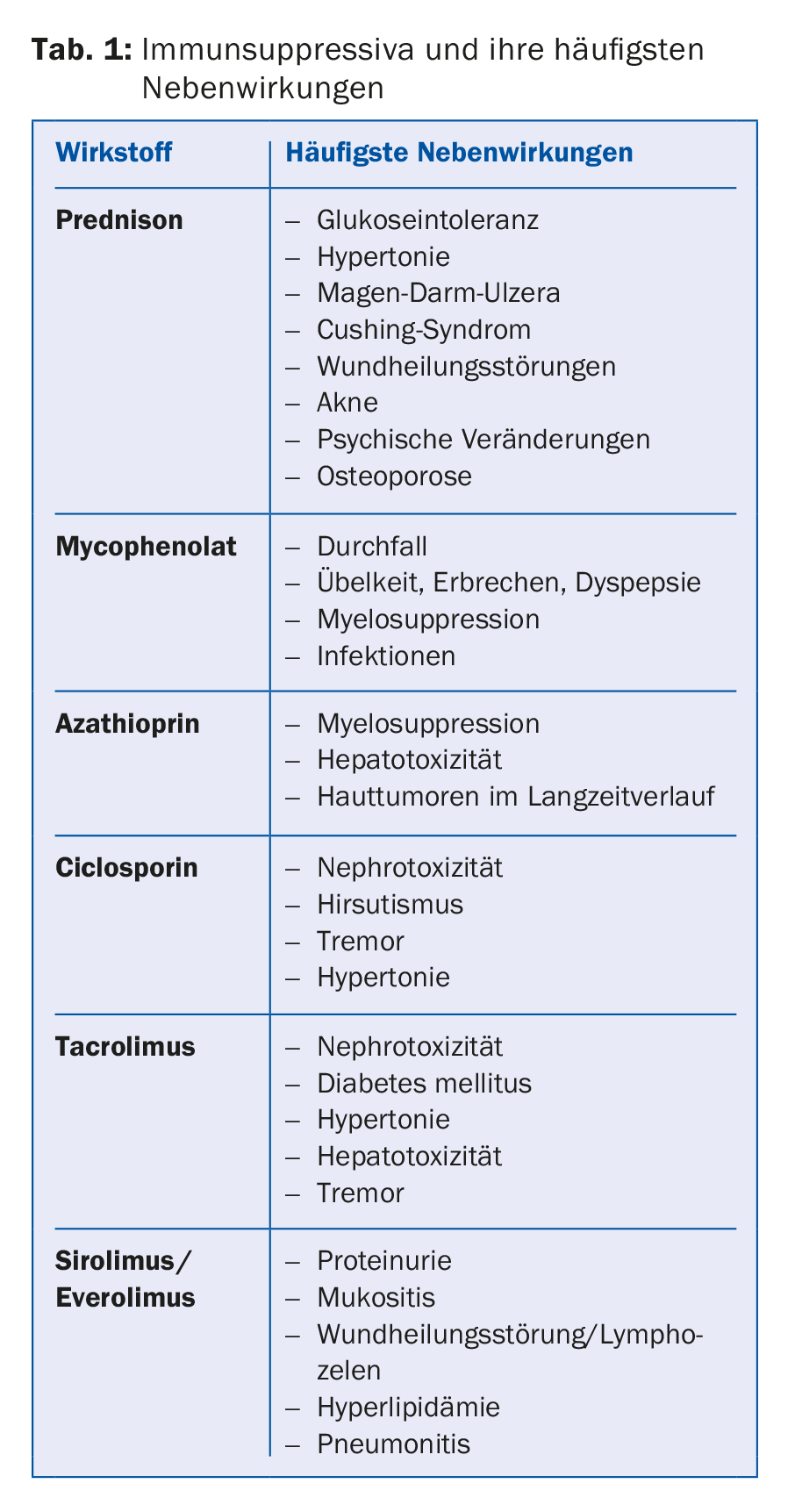
Con un trasplante, el paciente no se cura, debe tomar medicación regularmente de por vida. Por lo tanto, las cuestiones de los efectos secundarios y las interacciones deben discutirse siempre con el centro de trasplantes. La norma es la doble terapia para los pacientes con bajo riesgo inmunológico o la triple terapia para los pacientes con mayor riesgo. El tratamiento inmunosupresor suele consistir en un inhibidor de la calcineurina, normalmente tacrolimus (Prograf® o Advagraf®, este último es la forma de liberación sostenida del tacrolimus), en algunos casos alternativamente ciclosporina (Sandimmun Neoral®). Además, se utiliza una sustancia antiproliferativa, en la mayoría de los casos micofenolato (CellCept® o Myfortic®), más raramente azatioprina (Imurek®). En la fase postoperatoria temprana, se suele añadir un glucocorticoide como tercer inmunosupresor, que se retira progresivamente al cabo de unos seis meses en función del riesgo inmunológico y de las directrices del centro (tab. 1).
El ajuste de la dosis, especialmente de los inhibidores de la calcineurina, se realiza en función del llamado nivel valle, la determinación de la concentración de sustancia activa en la sangre doce horas después de la ingesta de la última dosis. Se persiguen niveles objetivo individuales, adaptados a la clínica (situación inmunológica, infección o complicaciones tumorales).
En cuanto a los inmunosupresores, deben utilizarse los preparados recomendados por el centro de trasplantes. Los cambios en la terapia, la dosis o el cambio a medicamentos genéricos sólo deben realizarse en consulta.
Los inhibidores de la calcineurina, como muchos otros fármacos, se metabolizan a través del CYP3A, por lo que debe extremarse la precaución al prescribir nuevos medicamentos debido a las posibles interacciones. Los antibióticos macrólidos en particular (especialmente la claritromicina y la eritromicina) pueden provocar una toxicidad grave de los inhibidores de la calcineurina al inhibir el CYP3A. Pero los medicamentos a base de plantas también tienen un alto potencial de interacción. Por ejemplo, puede producirse una reducción significativa de los niveles de inhibidores de la calcineurina con la hierba de San Juan, y un fuerte aumento con el zumo de pomelo, con el riesgo de rechazo consecutivo o sobreinmunosupresión.
Otros medicamentos
En los procedimientos dentales y las endoscopias con o sin biopsias, la profilaxis antibiótica no es obligatoria simplemente porque el paciente requiera inmunosupresión sistémica. La terapia antibiótica según el régimen de profilaxis de la endocarditis sólo suele estar indicada en pacientes que recibirían profilaxis antibiótica incluso sin inmunosupresión y/o si se planifican intervenciones en una zona infectada. En caso de duda, debe evaluarse la situación individual del paciente con el centro de trasplantes en función de su estado inmunitario.
En la terapia analgésica, los AINE y los inhibidores de la COX II deben evitarse a toda costa debido a los diversos efectos secundarios renales posibles (insuficiencia renal aguda inducida por vasomotores, nefritis tubulointersticial, retención de sal, etc.), como ocurre en general en todos los pacientes con función renal alterada.
La función renal debe tenerse en cuenta a la hora de dosificar el medicamento. En un trasplante que funciona muy bien, la tasa de filtración glomerular (TFG) suele ser superior a 60 ml/min y 1,73 m2 de superficie corporal. La dosis debe ajustarse para los diferentes rangos de TFG según la información del producto.
Infecciones urinarias
Las infecciones más comunes tras un trasplante de riñón son las infecciones del tracto urinario. En principio, en el curso a largo plazo sólo deben tratarse las infecciones urinarias sintomáticas. Antes de iniciar la terapia empírica (normalmente con ciprofloxacino o amoxicilina/ácido clavulánico), es imprescindible realizar un urocultivo para el tratamiento posterior en función de la resistencia.
En el caso de las infecciones urinarias recurrentes, la terapia empírica se selecciona en función de la resistencia previa a los antibióticos. Por otro lado, debe ponerse en contacto con el centro de trasplantes para aclarar las posibles causas (por ejemplo, reflujo en la edad del trasplante, etc.). Además, el consumo de arándanos rojos resp. Se recomienda el zumo de arándanos como medida profiláctica, en algunos casos también se puede hablar del uso de L-metionina para la acidificación urinaria.
Hiperuricemia y gota
Debido a la reducción del aclaramiento renal del ácido úrico, la hiperuricemia es una complicación frecuentemente observada del tratamiento con inhibidores de la calcineurina. Especialmente con ciclosporina, se han descrito ataques de gota en el 5-10% de los pacientes.
Para el tratamiento de un ataque agudo de gota, la administración a corto plazo de esteroides durante tres a cinco días (aprox. 20-50 mg/d). Los AINE deben evitarse estrictamente. La profilaxis con alopurinol no debe administrarse a pacientes en tratamiento continuo con azatioprina porque esta combinación puede provocar una neutropenia/agranulocitosis grave.
Diarrea y molestias gastrointestinales
La diarrea y las molestias gastrointestinales son un problema común en los pacientes inmunodeprimidos. Si un paciente se queja de diarrea (>3 heces líquidas/puras) que dura más de dos días, debe buscarse primero una causa infecciosa (bacteriología general de las heces, norovirus). En caso de persistencia y/o fiebre concurrente, el paciente debe ser enviado al centro de trasplantes (aclaración de la infección por CMV/colitis por CMV, etc.). Si se sospecha de diarrea inducida por fármacos, que se observa con frecuencia con el micofenolato, sobre todo cuando se desencadena por infecciones, puede ajustarse la dosis de inmunosupresores. En caso de diarrea, también está siempre indicado un control precoz del nivel de tacrolimus, ya que puede producirse un aumento de la absorción de tacrolimus y, por tanto, niveles elevados.
Factores de riesgo cardiovascular
Los factores de riesgo cardiovascular deben tratarse de forma coherente. La hipertensión arterial está presente en el 60-80% de los pacientes con trasplante renal [6]. En principio, pueden utilizarse todas las clases de antihipertensivos; al principio, suele emplearse principalmente un antagonista del calcio, utilizándose también inhibidores de la ECA o bloqueadores de los IRA (bloqueo del SRAA) si la función renal del trasplantado es estable. Si la proteinuria supera 1 g/24 h, una sustancia para el bloqueo del RAAS es la primera elección. El objetivo de tensión arterial para la mayoría de los pacientes trasplantados es de 130/80 mmHg (en mediciones domiciliarias), en algunos casos los valores objetivo deben fijarse individualmente.
La dislipidemia también debe tratarse de forma intensiva con medidas relacionadas con el estilo de vida, especialmente el control del peso. Sin embargo, a menudo también es necesario un tratamiento farmacológico con una estatina. El valor objetivo de LDL es <2,6 mmol/l. En este caso también deben tenerse en cuenta las interacciones con los inmunosupresores.
Siempre se debe motivar a los fumadores para que dejen de consumir nicotina y se les deben ofrecer programas para dejar de fumar. Los pacientes obesos pueden beneficiarse del asesoramiento nutricional. Se recomienda la profilaxis con ácido acetilsalicílico para la enfermedad cardiovascular aterosclerótica.
Diabetes mellitus
A menudo, la diabetes mellitus sólo reaparece tras el trasplante. En concreto, el tacrolimus, el sirolimus, la terapia con esteroides y la edad avanzada son factores de riesgo de la denominada “Nueva aparición de diabetes tras el trasplante” (NODAT). Además de las medidas habituales relacionadas con el estilo de vida y los fármacos antidiabéticos orales como los inhibidores de la DPP4 (sitagliptina), a menudo se considera la insulina al inicio del tratamiento de la NODAT. Si la inmunosupresión puede reducirse en el curso del tratamiento, el metabolismo de la glucosa vuelve a la normalidad en algunos pacientes. El objetivo terapéutico según las directrices KDIGO es una HbA1C <7-7,5%.
Deseo de tener hijos
Si desea tener hijos, es esencial que se ponga en contacto con el centro de trasplantes para hablar abiertamente de los riesgos y peligros. También suele ser obligatorio un cambio de medicación antes de un posible embarazo. Un embarazo en una mujer tras un trasplante de riñón es básicamente un embarazo de alto riesgo y requiere una atención interdisciplinar estrecha en el centro de trasplantes.
Vacunas y viajes
Por regla general, las vacunaciones completas -según la Recomendación suiza de vacunación para personas antes y después de un trasplante de órganos sólidos- ya deberían haberse realizado antes del trasplante en el momento de la inclusión en la lista. Tras el trasplante, las vacunas vivas como las de la rubéola o el sarampión están contraindicadas debido a la inmunosupresión. Todas las vacunas no vivas deben actualizarse regularmente según las recomendaciones de vacunación. También se recomienda la vacunación anual contra la gripe. Sin embargo, hay que tener en cuenta que la respuesta a la vacunación suele estar algo atenuada bajo terapia inmunosupresora.
Cuando viaje a países con un mayor riesgo de infecciones gastrointestinales, se recomienda una consulta previa, por ejemplo en un centro de medicina del viajero. Puede obtener información sobre la situación de la resistencia allí aquí. Sobre esta base, se determina la terapia empírica recomendada que debe tomarse en caso de urgencia.
Conclusión
En resumen, el éxito de un trasplante, especialmente en lo que se refiere a la supervivencia del mismo y a la calidad de vida del paciente, depende decisivamente de la estrecha colaboración entre el médico de familia, el nefrólogo, el centro de trasplantes y el paciente.
Literatura:
- Matas AJ, et al: Informe anual de datos OPTN/SRTR 2012: Riñón.
- Kumar D, et al: The AST Handbook of Transplant Infections, Wiley-Blackwell, 2011.
- Zwald FO, et al: Cáncer de piel en receptores de trasplantes de órganos sólidos: avances en la terapia y la gestión parte I: Epidemiología del cáncer de piel en receptores de trasplantes de órganos sólidos. J Am Acad Dermatol 2011; 65(2): 253-261.
- Engels E, et al: Espectro del riesgo de cáncer entre los receptores estadounidenses de trasplantes de órganos sólidos. JAMA 2011; 306(17): 1891-1901.
- Kasiske B, et al: Guía de práctica clínica KDIGO para el cuidado de receptores de trasplante renal: un resumen. Kidney Int 2010; 77: 299-311.
- Danovitch G: Manual de trasplante renal, Wolters Kluver, 2010.
PRÁCTICA GP 2015; 10(12): 20-24