La psoriasis es una enfermedad de la piel que se desencadena por un trastorno del sistema inmunológico con el consiguiente fuerte crecimiento celular. Puede dividirse en diferentes formas: Psoriasis en placas (psoriasis vulgaris), psoriasis guttata, psoriasis inversa, psoriasis pustulosa y psoriasis eritrodérmica. En la mayoría de los casos, los enfermos sólo padecen un tipo, aunque éste puede retirarse y, provocado por un desencadenante, reaparecer de forma diferente. En el Congreso de la AAD celebrado en Denver se debatieron los avances en el tratamiento de la psoriasis vulgar.
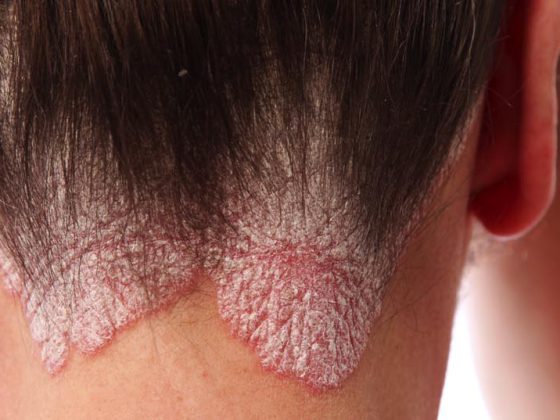
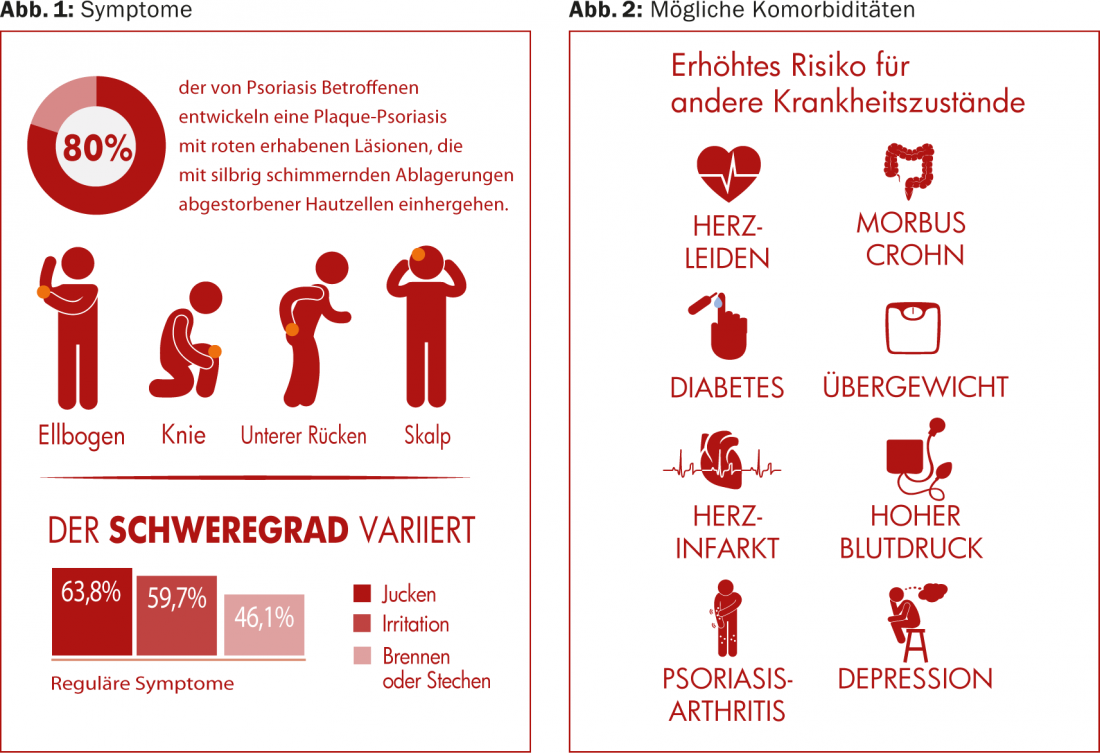
(ag) La psoriasis vulgaris se presenta con mayor frecuencia en este cuadro clínico (en aproximadamente el 80% de todos los casos de psoriasis). Provoca lesiones rojas y elevadas asociadas a depósitos plateados y brillantes de células cutáneas muertas. Se encuentran con mayor frecuencia en los codos, las rodillas, el cuero cabelludo y la parte baja de la espalda (Fig. 1) . La prevalencia varía mucho en todo el mundo, desde aproximadamente el 1% de la población adulta en EE.UU., hasta el 8,5% en Noruega [1]. Esta afección suele hacerse notar entre los 15 y los 30 años. Las mujeres se ven afectadas casi con la misma frecuencia que los hombres, mientras que los niños lo están algo menos que los adultos (0 en Taiwán, 2,1% en Italia [1]).
Causas y riesgos de la psoriasis
Aunque no existe un único “gen de la psoriasis”, los expertos coinciden en que lo más probable es que la enfermedad esté determinada genéticamente. Sin embargo, la predisposición genética en el conjunto de la población es superior a la tasa de prevalencia real, ya que sólo una fracción desarrolla psoriasis, normalmente desencadenada por un factor externo como el estrés, una lesión o la medicación.
La psoriasis conlleva un mayor riesgo de padecer otras afecciones, como enfermedades cardiovasculares (aterosclerosis, infartos de miocardio), síndrome metabólico y otras enfermedades inflamatorias inmunomediadas (artritis psoriásica, enfermedad de Crohn). (Fig. 2). Mientras que durante mucho tiempo se pensó que las enfermedades cardiovasculares estaban relacionadas con la obesidad y el consumo de nicotina, que a menudo también están presentes, y no con la psoriasis per se, ahora se discute si la propia inflamación crónica de la psoriasis no es más responsable. La psoriasis se asocia con especial frecuencia a la inflamación y el dolor articular, la artritis psoriásica [2], en la que los síntomas cutáneos pueden aparecer varios años antes que los articulares.
¿Cómo controla el sistema inmunitario la inflamación?
Para la recuperación, es fundamental que el sistema inmunitario también sea capaz de desconectar la reacción inflamatoria y volver a un estado de calma. Esto se consigue reequilibrando los factores pro y antiinflamatorios [3].
La fosfodiesterasa-4 (PDE4) es una enzima de las células inmunitarias que mantiene la inflamación al reducir el nivel de monofosfato de adenosina cíclico (AMPc) dentro de la célula [4,5]. Por lo tanto, es fundamental para la producción de factores proinflamatorios que son secretados por muchos tipos de células. Al mismo tiempo, disminuye la producción de factores antiinflamatorios.
Todavía se están investigando las vías exactas que conducen a la inflamación de la piel en la psoriasis, pero es probable que el núcleo del problema resida en la interminable respuesta inflamatoria, en la que la PDE4 puede desempeñar un papel central.
ESTEEM 1
Los fármacos que inhiben la PDE4 aumentan los niveles de AMPc en las células inmunitarias, lo que se traduce en una menor producción de mediadores inflamatorios (por ejemplo, TNF-α IL-23, IL-17). Así, al alterar la interacción de las señales inmunitarias pro y antiinflamatorias, pueden reducir la inflamación [6].
En el Congreso de la AAD celebrado este año en Denver, la Dra. Kim Papp, de Waterloo, expuso los nuevos resultados del ensayo aleatorizado y controlado de fase III ESTEEM 1 [7]. El estudio investigó el apremilast (APR), un inhibidor oral de la PDE4.
844 pacientes con psoriasis de moderada a grave (PASI ≥12, “superficie corporal” [BSA] ≥10%, “evaluación global estática del médico” [sPGA] ≥3) fueron aleatorizados 2:1 a placebo (PBO) o APR 30 mg. En la semana 16, todos los del grupo placebo pasaron a la APR. Permanecieron así hasta la semana 32, cuando todos los pacientes con APR que habían alcanzado desde entonces un PASI-75 fueron aleatorizados de nuevo a APR 30 mg o placebo (1:1). Si se perdía el estado PASI-75, los pacientes que habían sido reasignados previamente a placebo tomaban de nuevo la APR.
Resultados: En la semana 16, un número significativamente mayor de pacientes en tratamiento con APR 30 mg había alcanzado PASI-75 (33,1%) y PASI-50 (58,7%) que los que recibieron placebo (5,3 y 17,0%, p<0,0001). El cambio porcentual medio/mediano en el PASI desde el inicio fue de -52,1/-59,0% para el APR y de -16,8/-14,0% para el placebo. Esta diferencia también fue altamente significativa desde el punto de vista estadístico (p<0,0001).
En general, los cambios continuaron hasta la semana 32. Esta semana se obtuvieron respuestas PASI similares en los pacientes que habían pasado de placebo a APR 16 semanas antes.
En la fase de interrupción aleatorizada (semana 52), el 61,0% de los 77 pacientes aleatorizados a APR en la semana 32 respondieron al PASI-75. En comparación, de los pacientes reasignados al placebo en la semana 32, sólo el 11,7% (n=77) alcanzó tal estado. En este grupo, la mediana del tiempo transcurrido hasta la pérdida del PASI-75 fue de 5,1 semanas. Después de que a estos pacientes se les volviera a cambiar a la APR como se ha descrito anteriormente, un 70,3% volvió a alcanzar un PASI-75.
Efectos secundarios: En general, la APR fue bien tolerada durante 52 semanas. El número de nuevos efectos secundarios no aumentó a lo largo de las semanas. Las más frecuentes fueron la diarrea (18,7%), las infecciones de las vías respiratorias superiores (URTI, 17,8%), las náuseas (15,3%), la nasofaringitis (13,4%), la tensión (9,6%) y el dolor de cabeza normal (6,5%). La mayoría de los efectos secundarios pudieron clasificarse como de leves a moderados y no condujeron a la interrupción del tratamiento. Los casos graves, como infecciones, neoplasias malignas y episodios cardiovasculares, concordaron con los estudios previos de APR.
Conclusión: “El apremilast funciona bien para la psoriasis de moderada a grave”, resumió Papp los resultados. “En la fase aleatoria de interrupción, las respuestas PASI se mantuvieron en aquellos pacientes que habían sido reasignados aleatoriamente a APR 30 mg. Apremilast también mostró un perfil de seguridad aceptable y fue bien tolerado hasta la semana 52.”
Fuente: Reunión anual de la Academia Americana de Dermatología (AAD), 21-25 de marzo de 2014, Denver
Literatura:
- Parisi R, et al: Epidemiología mundial de la psoriasis: una revisión sistemática de la incidencia y la prevalencia en . J Invest Dermatol 2013 Feb; 133(2): 377-385.
- Mease PJ: Artritis psoriásica: actualización sobre fisiopatología, evaluación y tratamiento. Bull NYU Hosp Jt Dis 2010; 68(3): 191-198.
- Van Parijs L, Abbas AK: Homeostasis y autotolerancia en el sistema inmunitario: apagar los linfocitos. Science 1998 abr 10; 280(5361): 243-248.
- Taskén K, Aandahl EM: Efectos localizados del AMPc mediados por rutas distintas de la proteína cinasa A. Physiol Rev 2004 Jan; 84(1): 137-167.
- Bäumer W, et al.: Inhibidores de la fosfodiesterasa 4 altamente selectivos para el tratamiento de las enfermedades alérgicas de la piel y la psoriasis. Inflamm Allergy Drug Targets 2007 Mar; 6(1): 17-26.
- Castro A, et al.: Las fosfodiesterasas de nucleótidos cíclicos y su papel en las respuestas inmunomoduladoras: avances en el desarrollo de inhibidores específicos de la fosfodiesterasa. Med Res Rev 2005 Mar; 25(2): 229-244.
- Papp K, et al: Apremilast, un inhibidor oral de la fosfodiesterasa 4, en pacientes con psoriasis de moderada a grave: resultados de la fase aleatoria de retirada del tratamiento de un ensayo de fase 3, aleatorio y controlado (ESTEEM 1). Póster nº 8359 de la AAD 2014.
ESPECIAL DEL CONGRESO 2014; 5(2): 11-13