El síndrome de las piernas inquietas es una de las enfermedades neurológicas más comunes, con una prevalencia de alrededor del 7% – una actualización.
El síndrome de las piernas inquietas (SPI) es una de las enfermedades neurológicas más comunes, con una prevalencia de alrededor del 7%. La primera descripción convincente de las dolencias se atribuye al anatomista inglés Thomas Willis (1672). Una tipificación más detallada del complejo sintomático del SPI fue realizada en el siglo XIX por Theodor Wittmaack, entre otros, quien introdujo el término “Anxietas tibiarum” debido a la urgencia por moverse. En la primera mitad del siglo XX se reconocieron la agrupación familiar y la exacerbación por el embarazo, pero no fue hasta 1944-1945 cuando Karl-Axel Ekbom resumió todas las características clínicas y acuñó el nombre ahora común de SPI [1]. El SPI suele denominarse también “enfermedad de Willis-Ekbom” ( EDW) (Fig. 1). Dado que el SPI puede afectar no sólo a las piernas, sino también a los brazos, recientemente se ha vuelto a sugerir el nombre de WED o SPI/WED.

Reclamaciones y diagnósticos
Los pacientes afectados suelen tener dificultades para describir sus síntomas de SPI. Los síntomas sensoriales incluyen disestesia, ardor, tirones, hormigueo, electrización o picor. La mitad de los pacientes experimentan dolor. Sin embargo, la característica decisiva es el impulso de moverse, que no tiene por qué ir acompañado de malestar. El SPI es un diagnóstico clínico; además de la urgencia por moverse, las características esenciales del SPI incluyen la aparición en reposo, el empeoramiento al atardecer y por la noche, y la mejoría con el movimiento (véase el recuadro “Criterios diagnósticos del SPI”).

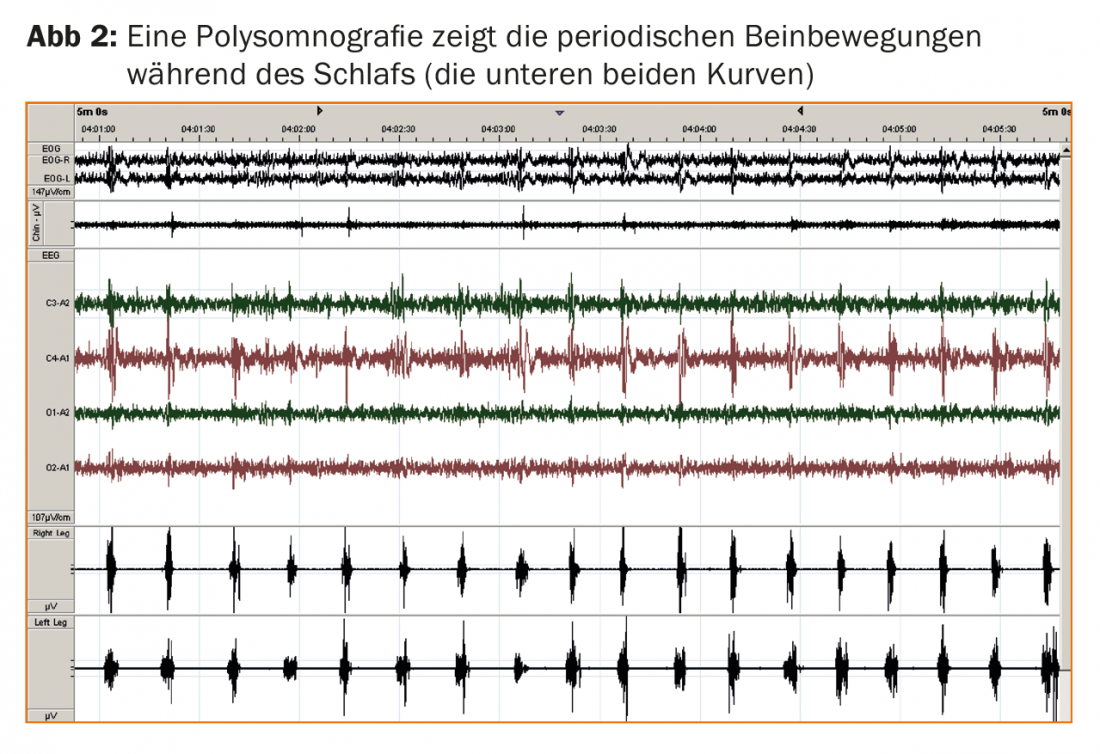
La polisomnografía es un complemento diagnóstico opcional pero útil. La polisomnografía permite detectar los movimientos periódicos de las piernas durante el sueño (PLMS; fig. 2) en casi todos los pacientes con SPI y registrar los efectos sobre la calidad del sueño nocturno, normalmente en forma de latencia prolongada para conciliar el sueño y fragmentación del sueño debido a las respuestas de excitación cortical inducidas por los PLMS. La respuesta inmediata a dosis bajas de levodopa y los antecedentes familiares positivos en más del 50% de los pacientes con SPI confirman el diagnóstico. La ausencia de somnolencia diurna grave también figura ahora como característica diagnóstica no esencial, lo que resulta sorprendente a primera vista, pero se corresponde con la experiencia de que los pacientes con SPI son más propensos a quejarse de otros síntomas diurnos como fatiga o trastornos de la concentración a pesar de la alteración del sueño nocturno.
La escala internacional de gravedad del SPI (Fig. 3) permite una evaluación semicuantitativa de los síntomas del SPI. La prueba de inmovilización intenta objetivar la incapacidad de mantener las piernas inmóviles en una posición fija; sin embargo, la prueba no ha podido establecerse como un examen de diagnóstico rutinario.

Diagnóstico diferencial
Existen varias afecciones que parecen cumplir algunos o incluso todos los criterios diagnósticos esenciales del SPI, y su delimitación puede resultar algo difícil. Entre ellas se incluyen, entre otras, la parestesia por lesiones circunscritas en las piernas, los calambres en las piernas, la polineuropatía periférica, la radiculopatía, la ansiedad, la acatisia, el dolor muscular, las posturas incómodas, el balanceo habitual del pie, el edema de la parte inferior de la pierna o la inflamación de las articulaciones.
Genética y fisiopatología
La predisposición genética desempeña un papel importante en el SPI. Los gemelos idénticos muestran una mayor concordancia con el SPI que los gemelos fraternos. La enfermedad se hereda mayoritariamente de forma autosómica dominante, con una alta penetrancia. El fenómeno de anticipación también es típico del SPI, es decir, se observa una aparición más temprana de la enfermedad y un curso más grave en la siguiente generación. Los estudios de asociación de todo el genoma han identificado varias mutaciones genéticas (PTPRD, BTBD9, MEIS1) que se asocian a un mayor riesgo de SPI [2].
La causa del SPI sigue sin estar muy clara; no se ha podido demostrar la existencia de neurodegeneración. Las alteraciones en el metabolismo del hierro y la dopamina desempeñan un papel central. La carencia de hierro es una causa frecuente y tratable del SPI, por ejemplo en el embarazo, la anemia perniciosa o la insuficiencia renal y la diálisis. Los síntomas del SPI pasajero pueden aparecer en el postoperatorio como consecuencia de la pérdida de sangre. La resonancia magnética y los exámenes post mortem mostraron una disminución de las concentraciones de hierro en la sustancia negra, el tálamo y los ganglios basales [3,4]. Además de la respuesta terapéutica a la levodopa, los estudios de imagen demostraron una reducción de la densidad del receptor D2 de dopamina en el cuerpo estriado y una reducción del transportador de dopamina.
SPI secundario
La causa más común del SPI secundario son las enfermedades asociadas a la carencia de hierro. Además, la prevalencia del SPI aumenta en diversas enfermedades neurológicas, como la esclerosis múltiple, la enfermedad de Huntington, la esclerosis lateral amiotrófica o la enfermedad de Parkinson. El hipo e hipertiroidismo y la enfermedad pulmonar crónica también parecen estar asociados a un mayor riesgo de SPI. Además, muchos medicamentos pueden desencadenar o agravar el SPI, especialmente los antidepresivos tricíclicos y de otro tipo, el litio, los antihistamínicos, los neurolépticos y el alcohol. Por definición, la forma secundaria del SPI desaparece una vez eliminado el desencadenante.
Terapia del SPI
Al tratar el SPI, deben abordarse las causas potencialmente reversibles antes de iniciar la terapia farmacológica. Esto incluye la sustitución del hierro, la vitamina B12 o el ácido fólico, así como identificar y suspender (si es posible) los medicamentos que puedan desencadenar el SPI. Dado que la somnolencia diurna puede empeorar la intensidad del SPI, también es importante mantener una buena higiene del sueño. No es aconsejable aumentar el consumo de cafeína y alcohol. La farmacoterapia distingue entre varias clases de sustancias:
- Levodopa y agonistas dopaminérgicos
- A2δ ligandos
- Opiáceos
- Benzodiacepinas
En la terapia dopaminérgica, actualmente se prefieren los agonistas dopaminérgicos a la levodopa debido al menor riesgo de aumento (véase el recuadro “Aumento”). Los dos agonistas dopaminérgicos siguientes son los más utilizados: pramipexol (Sifrol®), empezando con 0,125 mg por la noche y aumentando gradualmente hasta 0,5 mg o 0,75 mg; parches de rotigotina (Neupro®), 1-3 mg/24h. Los efectos secundarios más comunes son náuseas, mareos, hipotensión ortostática, somnolencia y trastorno del control de los impulsos. La eficacia y el perfil favorable de efectos secundarios de la pregabalina, un ligando A2δ, se demostraron en un estudio cuidadosamente aleatorizado y doble ciego [5]. La dosis inicial es de 50-75 mg y suele aumentarse a 300 mg/día. Los efectos secundarios son mareos y somnolencia; el riesgo de aumento es menor que con los agonistas dopaminérgicos. En los casos de SPI grave y respuesta inadecuada a los ligandos A2δ y/o agonistas dopaminérgicos, puede ser útil la administración añadida de opiáceos, en particular oxicodona (Oxycontin®) 5-10 mg o dihidrocodeína (Codicontin®) 30-90mg. Con los opiáceos, existe el riesgo de que aumenten las apneas centrales. Por último, las benzodiacepinas, especialmente el clonazepam (Rivotril®) 0,5-1mg, también pueden aliviar el sufrimiento. A diferencia de las otras sustancias, las benzodiacepinas actúan elevando el umbral de excitación, pero sin reducir el número de PLMS.

Mensajes para llevarse a casa
- El síndrome de las piernas inquietas es una de las enfermedades neurológicas más comunes, con una prevalencia de alrededor del 7%.
- Las características esenciales del SPI incluyen la urgencia de moverse y su aparición en reposo, el empeoramiento al atardecer y por la noche, y la mejoría con el movimiento.
- Entre los diagnósticos diferenciales importantes se incluyen la parestesia por lesiones circunscritas en las piernas, calambres en las piernas, polineuropatía periférica, radiculopatía, ansiedad, acatisia, dolor muscular, posturas incómodas, balanceo habitual del pie, edema de la parte inferior de la pierna o inflamación articular.
- La enfermedad se hereda mayoritariamente de forma autosómica dominante, con una alta penetrancia. Las alteraciones en el metabolismo del hierro y la dopamina desempeñan un papel central.
- En farmacoterapia se distinguen varias clases de sustancias: (1) agonistas de la levodopa y la dopamina, (2) ligandos A2δ, (3) opiáceos y (4) benzodiacepinas. En la terapia dopaminérgica, actualmente se prefieren los agonistas dopaminérgicos a la levodopa debido al menor riesgo de aumento.
Literatura:
- Ekbom KA: Astenia crurum paraesthetica (piernas irritables). Acta Med Scand 1944; 118: 197.
- Jiménez-Jiménez FJ, et al: Genética del síndrome de las piernas inquietas: una actualización. Sleep Med Rev 2018; 39: 108-121.
- Connor JR, et al. : El examen neuropatológico sugiere una adquisición de hierro cerebral alterada en el síndrome de las piernas inquietas. Neurología 2003; 61: 304309.
- Godau J, et al: Deficiencia multirregional de hierro cerebral en el síndrome de las piernas inquietas. Mov Disord 2008; 23: 11841187.
- Allen RP, et al: Comparación de la pregabalina con el pramipexol para el síndrome de las piernas inquietas. N Engl J Med 2014; 370: 621-631.
- Garcia-Borreguero D, et al: Directrices para el tratamiento de primera línea del síndrome de las piernas inquietas/enfermedad de Willis-Ekbom, prevención y tratamiento del aumento dopaminérgico: un grupo de trabajo combinado del IRLSSG, el EURLSSG y la RLS-foundation. Sleep Med 2016; 21: 1-11.
InFo NEUROLOGÍA Y PSIQUIATRÍA 2018; 16(4): 12-15.