Los estudios sugieren que la vigilancia activa es una opción de tratamiento para los tumores con bajo riesgo de progresión (tumores de bajo riesgo). El equipo de tratamiento debe trabajar con el paciente para determinar las estrategias de tratamiento basándose en las directrices existentes y en las pruebas actuales. En la Vigilancia Activa, el seguimiento del paciente y la monitorización regular son un factor crucial en la estrategia de tratamiento. Cada vez se diagnostican más carcinomas de próstata a partir de las mediciones del PSA. Alrededor del 90% de estos tumores están localizados. Una gran proporción de los tumores diagnosticados no suponen un riesgo para los pacientes afectados; el riesgo de morbilidad de las intervenciones es mayor para estos pacientes que el riesgo de morbilidad del tumor.
Según las directrices actuales (S3 Guideline DGU, EAU Guideline on Prostate Cancer), existen varias opciones alternativas para el tratamiento del cáncer de próstata localizado de bajo riesgo: prostatectomía radical, radioterapia local, vigilancia activa y, en función de la edad, el concepto de espera vigilante. Por vigilancia activa (VA) se entiende el seguimiento estrecho de las personas diagnosticadas de una enfermedad durante su curso. El AS debe distinguirse de la espera vigilante. Esto incluye estrategias de tratamiento sintomático de una enfermedad en su curso sin el objetivo de transferir a los pacientes a una terapia curativa, por ejemplo debido a una edad avanzada y/o comorbilidades graves. La AS también debe distinguirse de la vigilancia clínica/sanitaria, cuyo objetivo es recopilar, analizar e interpretar datos relacionados con la salud sobre poblaciones específicas [1].
Vigilancia activa para los cánceres de bajo riesgo
El análisis y la interpretación de los tratamientos oncológicos para determinadas enfermedades oncológicas en los hombres han perseguido recientemente el objetivo de evitar el sobretratamiento con opciones terapéuticas invasivas. Especialmente para el cáncer de próstata y de testículos, se han desarrollado criterios que conducen a la ausencia de tratamiento inmediato o incluso a la ausencia del mismo. Para ambas entidades, las directrices de tratamiento estipulan que, además de las opciones de tratamiento establecidas (prostatectomía, radioterapia, terapia tumoral basada en fármacos, ablación hormonal, orquiectomía), la AS para la enfermedad de bajo riesgo también está disponible como otra opción de tratamiento primario [2,3]. La decisión a favor o en contra de la AS como estrategia de tratamiento viene determinada por la clasificación del tumor como de “bajo riesgo”.
Utilizando el ejemplo del carcinoma de próstata, a continuación se demostrarán las dificultades prácticas en la elección de un posible tratamiento. El hecho de que la clasificación del cáncer siga caracterizándose -a pesar de muchos años de investigación- por una práctica muy heterogénea se pone de manifiesto en los estudios actuales [4–11]. Por ejemplo, la tasa de pacientes con un tumor de bajo riesgo descendió del 60% en 2004 al 27% en 2013 – basándose en las definiciones revisadas de los tumores de bajo riesgo [12].
Epidemiología y etiología
El cáncer de próstata es el más frecuente entre los hombres en Suiza [13]. Existe una incidencia diferente en las distintas poblaciones: en EE.UU., las personas de piel oscura se ven afectadas con más frecuencia que los blancos y éstos más que los asiáticos. Esto sugiere una predisposición genética al desarrollo del carcinoma [9]. Presumiblemente, la predisposición genética también se ve influida y modificada por factores sociodemográficos [14–16]. Por ejemplo, la incidencia del cáncer de próstata aumenta entre los asiáticos que inmigran a EE UU. La incidencia del cáncer de próstata clínicamente no significativo es comparable en todo el mundo, pero existen diferencias en el caso del cáncer de próstata clínicamente relevante. Los hombres con un familiar de primer grado con cáncer de próstata tienen el doble de riesgo de desarrollar también cáncer de próstata. Si hay varios familiares de primer grado con la enfermedad, el riesgo aumenta entre 5 y 11 veces [10,17].
La mayoría de todos los carcinomas de próstata surgen probablemente debido a múltiples polimorfismos genéticos [10]. La testosterona no se considera actualmente un agente precanceroso, pero probablemente desempeña un papel como promotor tumoral en tumores ya progresivos. Los componentes de la dieta afectan al cáncer de próstata de muchas maneras [18]. Las proteínas animales parecen favorecer el riesgo de desarrollar un cáncer de próstata avanzado. El oligoelemento selenio ha sido objeto de debate durante algún tiempo con respecto a un posible beneficio protector. Sin embargo, el ensayo SELECT no pudo demostrar tal beneficio, por lo que se interrumpió prematuramente en 2008. Fumar tabaco en el momento del diagnóstico inicial aumenta el riesgo de tumor avanzado, recidiva (38 frente a 26%) y muerte por carcinoma (15,3 frente a 9,6/1000 personas-año) [15]. El síndrome metabólico también aumenta el riesgo de cáncer de próstata. Hasta ahora no se ha podido demostrar una relación entre el riesgo de cáncer de próstata y el consumo de alcohol.
Alta proporción de sobretratamiento
Durante más de 30 años, la prostatectomía radical se ha considerado la terapia estándar para el tratamiento curativo del cáncer de próstata; alrededor del 70% de los pacientes menores de 70 años se someten a una prostatectomía [8,12]. Esta estrategia se lleva a cabo bajo el supuesto de que el paciente se cura tras la intervención. Estas consideraciones deben relativizarse cada vez más: Se calcula que en un 30% de los hombres operados se produce una progresión del PSA en el transcurso de la intervención. Algunos de los pacientes tienen tumores que no tienen por qué ser tratados con una intervención; estos pacientes no morirían a causa del tumor incluso sin cirugía o radiación. Sin embargo, las posibilidades de evaluar la biología tumoral individual siguen siendo limitadas en la actualidad. Por ello, el equipo de tratamiento y los pacientes suelen optar por la vía de la intervención, a menudo por la preocupación de que el tumor pueda evolucionar a un estadio que ya no pueda tratarse de forma curativa debido a su rápida progresión.
La observación activa periódica de pacientes con carcinomas de bajo riesgo clínicamente anodinos aptos para la AS puede evitar morbilidades relacionadas con la terapia (disfunción eréctil, incontinencia, complicaciones relacionadas con la cirugía y la radiación, etc.) y, por tanto, el sobretratamiento, por lo que se considera segura en este contexto. La carga psicológica del paciente y su pareja bajo la dirección de un urólogo experimentado también se considera adecuada [6,18]. El estudio ERSPC mostró una tasa de sobretratamiento del 54%. Evitar a estos hombres las morbilidades de la terapia intervencionista es el objetivo de la AS [5].
Criterios para la vigilancia activa
La actual directriz S3 sobre detección precoz, diagnóstico y tratamiento de los distintos estadios del cáncer de próstata incluye la AS como estrategia de tratamiento para carcinomas definidos de bajo riesgo que cumplan determinados criterios (Tab. 1).

La directriz define los siguientes criterios de decisión pertinentes:
- Los pacientes con cáncer de próstata localizado que cumplan los requisitos para recibir un tratamiento curativo local deben ser informados no sólo sobre los procedimientos de tratamiento como la prostatectomía radical, la radioterapia y la braquiterapia, sino también sobre la AS.
- En los pacientes con cáncer de próstata localizado candidatos a un tratamiento curativo, deben sopesarse los efectos adversos y las consecuencias terapéuticas de la prostatectomía radical, la radioterapia percutánea y la braquiterapia frente al riesgo de retrasar el tratamiento en el caso de una estrategia de AS.
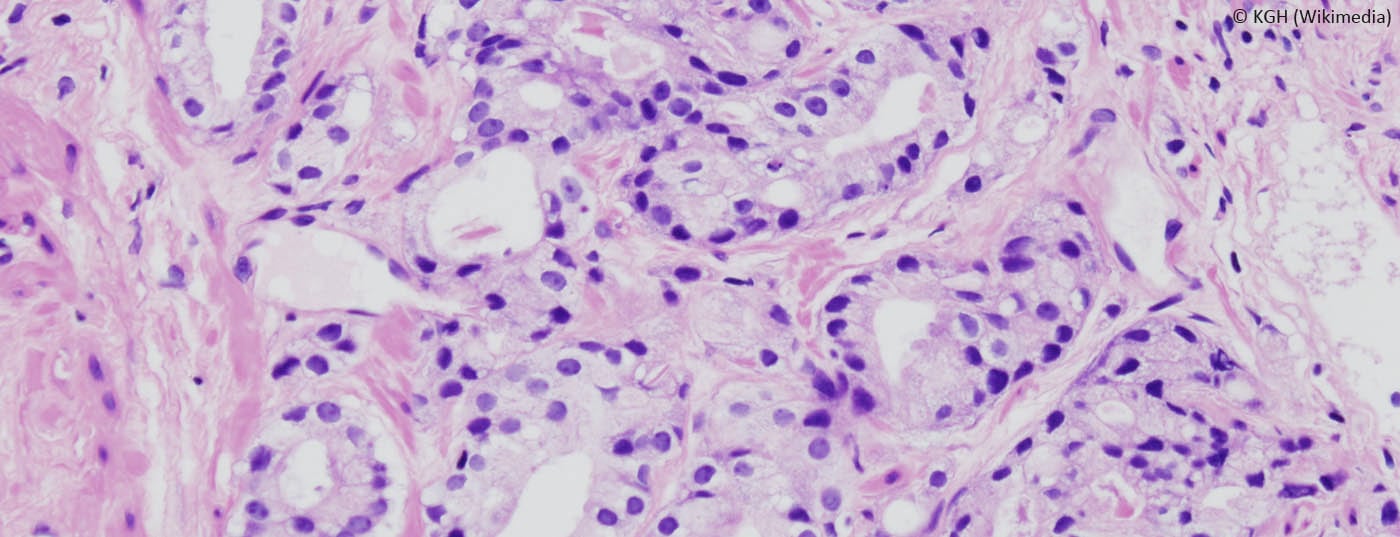
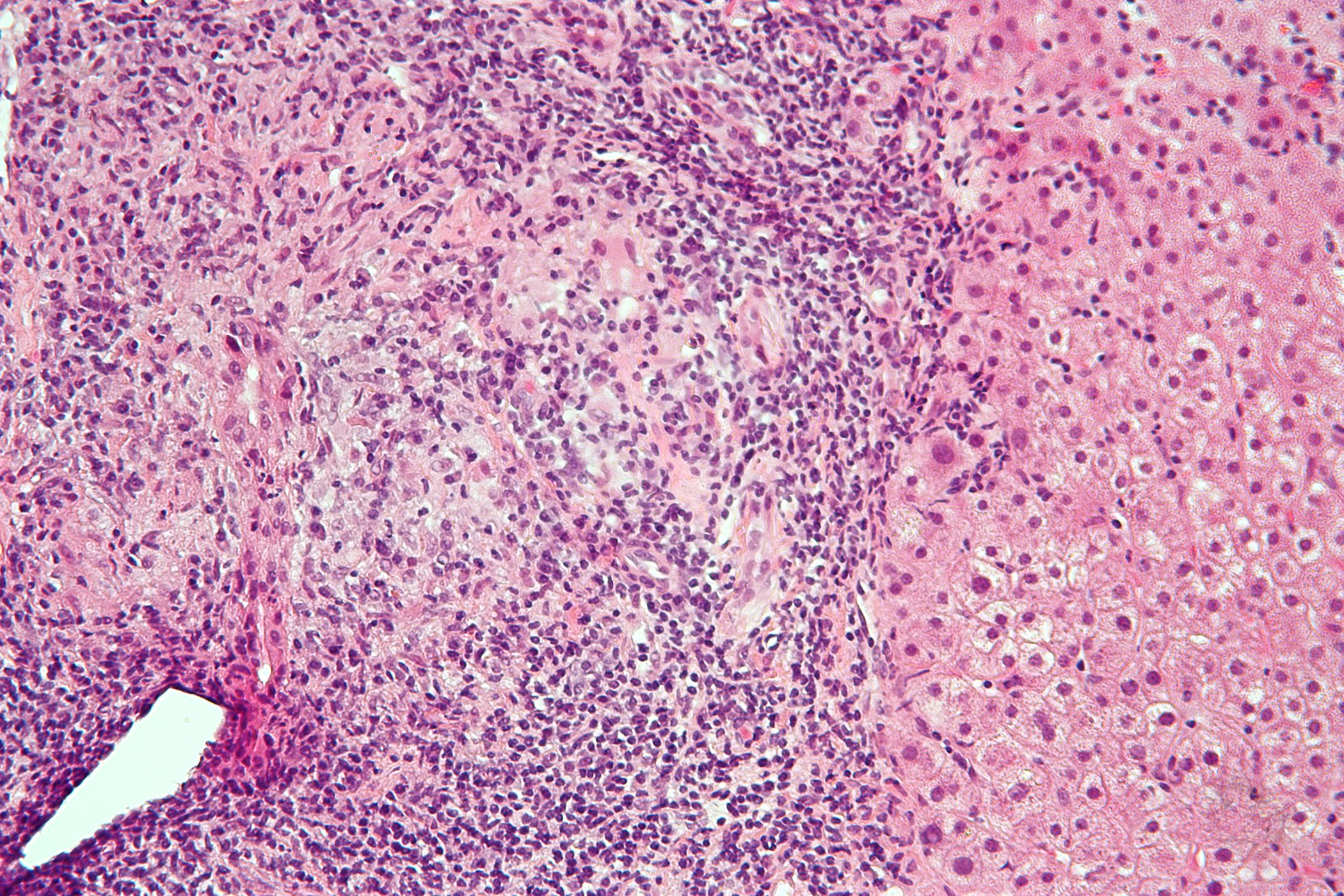
- El tumor debe controlarse cada tres meses durante los dos primeros años tras el diagnóstico mediante la determinación del PSA y el tacto rectal. Si el valor de PSA se mantiene estable, deberá comprobarse cada seis meses a partir de entonces. Las biopsias deben realizarse cada 12-18 meses. Actualmente se están investigando nuevos métodos para aumentar la importancia de las biopsias de próstata (Fig. 1).
- La AS debe abandonarse si el tiempo de duplicación del PSA se reduce a menos de tres años o el grado de malignidad se deteriora hasta una puntuación de Gleason >6.
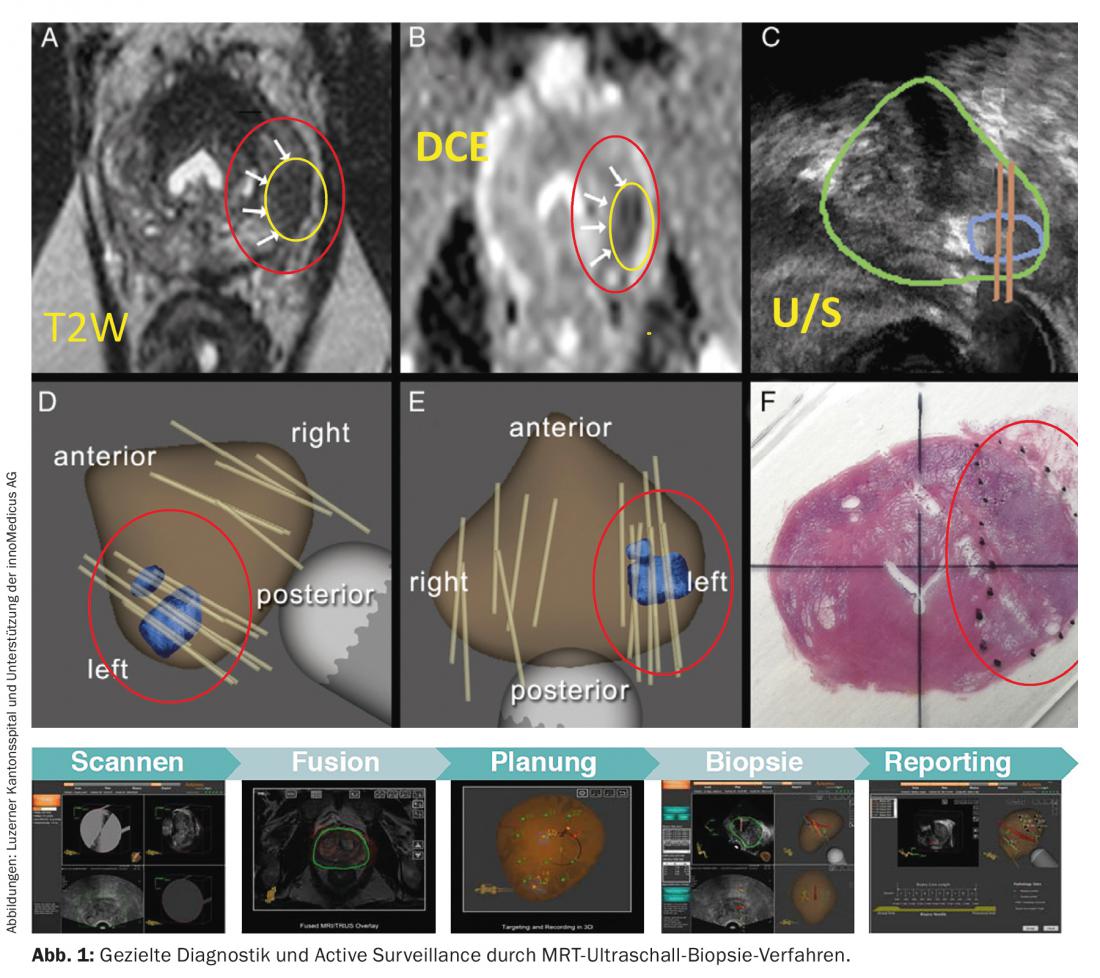
El grado de adaptación del tratamiento en el curso individual (por ejemplo, prostatectomía radical o radiación local) depende directamente de la dinámica individual del cáncer. A cada paciente se le informa sobre todas las opciones terapéuticas y se le ofrece principalmente un procedimiento que le permita inicialmente pasar más años de su vida sin impedimentos relacionados con la terapia y con una alta calidad de vida. Los centros oncológicos certificados contribuyen de forma demostrable a garantizar la calidad de la asistencia.
Conclusión para la práctica
- Actualmente, la primera prueba de referencia del PSA se recomienda en Suiza entre los 40 y los 45 años.
- Si el nivel de PSA es de <1 ng/ml, se recomienda la determinación de PSA cada tres años, para PSA ≥1 a <2 ng/ml cada dos años y para PSA ≥2 a <3 ng/ml anualmente. El paciente debe ser informado detalladamente de antemano.
- Las mediciones excesivas de PSA provocan el diagnóstico de un número cada vez mayor de carcinomas de próstata que, de otro modo, habrían pasado desapercibidos durante toda la vida dada la constelación de edad, las comorbilidades y/o la biología tumoral favorable de los pacientes.
- Alrededor del 90% de los pacientes diagnosticados en los últimos años presentan un carcinoma de próstata localizado.
- Los estudios sugieren que la AS es una opción de tratamiento para los tumores con un bajo riesgo de progresión (tumores de bajo riesgo). Los pacientes deben ser informados sobre todas las opciones de tratamiento.
- El equipo de tratamiento (médicos generalistas, urólogos, oncólogos radioterapeutas, oncólogos) tiene que definir y seguir las estrategias de tratamiento junto con el paciente y sus familiares, especialmente en caso de posible AS, basándose en las directrices existentes y en las pruebas actuales.
- La Sociedad Suiza de Urología ha creado una base de datos de vigilancia activa (SIP-CAS) para asegurar y ampliar continuamente la base de pruebas.
Literatura:
- OMS, Vigilancia de la salud pública, 2015. www.who.int/topics/public_health_surveillance/en/.
- Kollmannsberger C, et al: Patrones de recaída en pacientes con cáncer testicular en estadio clínico I tratados con vigilancia activa. J Clin Oncol 2015; 33(1): 51-57.
- Coursey Moreno C, et al: Tumores testiculares: lo que los radiólogos deben saber: diagnóstico diferencial, estadificación y tratamiento. Radiographics 2015; 35(2): 400-415.
- Loeb S, et al: Vigilancia activa del cáncer de próstata: una revisión sistemática de las variables clinicopatológicas y los biomarcadores para la estratificación del riesgo. Urología europea 2015; 67(4): 619-626.
- Klotz L: Vigilancia activa del cáncer de próstata: debate sobre la aplicación, no sobre el concepto. Urología europea 2015 Ene 24. doi: 10.1016/j.eururo.2015.01.007. [Epub ahead of print]
- Bellardita L, et al: ¿Cómo afecta la vigilancia activa del cáncer de próstata a la calidad de vida? Una revisión sistemática. Urología europea 2015; 67(4): 637-645.
- Bangma CH, et al: Vigilancia activa del cáncer de próstata de bajo riesgo: avances hasta la fecha. Urología europea 2015; 67(4): 646-648.
- Saman DM, et al: Una revisión de la epidemiología actual y las opciones de tratamiento del cáncer de próstata. Dis Mon 2014; 60(4): 150-154.
- Helfand BT, Catalona WJ: La epidemiología y las implicaciones clínicas de la variación genética en el cáncer de próstata. Urol Clin North Am 2014; 41(2): 277-297.
- Eeles R, et al: La epidemiología genética del cáncer de próstata y sus implicaciones clínicas. Nat Rev Urol 2014; 11(1): 18-31.
- Berman DM, Epstein J: ¿Cuándo es realmente cáncer el cáncer de próstata? Urol Clin North Am 2014; 41(2): 339-346.
- Huland H, Graefen M: Tendencias cambiantes en el tratamiento quirúrgico del cáncer de próstata: ¿el fin del sobretratamiento? Eur Urol 2015 Feb 27. doi: 10.1016/j.eururo. 2015.02.020. [Epub ahead of print]
- Oficina Federal de Estadística, 2015. www.bfs.admin.ch/bfs/portal/de/index/themen/14/02/05/key/01/02.html.
- Kasperzyk JL, et al: Espera vigilante y calidad de vida entre los supervivientes de cáncer de próstata en el Estudio de Salud de los Médicos. J Urol 2011; 186(5): 1862-1867.
- Kenfield SA, et al: Tabaquismo y supervivencia y recidiva del cáncer de próstata. JAMA 2011; 305(24): 2548-2555.
- Kenfield SA, et al: Actividad física y supervivencia tras el diagnóstico de cáncer de próstata en el estudio de seguimiento de profesionales sanitarios. J Clin Oncol 2011; 29(6): 726-732.
- Bratt O: Cáncer de próstata hereditario: aspectos clínicos. J Urol 2002; 168(3): 906-913.
- Masko EM, et al: La relación entre nutrición y cáncer de próstata: ¿más siempre es mejor? Eur Urol 2013; 63(5): 810-820.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2015; 3(5): 8-11