Las enfermedades cardiovasculares (ECV) siguen siendo la principal causa de muerte en todo el mundo. Las recientes directrices sobre la prevención de la HKE destacan hasta qué punto la elevación del colesterol de lipoproteínas de baja densidad (LDL-C) es uno de los factores que más contribuyen a la HKE aterosclerótica. En consecuencia, está indicada una reducción eficaz del LDL-C.
Las enfermedades cardiovasculares (ECV) siguen siendo la principal causa de muerte en todo el mundo [1]. Las últimas estadísticas de la Organización Mundial de la Salud (OMS) muestran que cada año mueren 17,9 millones de personas en todo el mundo a causa de la HKE, lo que supone aproximadamente el 32% de todas las muertes. De ellos, cerca del 85% se deben a infartos de miocardio (ataques al corazón) y derrames cerebrales.
Las directrices recientes sobre la prevención de la HKE destacan hasta qué punto el colesterol elevado de lipoproteínas de baja densidad (LDL-C) es uno de los factores que más contribuyen a la HKE aterosclerótica [2]. Dado que los niveles elevados de LDL-C responden a la reducción farmacológica, las directrices europeas y estadounidenses pertinentes para la dislipidemia han propuesto objetivos de tratamiento en diferentes categorías de pacientes para enfatizar la necesidad de una reducción beneficiosa del LDL-C en pacientes con alto riesgo de HKE o pacientes con HKE existente. Las estatinas se han establecido como el patrón oro para el tratamiento del colesterol en prevención primaria y secundaria durante casi dos décadas. En los últimos años, la ezetimiba ha sido el segundo fármaco añadido al tratamiento con estatinas. La ezetimiba inhibe la absorción del colesterol en el intestino y proporciona así una reducción adicional del LDL-C.
A pesar del éxito de las estatinas, los datos de los registros muestran que las terapias actualmente disponibles están infrautilizadas. El estudio NOR-COR (NORwegian CORonary) publicado en 2017 mostró que en los pacientes que sobrevivieron a un infarto agudo de miocardio (infarto de miocardio), el 57% tenía niveles de LDL-C superiores a 1,8 mmol/l; el 22% superiores a 2,5 mmol/l; y el 10% superiores a 3,0 mmol/l, en un momento entre 2 y 36 meses después del infarto [3]. En el estudio POLASPIRE, realizado en 2017-2018 como parte del ensayo EUROASPIRE V, los valores objetivo de LDL-C solo los alcanzaron el 20 % de las mujeres y el 25 % de los hombres [4]. Según las directrices actuales, estos pacientes deben aspirar a un nivel de LDL-C de 1,4 mmol/l o inferior [2]. Alcanzar las recomendaciones actuales de concentraciones de LDL-C incluso más bajas es un reto importante en la práctica clínica.
Entre los grupos de pacientes de alto riesgo se encuentran los que padecen hipercolestero-rin-emia familiar (HF). Debido a los altos niveles de colesterol desde el nacimiento, los pacientes con HF tienen un riesgo mucho mayor de HKE que aquellos con hipercolesterolemia de aparición más tardía [5]. La mayoría de los pacientes con HF no alcanzan sus objetivos de tratamiento de LDL-C. En un grupo noruego de personas, el 25% de los pacientes en prevención primaria y sólo el 8% de los pacientes en prevención secundaria alcanzaron objetivos de LDL-C por debajo de 2,5 mmol/l y por debajo de 1,8 mmol/l, respectivamente, en tratamiento principalmente con estatinas y ezetimiba [6]. Al igual que con la prevención secundaria, las directrices conjuntas de 2019 de la Sociedad Europea de Cardiología (ESC) y la Sociedad Europea de Aterosclerosis (EAS) para el tratamiento de la dislipidemia redujeron significativamente los objetivos de tratamiento de la HF a un LDL-C <1,8 mmol/l en prevención primaria y <1,4 mmol/l en prevención secundaria, lo que subraya la necesidad de nuevas opciones de tratamiento [7].
Otro problema de la cardio-logía preventiva es el riesgo residual de eventos recurrentes en pacientes con HKE establecida, a pesar de las terapias preventivas actuales. Recientemente, se ha reconocido el papel de las lipoproteínas ricas en triglicéridos en el desarrollo de la aterosclerosis y la HKE [7]. Estas partículas pueden mediar en la acumulación de colesterol en la íntima arterial y desencadenar procesos proinflamatorios. Aunque los fibratos tienen importantes propiedades para reducir los triglicéridos, su éxito en la reducción de los eventos cardiovasculares es limitado, lo que ha despertado el interés por los fármacos que modifican o reducen los riesgos cardiovasculares asociados a estas lipoproteínas. Otro factor que aumenta el riesgo residual es el aumento de la concentración de lipoproteína(a) [Lp(a)]. La Lp(a) es una partícula genética similar a la LDL caracterizada por la adición de la apolipoproteína(a) [apo(a)] a una partícula basada en la apolipoproteína B100. Hasta un 20% de la población tiene niveles que podrían aumentar su riesgo de HKE. Las grandes terapias hipolipemiantes tienen poco efecto sobre las concentraciones de Lp(a), pero se están desarrollando nuevas terapias basadas en genes que se dirigen específicamente a la apo(a).
En el siguiente artículo, revisaremos las pruebas de los principales agentes hipolipemiantes que se han introducido recientemente o que aún están en desarrollo, tras la introducción de las estatinas y la ezetimiba.
Inhibidor de la proproteína convertasa subtilisina/kexina tipo 9 (PCSK9)
La PCSK9 es una enzima que se expresa en muchos tejidos y células. Se une al receptor LDL en las membranas de los hepatocitos, lo que dirige al receptor para su degradación intracelular en los lisosomas. Los receptores de LDL que no están unidos a la PCSK9 pueden recircular más de 100 veces. El bloqueo de la PCSK9 provoca un aumento de los receptores LDL funcionales, un mayor transporte de las partículas LDL del espacio extracelular al intracelular y, por tanto, una disminución de la concentración de LDL-C en la sangre. (Fig. 1). Los dos primeros inhibidores de la PCSK9, el alirocumab y el evolocumab, fueron aprobados por la Agencia Europea del Medicamento (EMA) y la Administración de Alimentos y Medicamentos (FDA) en 2015 como inyecciones una vez cada quince días o una vez al mes. Un metaanálisis reciente en pacientes con HKE aterosclerótica pero no HF, en el que participaron 66 478 pacientes de 39 ensayos controlados aleatorizados, descubrió que los inhibidores de la PCSK9 lograban una reducción del LDL-C de aproximadamente el 60%. Esta reducción se asoció a un menor riesgo de infarto de miocardio (riesgo relativo [RR], 0,80; intervalo de confianza del 95% [KI], 0,74-0,86; p<0,0001), ictus isquémico (RR, 0,78; IC 95%, 0,67-0,89; p=0,0005), y revascularización coronaria (RR, 0,83; IC 95%, 0,78-0,89; p<0,0001), en comparación con los valores de control. Sin embargo, los efectos de la inhibición de la PCSK9 sobre la mortalidad por todas las causas y la muerte cardiovascular no fueron estadísticamente significativos durante la mediana del periodo de observación de 2,3 años; un lapso de tiempo que puede haber sido demasiado corto para demostrar efectos sobre la mortalidad. El estudio PCSK9 más reciente, seguimiento de uno de los mayores ensayos de fase III, tuvo un periodo de observación de 8,4 años y mostró una reducción significativa del 23% de la mortalidad cardiovascular en comparación con el placebo [8]. El uso de estos inhibidores de la PCSK9 no se ha asociado a un mayor riesgo de acontecimientos adversos neurocognitivos, aumento de los niveles de enzimas hepáticas, rabdomiólisis o diabetes mellitus de nueva aparición [8].
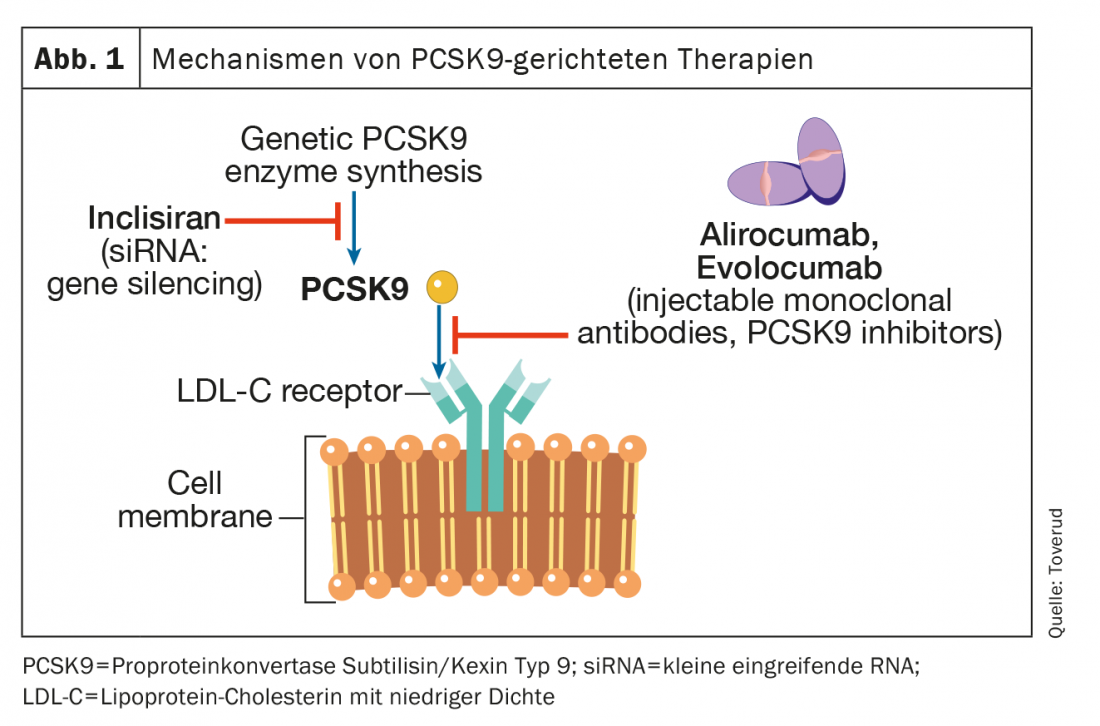
En estudios aleatorizados a doble ciego con alirocumab y evolocumab en pacientes con HF heterocigótica en tratamiento hipolipemiante estable, principalmente con estatinas y ezetimiba, las concentraciones de LDL-C se redujeron entre un 50 y un 60 hasta alrededor de 1,8 mmol/l [9,10]. Alrededor del 60% de los pacientes pueden alcanzar objetivos de tratamiento de LDL-C inferiores a 1,8 mmol/l [8,9]. Los resultados de los ensayos de tratamiento abierto a largo plazo con alirozumab y evolocumab han sido alentadores, con niveles de LDL-C más bajos de forma sostenida, bajas tasas de interrupción debido a efectos secundarios y baja prevalencia de anticuerpos antifármaco [11,12]. En la rara condición de HF homocigota (es decir, mutaciones causantes de HF heredadas de ambos progenitores), queda poca o ninguna actividad residual del receptor de LDL. Por lo tanto, los fármacos que actúan regulando al alza los receptores de LDL, incluidas las estatinas y la ezetimiba, tienen un efecto limitado. Los inhibidores de la PCSK9 también regulan al alza los receptores de LDL, pero en los pacientes con HF homocigótica que tienen alguna función residual del receptor de LDL, los inhibidores de la PCSK9 pueden ser eficaces en diversos grados [13,14].
Inclisiran
Inclisiran (Leqvio®) es un pequeño ARN de interferencia (ARNsi) que inhibe la traducción de la proteína PCSK9 (Fig. 1) . Tres ensayos en los que participaron pacientes con HF heterocigótica o HKE existente investigaron la eficacia de este fármaco además de las estatinas [15]. El criterio de valoración principal en estos ensayos fue la reducción de los niveles de LDL-C, y el fármaco o el placebo se administraron por vía subcutánea al inicio y en los meses 3, 9 y 15. En general, la reducción de los niveles de LDL-C fue de alrededor del 45%. Hasta ahora, ningún estudio ha documentado un beneficio para la morbilidad o la mortalidad, pero están en curso. La EMA aprobó la comercialización de Inclisiran en 2020 y la FDA en 2021. Curiosamente, el Instituto Nacional para la Excelencia Sanitaria y Asistencial (NICE) del Reino Unido avaló su uso en la práctica general del país incluso antes de que se publicara ningún estudio de resultados. Una de las ventajas de Inclisiran es su farmacocinética, que conduce a una reducción permanente de las concentraciones de LDL-C. Inclisiran se administra a los 0 y tres meses y después dos veces al año, lo que garantiza un mejor cumplimiento (adherencia a la terapia). Por otro lado, pueden persistir posibles efectos adversos, pero su perfil de seguridad sigue siendo excelente hasta la fecha. En todos los estudios, Inclisiran se utilizó junto con un tratamiento hipolipemiante de eficacia probada.
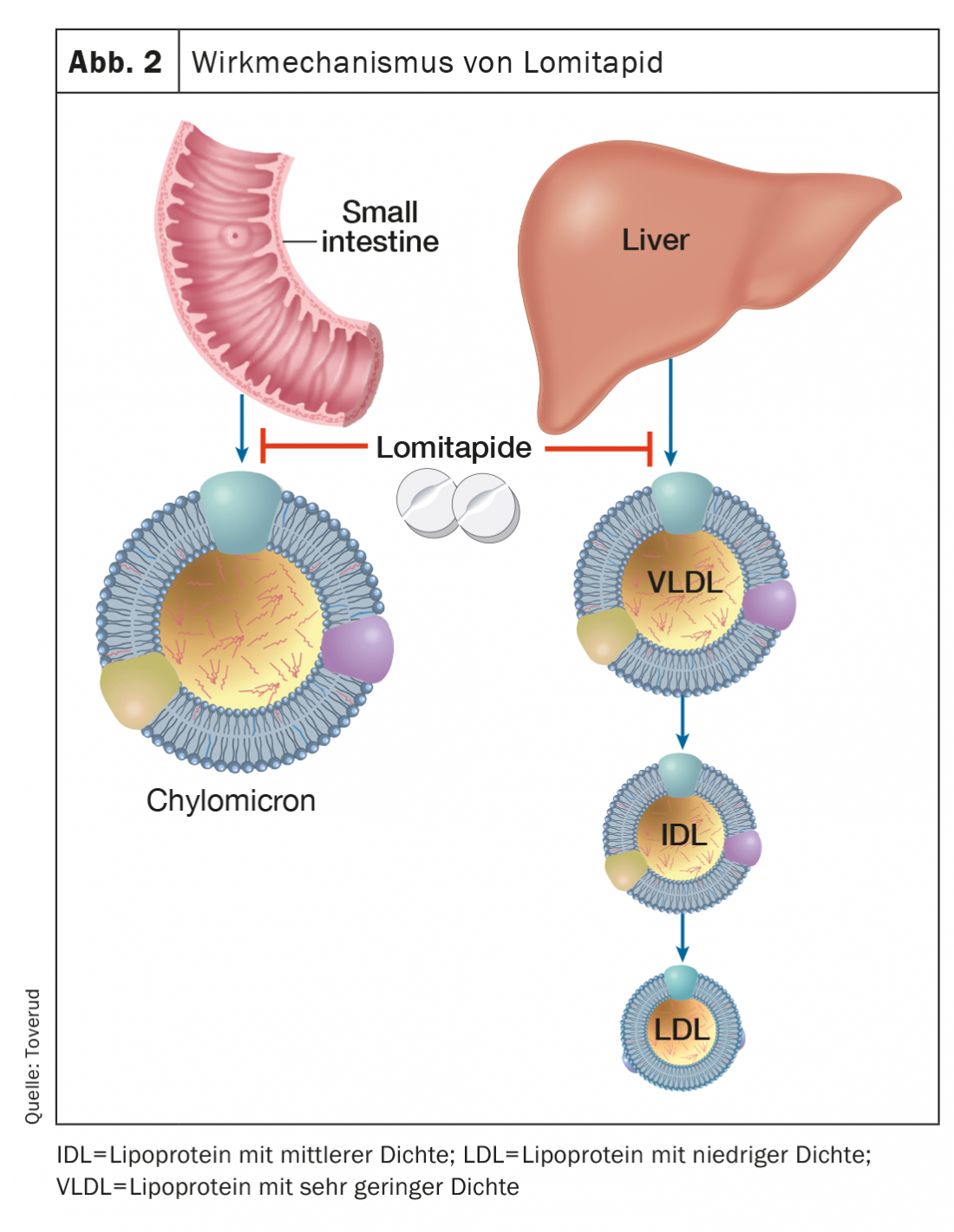
Lomitapide
La lomitapida, un inhibidor de la proteína microsomal de transferencia de triglicéridos, inhibe la formación de apolipoproteína B, que contienen las lipoproteínas en el intestino y el hígado, y por lo tanto disminuye el LDL-C sérico, independientemente de los receptores de LDL (Fig. 2). Dependiendo de la dosis, las concentraciones de LDL-C pueden reducirse en torno a un 50% [16]. El tratamiento adicional con lomitapida puede prolongar los intervalos entre aféresis de LDL en pacientes seleccionados y motivados con HF homocigótica. Los efectos secundarios incluyen alteraciones gastrointestinales, aumento de las enzimas hepáticas y aumento de la grasa hepática. La lomitapida (Lojuxta®) se aprobó en 2013 para el tratamiento de la HF homocigótica en adultos. Por otro lado, los costes son muy elevados, lo que limita la disponibilidad.
Ácido bempedoico
El ácido bempedoico está aprobado en la Unión Europea (Nilemdo®) y en Estados Unidos (Nexletol®) para el tratamiento de la hipercolesterolemia. Como profármaco, el ácido bempedoico requiere la activación por la acil-CoA sintetasa-1 de cadena muy larga, que se expresa principalmente en el hígado (pero no en el músculo esquelético). El metabolito activo inhibe la adenosín trifosfato citrato liasa, una enzima esencial en la vía de la síntesis del colesterol, antes de la 3-hidroxi-3-metilglutaril-CoA reductasa (Fig. 3 ). Al igual que con las estatinas, la inhibición de la síntesis de colesterol conduce a la regulación al alza de los receptores de LDL y, por tanto, a la eliminación de las partículas de LDL. Con una semivida de 15-24 horas, el ácido bempedoico puede administrarse por vía oral una vez al día. Como monoterapia, el ácido bempedoico redujo las concentraciones de LDL-C hasta en un 25% (restando el placebo) en pacientes con valores basales de 3,4-5,7 mmol/l [17].
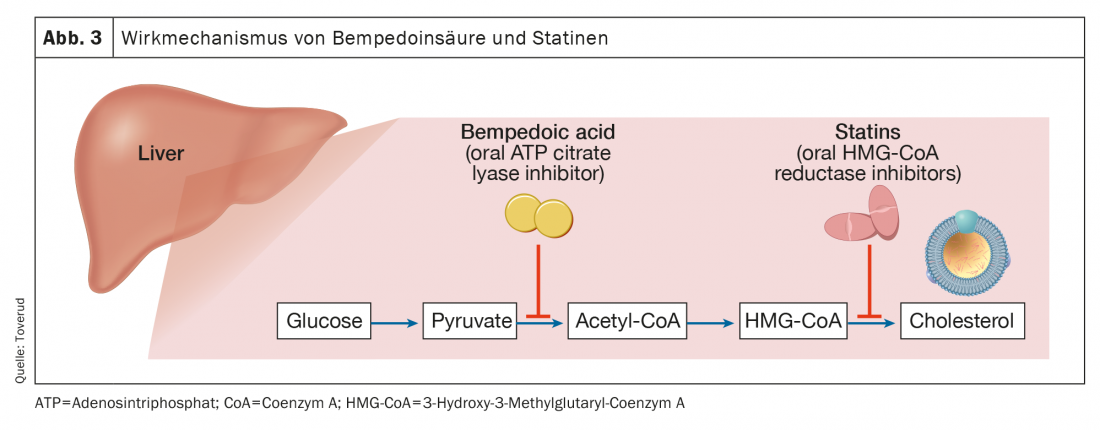
Como ya se ha mencionado, ha surgido la necesidad de lograr mayores reducciones del LDL-C que las conseguidas sólo con estatinas, y el ácido bempedoico puede desempeñar un papel importante. En pacientes que recibían un tratamiento de fondo con estatinas y cuyos niveles de LDL-C se mantenían entre 3,0 y 5,7 mmol/l, el ácido bempedoico 180 mg diarios redujo aún más el LDL-C en un ~20%, a pesar de dirigirse a la misma vía de biosíntesis del colesterol que las estatinas, pero a través de enzimas diferentes [18]. Las tasas de acontecimientos adversos, incluidos los síntomas relacionados con los músculos, fueron similares a las del placebo [19]. Del mismo modo, en pacientes con enfermedad cardiovascular aterosclerótica o HF, o ambas, cuyos niveles de C-LDL se mantuvieron >1,8 mmol/l con un tratamiento lipídico tolerado al máximo (incluida la estatina), se observaron reducciones del C-LDL de 17-18 [20]. En un estudio paralelo de pacientes similares con niveles de LDL-C >2,6 mmol/l en su primer examen, se observó una reducción correspondiente en el que los pacientes no necesitaban tomar una estatina para participar en el estudio [21]. Los efectos secundarios habituales del ácido bempedoico son un aumento del ácido úrico [20,21] y un aumento de la gota [21,22]. En un metaanálisis reciente [21] se indicó una tendencia al empeoramiento de la función renal.
En los últimos años ha surgido la necesidad de controlar los lípidos en pacientes que no toleran las estatinas. Aunque los ensayos controlados aleatorizados muestran tasas bajas de síntomas musculares, los datos observacionales sugieren que hasta un tercio de los pacientes tratados con estatinas refieren intolerancia absoluta o incapacidad para tomar las dosis adecuadas para alcanzar los objetivos de LDL-C [22]. En un número considerable de pacientes, los síntomas que se consideran efectos secundarios de las estatinas son probablemente efectos nocebo. Los estudios realizados en pacientes con síntomas relacionados con los músculos durante el tratamiento con estatinas muestran que la mayoría de las personas son incapaces de distinguir las fases del tratamiento con placebo de las fases del tratamiento con estatinas [23,24]. Los estudios se han dirigido hacia el uso del ácido bempedoico en pacientes con intolerancia a las estatinas [25] y como terapia añadida a la ezetimiba [26]. En pacientes con intolerancia a las estatinas, se observaron niveles de LDL-C de 4,1 mmol/l, de los cuales 21% [25]. En un estudio de pacientes intolerantes a las estatinas que tomaban ezetimiba, un tercio de los cuales tomaba una estatina de dosis baja, las concentraciones de LDL-C se redujeron en >28% [27]. El ácido bempedoico fue bien tolerado por estos grupos de pacientes, sin aumento de los síntomas musculares.
Dado el coste de los inhibidores de la PCSK9, los estudios de seguimiento han intentado alcanzar niveles de LDL-C tan bajos como los que proporcionan los inhibidores de la PCSK9. En un estudio de dosis fija de ácido bempedoico más ezetimiba, en pacientes con alto riesgo cardiovascular con un LDL-C basal medio de 3,9 mmol/l a pesar de un tratamiento máximo con estatinas, las reducciones de los niveles de LDL-C fueron sustanciales (>38%), aunque inferiores a las esperadas con un inhibidor de la PCSK9 [28]. La terapia triple con ácido bempedoico, ezetimiba y atorvastatina (20 mg/día) dio lugar a una reducción aproximadamente equivalente del LDL-C de >64%, como cabría esperar con un inhibidor de la PCSK9 [29], aunque no se han publicado estudios comparativos. La adición de ácido bempedoico junto al tratamiento de fondo con evolocumab 420 mg una vez al mes redujo significativamente el LDL-C en casi un 30% [29].
En general, las reducciones de los niveles de LDL-C con ácido bempedoico parecen ser algo mayores en los grupos de pacientes que no toman una estatina [18–20]. Con respecto a otras fracciones lipídicas, el ácido bempedoico reduce la apolipoproteína B, los triglicéridos y las concentraciones de colesterol de lipoproteínas de no alta densidad (colesterol no HDL-C). Las reducciones de los niveles de PCR observadas en varios estudios pueden ser prometedoras, pero requieren una mayor comprensión del mecanismo [21,22,26].
El papel del ácido bempedoico en el futuro parece estar en (1) pacientes intolerantes a las estatinas combinadas con otros agentes hipolipemiantes tolerados y (2) pacientes que requieren terapias adicionales para alcanzar los objetivos de LDL-C. El estudio de resultados cardiovasculares en curso (CLEAR Outcome) en pacientes con antecedentes de HKE o alto riesgo de padecerla, intolerancia a las estatinas y niveles de LDL-C ≥2,6 mmol/l aclarará aún más el papel del fármaco y si las posibles reducciones de los criterios de valoración clínicos están relacionadas exclusivamente con la disminución de los lípidos o también con una reducción de la PCR.
Debido a los elevados costes, como ya se ha mencionado, la disponibilidad de los inhibidores de la PCSK9 es limitada. Con la llegada de los biosimilares y otras formas de inhibición de la PCSK9, es posible que los precios bajen en el futuro y que esta terapia eficaz y bien tolerada esté disponible para un mayor número de pacientes.
Triglicéridos/hiperlipidemia combinada – terapias dirigidas
Los triglicéridos elevados a pesar de las terapias de reducción del LDL-C son uno de los problemas más comunes en la práctica clínica. Los pacientes con hipertrigliceridemia pueden tener un alto riesgo residual de enfermedad cardiovascular [30]. Dado que el estilo de vida se perfila como una de las principales causas de hipertrigliceridemia en pacientes con síndrome metabólico, obesidad abdominal o diabetes mellitus tipo 2 (DMT2), así como en personas que consumen demasiado alcohol o son físicamente inactivas, ¿qué más puede hacer un médico para abordar estos factores de riesgo? Aunque la dieta, la actividad y la pérdida de peso son las piedras angulares del tratamiento, la genética y otros factores no modificables también desempeñan un papel. Por ejemplo, los pacientes con hiperlipidemia familiar combinada son frecuentes en la práctica clínica y pueden presentar hipertrigliceridemia a pesar de un peso corporal normal [31]. Una afección muy rara es el síndrome de hipercilomicronaemia familiar monogénica.
Las pruebas epidemiológicas y genéticas han respaldado la hipótesis de que las variantes de varios genes clave del metabolismo de los triglicéridos que afectan a los triglicéridos y a las lipoproteínas ricas en triglicéridos y residuales están asociadas causalmente con las enfermedades cardiovasculares y la mortalidad general [32]. Gracias a estas pruebas, han surgido nuevas terapias dirigidas a estas manifestaciones.
Ácido eicosapentaenoico
Los suplementos de aceite de pescado se han promocionado durante décadas por sus efectos cardiovasculares positivos. También se han utilizado bastante en la práctica clínica para reducir las concentraciones de triglicéridos, pero los estudios con ácidos grasos omega-3 no han demostrado su protección con respecto a la HKE [33]. Por ello, los resultados del estudio REDUCE-IT (Reduction of Cardioascular Events with Icosapent Ethyl-Interention Trial ) fueron una sorpresa. Los pacientes que recibieron diariamente 4 g de icosapent-etilo o un aceite mineral con placebo mostraron una reducción del 25% en el criterio de valoración primario de un compuesto de muerte cardiovascular, infarto de miocardio no mortal (ataque al corazón), ictus no mortal, revascularización coronaria o angina inestable [34]. Los análisis posteriores mostraron un beneficio consistente para todos los subgrupos de pacientes y una reducción del 31% de los acontecimientos isquémicos (primeros y posteriores) [35]. La mayoría de los pacientes incluidos en el estudio partían de una HKE existente (71%); casi el 60% padecían diabetes y el nivel medio de triglicéridos era de 2,4 mmol/l. Por ejemplo, la impresionante reducción de acontecimientos se produjo en un grupo de pacientes con alto riesgo cardiovascular, de los que más del 90% fueron tratados con estatinas de intensidad moderada o alta.
Desde esta publicación, las preguntas se han centrado en la diferencia entre el icosapent-etilo, que se utilizó en el estudio REDUCE-IT, y el ácido carboxílico omega-3, que es una mezcla de ácido eicosapentaenoico (EPA) y ácido docosahexaenoico. Este compuesto se utilizó a una dosis de 4 g/día en el estudio STRENGTH (Statin Residual Risk Reduction with Epanoa in High Cardioascular Risk Patients with Hypertriglyceridemia ), un estudio que no mostró ninguna reducción de los acontecimientos cardiovasculares [36]. Aún no se ha podido aclarar del todo si estas diferencias pueden atribuirse a los posibles daños del ácido docosahexaenoico o a la mayor dosis de EPA en el estudio REDUCE-IT en comparación con el estudio STRENGTH. Otra explicación que se ha sugerido es la elección del placebo en el ensayo REDUCE-IT. En el grupo de control de aceite mineral, los niveles de LDL-C, apolipoproteína B y proteína C reactiva aumentaron un 10,9%, 7,8% y 32,3%, respectivamente, lo que sugiere que los beneficios del icosapente-etilo pueden haberse visto parcialmente confundidos por los daños en el grupo de control [34,37]. Sin embargo, la EPA puede tener propiedades que mitiguen algunas de estas diferencias.
Los mecanismos de los beneficios observados en el ensayo REDUCE-IT pueden ser multifactoriales, ya que las reducciones del riesgo observadas superaron las expectativas por el grado de reducción de los triglicéridos. De media, el nivel de triglicéridos disminuyó un 18,3% (-0,44 mmol/l) en el grupo de icosapent-etil, mientras que aumentó un 2,2% en el grupo placebo. Debido a la variación de los triglicéridos, alrededor del 10% de los participantes tenían niveles normales, pero las reducciones del riesgo fueron constantes en todos los niveles iniciales de triglicéridos. Los ácidos grasos omega-3 pueden reducir la inflamación, influir en las arritmias cardiacas debido a la modulación de la fluidez de la membrana y atenuar la formación y progresión de la placa aterosclerótica [38]. Aunque por un lado se produjo una reducción significativa del 30% de las muertes cardiacas súbitas en el grupo de icosapent-etilo en el ensayo REDUCE-IT (un análisis terciario), la tasa de fibrilación auricular fue significativamente mayor en el grupo de icosapent-etilo que en el de placebo (5,3% frente a 3,9%) [34].
A pesar de algunas incertidumbres, una revisión del icosapent-etilo (Vazkepa®) por la EMA en 2021 para la aprobación del fármaco como tratamiento para reducir el riesgo de eventos cardiovasculares en pacientes de alto riesgo tratados con estatinas con triglicéridos elevados (≥1,7 mmol/l) y HKE existente (o diabetes y uno o más factores de riesgo cardiovascular adicionales).
Pemafibrato
Los fibratos son agonistas de los receptores activados por el proliferador de peroxisomas (PPAR) que se han utilizado como fármacos reductores de los triglicéridos durante décadas. Como la mayoría de los estudios incluyeron un amplio abanico de participantes, sus efectos cardioprotectores han sido cuestionados y se observan principalmente en subgrupos con hipertrigliceridemia [39]. El pemafibrato destaca como un nuevo modulador altamente selectivo de PPAR-α que produce reducciones significativas de los triglicéridos y de las partículas de colesterol residual. Sin embargo, un estudio reciente no encontró reducciones significativas en el colesterol no HDL-C [40], lo que sugiere que los posibles efectos beneficiosos pueden estar relacionados principalmente con las reducciones de triglicéridos y residuos de triglicéridos. El estudio PROMINENT en curso (Pemafibrate to Reduce Cardio ascular Outcomes by Reducing Triglycerides in Patients with Diabetes ) ha inscrito a más de 10 000 participantes con DMT2 (prevención primaria o secundaria), triglicéridos de 2,26-5,64 mmol/l y niveles de HDL-C <1,03 mmol/l aleatorizados a pemafibrato o placebo, con el criterio de valoración del estudio determinado por los acontecimientos. Los resultados se presentarán en breve [41]. Los resultados positivos podrían mejorar significativamente el tratamiento de los pacientes con DMT2.
Terapias con apolipoproteína C-III y proteína similar a la angiopoyetina
En el control del metabolismo de los triglicéridos intervienen varias proteínas y vías enzimáticas. Los triglicéridos de los quilomicrones y las lipoproteínas de muy baja densidad se someten a una lipólisis intravascular por la lipoproteína lipasa para liberar ácidos grasos libres que se utilizarán o almacenarán como combustible. Las proteínas centrales que regulan estos procesos son la apolipoproteína C-III (ApoCIII), la proteína 3 similar a la angiopoyetina (ANGPTL3) y la ANGPTL4, todas ellas potentes inhibidores de la lipoproteína lipasa (Fig. 4).
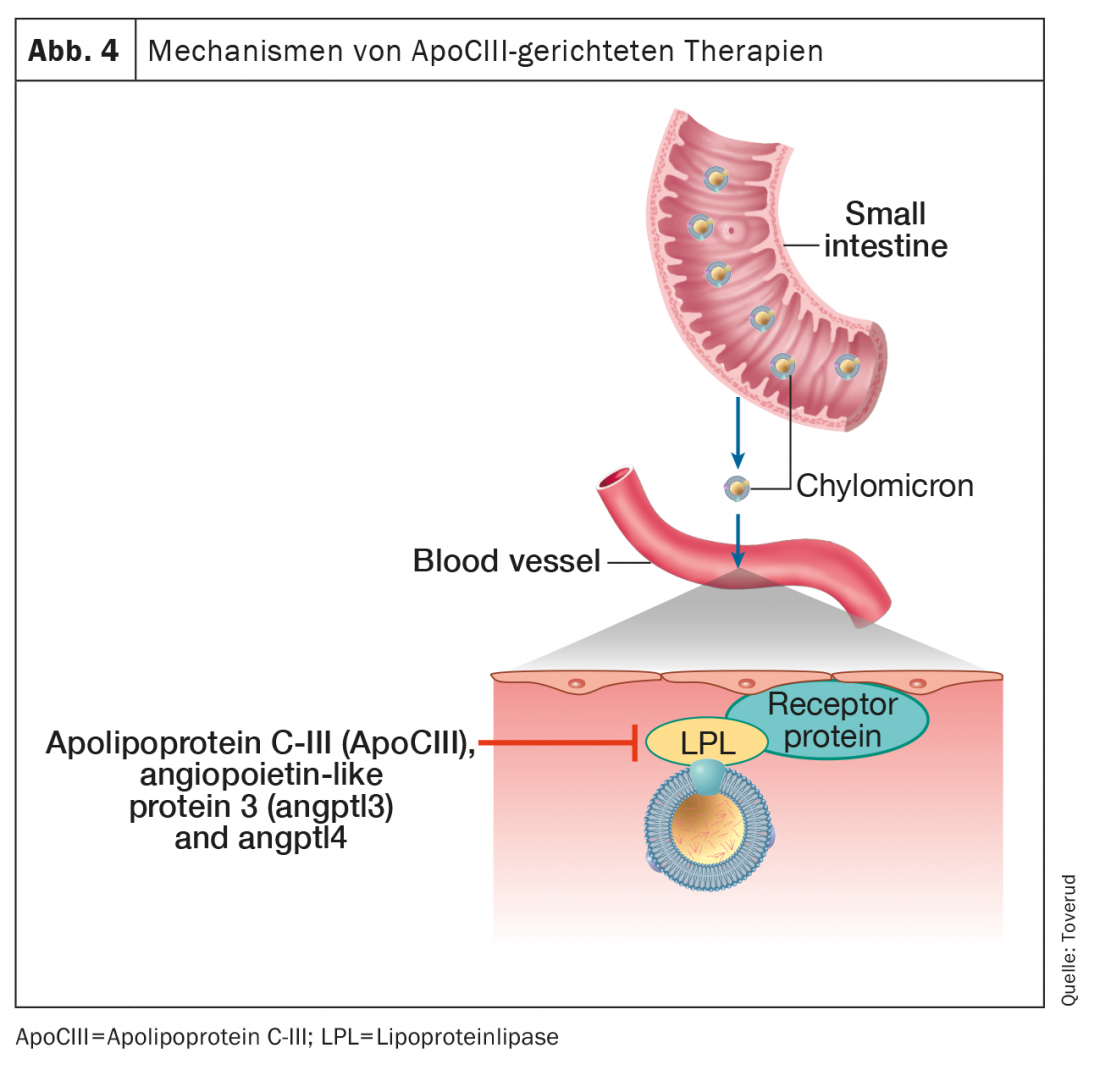
Las pruebas genéticas relacionan las variantes de pérdida de función de la ApoCIII con la reducción de los niveles de triglicéridos y el riesgo cardiovascular [42]. Además, la ApoCIII parece contribuir a la aterogenicidad de varias lipoproteínas a las que está unida, incluidas las HDL [43]. En particular, el bajo riesgo de HKE en heterocigotos con pérdida de función de ApoCIII parece estar mediado por su asociación con un bajo colesterol residual en lugar de un bajo LDL-C [44], lo que establece aún más el papel de los residuos de triglicéridos en la aterosclerosis. Estos conocimientos de la genética y la fisiopatología han actuado como catalizadores clave para el desarrollo de fármacos terapéuticos contra la hipertrigliceridemia mediante la inhibición de la ApoCIII.
Un estudio reciente descubrió que los niveles de ANGPTL3 seguían siendo determinantes independientes de los acontecimientos cardiovasculares tras ajustar los factores de riesgo tradicionales y los medicamentos hipolipemiantes [45].
En consecuencia, se ha demostrado que las mutaciones de pérdida de función en el gen ANGPTL3 están asociadas a la hipobeta-lipoproteinemia y a la reducción de los niveles de triglicéridos y de los niveles de LDL-C y HDL-C, así como al riesgo de enfermedad coronaria [44], mientras que las mutaciones en el gen ANGPTL4 están asociadas a la reducción de los triglicéridos y al aumento de los niveles de colesterol HDL [45]. Los pacientes con deficiencia de ANGPTL3 no mostraron aterosclerosis coronaria [46], lo que lleva a la conclusión de que los bloqueantes de ANGPTL3 podrían ser agentes prometedores de reducción del riesgo. Por otra parte, el desarrollo de inhibidores de angptl4 se vio obstaculizado por la observación de lesiones lipogranulomatosas en el intestino de ratones deficientes en angptl4.
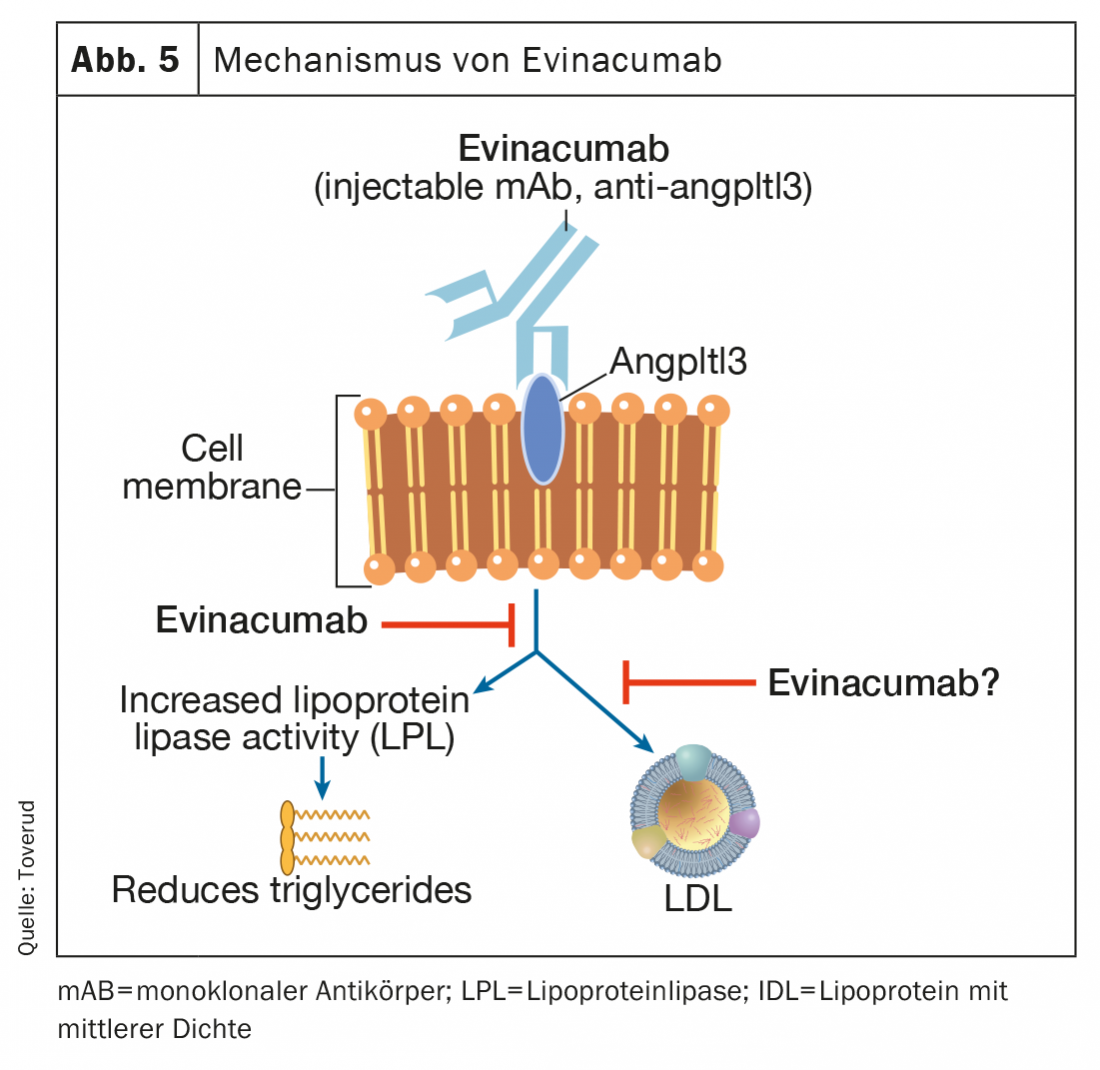
Evinacumab
El evinacumab es un anticuerpo monoclonal totalmente humano que se une a los inhibidores de la angptl3 y los inhibe, aumentando así la actividad de la lipoproteína lipasa (Fig. 5) . El evinacumab reduce los niveles elevados de triglicéridos, pero no en pacientes con triglicéridos gravemente elevados debido a la falta de actividad de la lipoproteína lipasa en el síndrome de hipercilomicronaemia familiar poco frecuente [47,48]. El evinacumab también reduce los niveles de LDL-C a través de un mecanismo independiente de los receptores de LDL que no se conoce del todo. En un reciente estudio de fase 3 en pacientes con HF homocigótica, las infusiones intravenosas mensuales de evinacumab redujeron los niveles de LDL-C en un 47% (49% frente a placebo) y parecieron ser una nueva y prometedora opción de tratamiento para estos pacientes difíciles de tratar [49]. Los síntomas gripales fueron más frecuentes en los pacientes que recibieron evinacumab. Los efectos secundarios a largo plazo en la aterosclerosis y el embarazo se registran a partir de un registro continuo de usuarios. El evinacumab (Evkeeza®) se aprobó en 2021 para el tratamiento de la HF homocigótica a partir de los 12 años.
Vupanorsen
El vupanorsen es un oligonucleótido antisentido del ARNm del ANGPTL3 que se está desarrollando como tratamiento potencial de la dislipidemia [50]. En pacientes con diabetes, esteatosis hepática (hígado graso) e hipertrigliceridemia, el fármaco redujo significativamente los triglicéridos y el colesterol total y no HDL sin reducir el recuento de plaquetas [51].
Volanesorsen
El volanesorsen es un oligonucleótido antisentido contra el ARNm de la Apo-CIII que reduce en gran medida los niveles de triglicéridos y de ApoCIII a través de vías independientes de la lipoproteína lipasa (Fig. 4). Ensayos clínicos controlados aleatorizados han demostrado una reducción de los niveles de triglicéridos de alrededor del 70% y un menor riesgo de pancreatitis aguda asociada a la hipertrigliceridemia [52]. Se ha dado un paso importante en el tratamiento de enfermedades raras en pacientes con síndrome de quilomicronaemia familiar, un trastorno genético raro y potencialmente mortal debido a la pérdida de actividad de la lipoproteína lipasa, caracterizado por una quilomicronaemia con pancreatitis recurrente y pocas opciones terapéuticas. El volanesorsen redujo los niveles de triglicéridos en un 77%, y la mayoría de los participantes alcanzaron niveles de triglicéridos inferiores a 8,5 mmol, un umbral asociado a un riesgo significativamente menor de pancreatitis [53]. El volansorsen redujo la apolipoproteína B-48 en un 76%, pero aumentó el LDL-C en un 136% y la apolipoproteína B total en un 20%. Aunque estos resultados pueden reflejar un posible aumento del riesgo cardiovascular, los niveles de lipoproteínas aterogénicas eran muy bajos, como suele observarse en los pacientes con quilomicronaemia familiar.
Uno de los principales efectos adversos del volanesorsen es la trombocitopenia, que llevó a la FDA a denegar su aprobación, así como la preocupación por las hemorragias graves. Sin embargo, la trombocitopenia se revierte al suspender el fármaco. La EMA ha aprobado el volanesorsen (Waylivra®) en pacientes adultos con síndrome de quilomicronemia familiar en 2019.
Olezarsen
El olezarsen es un oligonucleótido antisentido que se dirige al ARNm de la ApoCIII hepática para inhibir la producción de proteína ApoCIII (Fig. 4). En un estudio reciente, el tratamiento con olezarsen durante 6-12 meses redujo los triglicéridos de forma dependiente de la dosis entre un 23 y un 60 %, sin cambios en el recuento de plaquetas ni en la función hepática o renal, en participantes con triglicéridos elevados y alto riesgo cardiovascular o enfermedad cardiovascular. [51].
Terapias contra la lipoproteína (A) elevada
La relación entre la Lp(a) elevada y las enfermedades cardiovasculares se estableció mediante estudios después de que la molécula fuera identificada en 1968 por Berg en Oslo, Noruega. Un metaanálisis de estudios prospectivos halló un aumento aproximado del riesgo de cardiopatía coronaria de 1,16 (1,11-1,22) por cada aumento de 3,5 veces en la concentración de Lp(a), disminuyendo sólo ligeramente a 1,13 (1,09-1,18) tras el ajuste [54].
También se han demostrado asociaciones entre la Lp(a) y la mortalidad, así como el ictus, la arteriopatía periférica y la estenosis de la válvula aórtica calcificada. Esta breve revisión se centra únicamente en las terapias específicas para la apo(a). Se cree que, aunque algunos estudios han constatado que la reducción de la Lp(a) entre un 20% y un 25% no representaba una reducción del riesgo cardiovascular por encima de la reducción concomitante del LDL-C, esta observación puede explicarse por la suposición de que se requieren grandes reducciones de los niveles absolutos, como han constatado los estudios de las siguientes terapias novedosas [55].
Pelacarsen
El pelacarsen es el oligonucleótido antisentido que se dirige a la producción hepática de apo(a) y es el que más ha progresado en los ensayos finalizados o iniciados (Fig. 6). En comparación con el placebo, el pelacarsén redujo los niveles de Lp(a) de forma consistente y dependiente de la dosis hasta en un 80% en pacientes con niveles elevados y HKE existente [56].
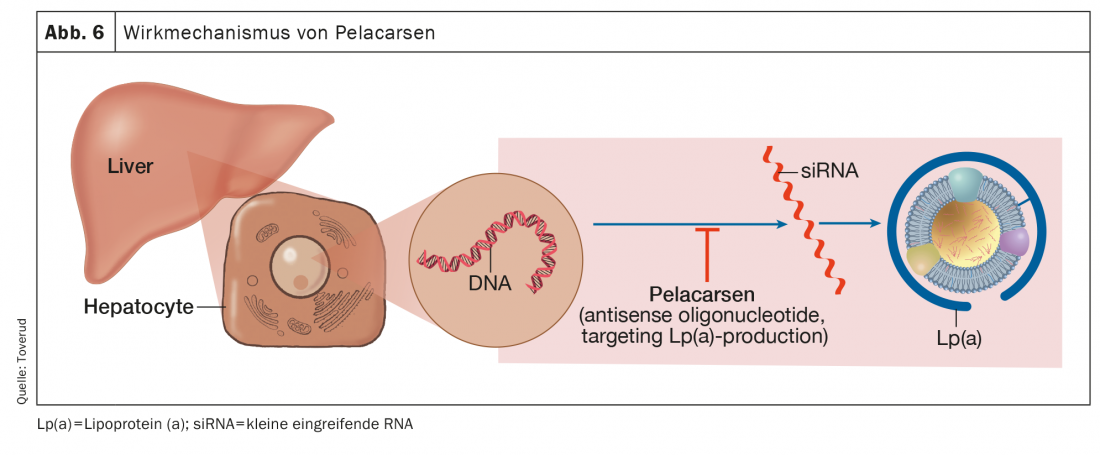
Además, se observaron disminuciones de los fosfolípidos oxidados en la apolipoproteína B y la apo(a), componentes de la Lp(a) susceptibles de tener efectos proinflamatorios. El estudio HORIZON sobre la Lp(a) es un ensayo aleatorizado, doble ciego, controlado con placebo y multicéntrico para evaluar el efecto del pelacarsén sobre los acontecimientos cardiovasculares en pacientes con HKE existente y concentraciones de Lp(a) ≥175 nmol/l [57].
Pequeña terapia de ARN de intervención
El olpasiran, una pequeña molécula de interferencia diseñada para inhibir directamente el ARN mensajero de la Lp(a), mostró grandes reducciones, dependientes de la dosis y duraderas, del 71% al 97% en las concentraciones de Lp(a), con efectos que duraron varios meses [58]. Recientemente, se conocieron los resultados de un estudio de escalada de otra pequeña terapia de ARN de intervención (SLN360), que inhibe la traducción del gen codificante de la apo(A) en los hepatocitos y que también se administró como dosis única. Se observaron reducciones medias de Lp(a) del 98% en el grupo que recibió la dosis más alta después de hasta 150 días [59]. Las cuestiones de seguridad relacionadas con estas dos terapias requerirán estudios más largos y amplios.
Conclusión
En conjunto, existe una necesidad insatisfecha de terapias hipolipemiantes más eficaces, así como de ampliar el arsenal terapéutico actual. Los recientes avances en farmacoterapia sugieren una serie de posibles vías mecanicistas y farmacológicas que se están utilizando con el objetivo de llevar a más pacientes a objetivos lipídicos. Este campo está avanzando más rápido que en las últimas décadas y es posible que en el futuro se produzcan cambios significativos en la forma de abordar la carga aterosclerótica mundial.
Fuente: Este artículo es una publicación secundaria, una traducción del artículo original en inglés publicado en la revista “Kardiol.Pol. se publicó. La referencia es: Cardiol.Pol 2022; 80(7-8): 741-749. doi: 10.33963/KP.a2022.0117.
Damos las gracias a Kari C. Toverud (ilustradora médica certificada) por las figuras.
Mensajes para llevarse a casa
- La aterosclerosis sigue siendo la causa más común de muerte en todo el mundo.
- Gran parte de la aparición y el desarrollo de la aterosclerosis se debe a la dislipidemia.
- Con la llegada de las estatinas, la ezetimiba y, más recientemente, los inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (PCSK9), los médicos de todas las especialidades tienen acceso a un arsenal terapéutico para abordar este importante motor fisiopatológico.
- No obstante, sigue existiendo una gran necesidad insatisfecha de estrategias de optimización para la reducción farmacoterapéutica de los lípidos.
- Se centran en reducir los triglicéridos (TG) o la lipoproteína(a) [Lp(a)].
Literatura:
- OMS: Temas de salud en enfermedades cardiovasculares 2021. Disponible en línea: www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds) (Acceso: 28 de abril de 2022).
- Atar D, Jukema JW, Molemans B, et al: Nuevas directrices de prevención cardiovascular: ¿Cómo gestionar de forma óptima la dislipidemia y el riesgo cardiovascular en 2021 en pacientes que necesitan prevención secundaria? Aterosclerosis 2021; 319: 51-61, doi: 10.1016/j.atherosclerosis.2020.12.013, indexado en Pubmed: 33476944.
- Sverre E, Peersen K, Husebye E, et al: Control desfavorable de los factores de riesgo tras los acontecimientos coronarios en la práctica clínica habitual. BMC Cardiovasc Disord 2017; 17(1): 40, doi: 10.1186/s12872-016-0387-z, indexado en Pubmed: 28109259.
- Setny M, Jankowski P, Kamiński K, et al: Prevención secundaria de la cardiopatía coronaria en Polonia: ¿importa el sexo? Resultados de la encuesta POLASPIRE. Pol Arch Intern Med 2022; 132(3), doi: 10.20452/pamw.16179, indexado en Pubmed: 34935325.
- Mundal L, Igland J, Ose L, et al: Mortalidad por enfermedad cardiovascular en pacientes con hipercolesterolemia familiar genéticamente verificada en Noruega durante 1992-2013. Eur J Prev Cardiol 2017; 24(2): 137-144, doi: 10.1177/2047487316676135, indexado en Pubmed: 27794106.
- Bogsrud MP, Græsdal A, Johansen D, et al: Consecución del objetivo de colesterol LDL, enfermedad cardiovascular y riesgo atribuido de Lp(a) en una gran cohorte de hipercolesterolemia familiar predominantemente verificada genéticamente. J Clin Lipidol. 2019; 13(2): 279-286, doi: 10.1016/j.jacl.2019.01.010, indexado en Pubmed: 30910667.
- Mach F, Baigent C, Catapano AL, et al: Grupo de documentos científicos de la ESC. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020; 41(1): 111-188, doi: 10.1093/eurheartj/ehz455, indexado en Pubmed: 31504418.
- O’Donoghue ML, Giugliano RP, Atar D, et al: Evolocumab a largo plazo en pacientes con enfermedad cardiovascular aterosclerótica establecida. Circulation 2022 Oct 11; 146(15): 1109-1119. doi: 10.1093/eurheartj/ehz430, indexado en Pubmed: 31270529.
- Kastelein JJP, Ginsberg HN, Langslet G, et al: ODYSSEY FH I y FH II: resultados de 78 semanas con tratamiento de alirocumab en 735 pacientes con hipercolesterolemia familiar heterocítica. Eur Heart J 2015; 36(43): 2996-3003, doi: 10.1093/eurheartj/ehv370, indexado en Pubmed: 26330422.
- Raal FJ, Stein EA, Dufour R, et al: Investigadores de RUTHERFORD-2. Inhibición de PCSK9 con evolocumab (AMG 145) en hipercolesterolemia familiar heterocigota (RUTHERFORD-2): ensayo aleatorizado, doble ciego, controlado con placebo. Lancet 2015; 385(9965): 331-340, doi: 10.1016/S0140-6736(14)61399-4, indexado en Pubmed: 25282519.
- Farnier M, Hovingh GK, Langslet G, et al: Seguridad y eficacia a largo plazo del alirocumab en pacientes con hipercolesterolemia familiar heterocigota: Una extensión abierta del programa ODYSSEY. Aterosclerosis 2018; 278: 307-314, doi: 10.1016/j.atherosclerosis.2018.08.036, indexado en Pubmed: 30293878.
- Koren MJ, Sabatine MS, Giugliano RP, et al: Eficacia y seguridad a largo plazo del evolocumab en pacientes con hipercolesterolemia. J Am Coll Cardiol 2019; 74(17): 2132-2146, doi: 10.1016/j.jacc.2019.08.1024, indexado en Pubmed: 31648705.
- Santos RD, Stein EA, Hovingh GK, et al: Evolocumab a largo plazo en pacientes con hipercolesterolemia familiar. J Am Coll Cardiol 2020; 75(6): 565-574, doi: 10.1016/j.jacc.2019.12.020, indexado en Pubmed: 32057369.
- Blom DJ, Harada-Shiba M, Rubba P, et al: Eficacia y seguridad del alirocumab en adultos con hipercolesterolemia familiar homocigota: el ensayo ODYS- SEY HoFH. J Am Coll Cardiol 2020; 76(2): 131-142, doi: 10.1016/j. jacc.2020.05.027, indexado en Pubmed: 32646561.
- Santulli G, Jankauskas SS, Gambardella J: Inclisiran: un nuevo hito en el camino de la PCSK9 para atajar el riesgo cardiovascular. Eur Heart J Cardiovasc Pharmacother 2021; 7(3): e11-e12, doi: 10.1093/ehjcvp/pvab014, indexado en Pubmed: 33655296.
- Cuchel M, Bloedon LT, Szapary PO, et al: Inhibición de la proteína microsomal de transferencia de triglicéridos en la hipercolesterolemia familiar. N Engl J Med 2007; 356(2): 148-156, doi: 10.1056/NEJMoa061189, indexado en Pubmed: 17215532.
- Ballantyne CM, Davidson MH, Macdougall DE, et al: Eficacia y seguridad de un novedoso modulador dual de la adenosina trifosfato-citrato liasa y la adenosina monofosfato-proteína quinasa activada en pacientes con hipercolesterolemia: resultados de un ensayo multicéntrico, aleatorizado, doble ciego, controlado con placebo y de grupos paralelos. J Am Coll Cardiol 2013; 62(13): 1154-1162, doi: 10.1016/j.jacc.2013.05.050, indexado en Pubmed: 23770179.
- Ballantyne CM, McKenney JM, MacDougall DE, et al: Efecto del ETC-1002 sobre el colesterol sérico de lipoproteínas de baja densidad en pacientes hipercolesterolémicos que reciben tratamiento con estatinas. Am J Cardiol 2016; 117(12): 1928-1933, doi: 10.1016/j.amjcard.2016.03.043, indexado en Pubmed: 27138185.
- Ray KK, Bays HE, Catapano AL, et al: Ensayo CLEAR Harmony. Seguridad y eficacia del ácido bempedoico para reducir el colesterol LDL. N Engl J Med 2019; 380(11): 1022-1032, doi: 10.1056/NEJMoa1803917, indexado en Pubmed: 30865796.
- Goldberg AC, Leiter LA, Stroes ESG, et al: Effect of bempedoic acid vs placebo added to maximally tolerated statins on low-density lipoprotein cholesterol in patients at high risk for cardiovascular disease: the CLEAR wisdom randomized clinical trial. JAMA 2019; 322(18): 1780-1788, doi: 10.1001/jama.2019.16585, indexado en Pubmed: 31714986.
- Lin Y, Parco C, Karathanos A, et al: Eficacia clínica y resultados de seguridad del ácido bempedoico para el tratamiento reductor del LDL-C en pacientes con alto riesgo cardiovascular: revisión sistemática y metaanálisis. BMJ Open. 2022; 12(2): e048893, doi: 10.1136/bmjopen-2021-048893, indexado en Pubmed: 35210334.
- Bytyçi I, Penson PE, Mikhailidis DP, et al: Prevalencia de la intolerancia a las estatinas: un metaanálisis. Eur Heart J 2022 [Epub ahead of print]: ehac015, doi: 10.1093/eurheartj/ehac015, indexado en Pubmed: 35169843.
- Wood FA, Howard JP, Finegold JA, et al: Ensayo N-de-1 de una estatina, placebo o ningún tratamiento para evaluar los efectos secundarios. N Engl J Med 2020; 383(22): 2182-2184, doi: 10.1056/NEJMc2031173, indexado en Pubmed: 33196154.
- Herrett E, Williamson E, Brack K, et al: Grupo de ensayo StatinWISE. Statin treatment and muscle symptoms: series of randomised, placebo controlled n-of-1 trials. BMJ. 2021; 372: n135, doi: 10.1136/bmj.n135, indexado en Pubmed: 33627334.
- Laufs U, Banach M, Mancini GB, et al: Eficacia y seguridad del ácido bempedoico en pacientes con hipercolesterolemia e intolerancia a las estatinas. J Am Heart Assoc 2019; 8(7): e011662, doi: 10.1161/JAHA.118.011662, indexado en Pubmed: 30922146.
- Ballantyne CM, Banach M, Mancini GB, et al: Eficacia y seguridad del ácido bempedoico añadido a la ezetimiba en pacientes con hipercolesterolemia intolerantes a las estatinas: Un estudio aleatorizado controlado con placebo. Aterosclerosis 2018; 277: 195-203, doi: 10.1016/j.atherosclerosis.2018.06.002, indexado en Pubmed: 29910030.
- Ballantyne CM, Laufs U, Ray KK, et al: Combinación de dosis fija de ácido bempedoico más ezetimiba en pacientes con hipercolesterolemia y alto riesgo de ECV tratados con estatinas de máxima tolerancia. Eur J Prev Cardiol 2020; 27(6): 593-603, doi: 10.1177/2047487319864671, indexado en Pubmed: 31357887.
- Rubino J, MacDougall DE, Sterling LR, et al: Combinación de ácido bempedoico, ezetimiba y atorvastatina en pacientes con hipercolesterolemia: Un ensayo clínico aleatorizado. Aterosclerosis 2021; 320: 122-128, doi: 10.1016/j.atherosclerosis.2020.12.023, indexado en Pubmed: 33514449.
- McKenney J, MacDougall D, Sterling L, et al: Lipid lowering with bempe- doic acid added to proprotein convertase subtilisin/kexin type 9 inhibitor therapy: a randomized controlled trial. J Clin Lipidol 2019; 13(3): e55-e56, doi: 10.1016/j.jacl.2019.04.092.
- Soehnlein O, Libby P. Targeting inflammation in atherosclerosis – from experimental insights to the clinic. Nature Rev 2021; 20(8): 589-610, doi: 10.1038/s41573-021-00198-1, indexado en Pubmed: 33976384.
- Ginsberg HN, Packard CJ, Chapman MJ, et al: Triglyceride-rich lipoproteins and their remnants: metabolic insights, role in atherosclerotic cardiovascular disease, and emerging therapeutic strategies-a consensus statement from the European Atherosclerosis Society. Eur Heart J 2021; 42(47): 4791-4806, doi: 10.1093/eurheartj/ehab551, indexado en Pubmed: 34472586.
- Bello-Chavolla OY, Kuri-García A, Ríos-Ríos M, et al: Hiperlipidemia familiar combinada: conocimientos actuales, perspectivas y controversias. Rev In- vest Clin. 2018; 70(5): 224-236, doi: 10.1007/springerreference_35144, indexado en Pubmed: 30307446.
- Aung T, Halsey J, Kromhout D, et al.: Omega-3 Treatment Trialists’ Collaboration. Asociaciones del uso de suplementos de ácidos grasos omega-3 con los riesgos de enfermedad cardiovascular: metaanálisis de 10 ensayos con 77 917 individuos. JAMA Cardiol 2018; 3(3): 225-234, doi: 10.1001/jamacardio.2017.5205, indexado en Pubmed: 29387889.
- Bhatt DL, Steg PG, Miller M, et al: Investigadores de REDUCE-IT. Reducción del riesgo cardiovascular con icosapent etil para la hipertrigliceridemia. N Engl J Med. 2019; 380(1): 11-22, doi: 10.1056/NEJMoa1812792, indexado en Pubmed: 30415628.
- Peterson BE, Bhatt DL, Steg PhG, et al: REDUCE-IT Investigators, RE- DUCE-IT Investigators, REDUCE-IT Investigators. Efectos del icosapent etil en los eventos isquémicos totales: de REDUCE-IT. J Am Coll Cardiol 2019; 73(22): 2791-2802, doi: 10.1016/j.jacc.2019.02.032, indexado en Pubmed: 30898607.
- Nicholls SJ, Lincoff AM, García M, et al: Efecto de las altas dosis de ácidos grasos omega-3 frente al aceite de maíz sobre los principales acontecimientos cardiovasculares adversos en pacientes con alto riesgo cardiovascular: el ensayo clínico aleatorizado STRENGTH. JAMA 2020; 324(22): 2268-2280, doi: 10.1001/jama.2020.22258, indexado en Pubmed: 33190147.
- Doi T, Langsted A, Nordestgaard BG: Una posible explicación de los resultados contrastados de REDUCE-IT frente a STRENGTH: estudio de cohortes que imita los diseños de los ensayos. Eur Heart J 2021; 42(47): 4807-4817, doi: 10.1093/eu-rheartj/ehab555, indexado en Pubmed: 34455435.
- Mason RP, Libby P, Bhatt DL: Mecanismos emergentes de protección cardiovascular del ácido graso omega-3 eicosapentaenoico. Arterio- scler Thromb Vasc Biol 2020; 40(5): 1135-1147, doi: 10.1161/ATVBA-HA.119.313286, indexado en Pubmed: 32212849.
- Liu ZL, Li GQ, Bensoussan A, et al: Efectos de los fibratos en los resultados cardiovasculares: una revisión sistemática y metaanálisis. Lancet 2010; 375(9729): 1875-1884, doi: 10.1016/S0140-6736(10)60656-3, indexado en Pubmed: 20462635.
- Ginsberg HN, Hounslow NJ, Senko Y, et al: Eficacia y seguridad del K-877 (pe-mafibrato), un modulador selectivo de pparα, en pacientes europeos en tratamiento con estatinas. Diabetes Care 2022; 45(4): 898-908, doi: 10.2337/dc21-1288, indexado en Pubmed: 35238894.
- Pradhan AD, Paynter NP, Everett BM, et al: Justificación y diseño del estudio pemafibrato para reducir los resultados cardiovasculares mediante la reducción de los triglicéridos en pacientes con diabetes (PROMINENT). Am Heart J 2018; 206: 80-93, doi: 10.1016/j.ahj.2018.09.011, indexado en Pubmed: 30342298.
- Dib I, Khalil A, Chouaib R, et al: Apolipoproteína C-III y enfermedades cardiovasculares: cuando la genética se encuentra con las patologías moleculares. Mol Biol Rep 2021; 48(1): 875-886, doi: 10.1007/s11033-020-06071-5, indexado en Pubmed: 33389539.
- Wulff AB, Nordestgaard BG, Tybjærg-Hansen A. Mutaciones de pérdida de función de APOC3, colesterol remanente, colesterol de lipoproteínas de baja densidad y riesgo cardiovascular: mediación y metaanálisis de 137 895 individuos. Arterioscler Thromb Vasc Biol 2018; 38(3): 660-668, doi: 10.1161/AT- VBAHA.117.310473, indexado en Pubmed: 29348120.
- Stitziel NO, Khera AV, Wang X, et al.: PROMIS and Myocardial Infarction Genetics Consortium Investigators. Deficiencia de ANGPTL3 y protección contra la enfermedad arterial coronaria. J Am Coll Cardiol 2017; 69(16): 2054-2063, doi: 10.1016/j.jacc.2017.02.030, indexado en Pubmed: 28385496.
- Dewey FE, Gusarova V, O’Dushlaine C, et al: Variantes inactivadoras en ANGPTL4 y riesgo de enfermedad arterial coronaria. N Engl J Med 2016; 374(12): 1123-1133, doi: 10.1056/NEJMoa1510926, indexado en Pubmed: 26933753.
- Hussain A, Sun C, Selvin E, et al: Triglyceride-rich lipoproteins, apolipo- protein C-III, angiopoietin-like protein 3, and cardiovascular events in older adults: Atherosclerosis Risk in Communities (ARIC) study. Eur J Prev Cardiol 2022; 29(2): e53-e64, doi: 10.1093/eurjpc/zwaa152, indexado en Pubmed: 33580780.
- Ahmad Z, Banerjee P, Hamon S, et al: La inhibición de la proteína 3 similar a la angiopoyetina con un anticuerpo monoclonal reduce los triglicéridos en la hipertri- gliceridemia. Circulation 2019; 140(6): 470-486, doi: 10.1161/CIRCULATIONAHA.118.039107, indexado en Pubmed: 31242752.
- Ahmad Z, Pordy R, Rader D, et al: Inhibición de la proteína 3 similar a la angiopoyetina con evinacumab en sujetos con hipertrigliceridemia alta y grave. J Am Coll Cardiol 2021; 78(2): 193-195, doi: 10.1016/j.jacc.2021.04.091, indexado en Pubmed: 34238441.
- Raal FJ, Rosenson RS, Reeskamp LF, et al: ELIPSE HoFH Investiga- tors. Evinacumab para la hipercolesterolemia familiar homocigota. N Engl J Med 2020; 383(8): 711-720, doi: 10.1056/NEJMoa2004215, indexado en Pubmed: 32813947.
- Gaudet D, Karwatowska-Prokopczuk E, Baum SJ, et al: Vupanorsen, un fármaco antisentido del ARNm ANGPTL3 conjugado con N-acetilgalactosamina, reduce los triglicéridos y las lipoproteínas aterogénicas en pacientes con dia- betes, esteatosis hepática e hipertrigliceridemia. Eur Heart J 2020; 41(40): 3936-3945, doi: 10.1093/eurheartj/ehaa689, indexado en Pubmed: 32860031.
- Tardif JC, Karwatowska-Prokopczuk E, Amour ES, et al: Reducción de la apolipoproteína C-III en sujetos con hipertrigliceridemia moderada y alto riesgo cardiovascular. Eur Heart J. 2022; 43(14): 1401-1412, doi: 10.1093/eu- rheartj/ehab820, indexado en Pubmed: 35025993.
- Gelrud A, Digenio A, Alexander V, et al: El tratamiento con volanesorsen redujo los triglicéridos y la pancreatitis en pacientes con FCS y sHTG frente a placebo: resultados de los estudios APPROACH y COMPASS. Aterosclerosis; 32(Suppl 2018): 157-158.
- Witztum JL, Gaudet D, Freedman SD, et al: Volanesorsen y niveles de triglicéridos en el síndrome de quilomicronemia familiar. N Engl J Med. 2019; 381(6): 531-542, doi: 10.1056/nejmoa1715944, indexado en Pubmed: 31390500.
- Erqou S, Kaptoge S, Perry PL, et al.: Colaboración de Factores de Riesgo Emergentes. Concentración de lipoproteína(a) y riesgo de cardiopatía coronaria, ictus y mortalidad no vascular. JAMA 2009; 302(4): 412-423, doi: 10.1001/jama.2009.1063, indexado en Pubmed: 19622820.
- Ference BA: El beneficio clínico potencial de reducir la lipoproteína(a). JAMA 2022 [Epub ahead of print], doi: 10.1001/jama.2022.5333, indexado en Pubmed: 35368050.
- Tsimikas S, Karwatowska-Prokopczuk E, Xia S, et al: Investigadores del estudio AKCEA-APO(a)-LRx. Reducción de la lipoproteína (a) en personas con enfermedades cardiovasculares. N Engl J Med 2020; 382(3): 244-255, doi: 10.1056/NEJ-Moa1905239, indexado en Pubmed: 31893580.
- Evaluación del impacto de la reducción de la lipoproteína (a) con Pelacarsen (TQJ230) sobre los principales acontecimientos cardiovasculares en pacientes con ECV. https://clinicaltrials.gov/ct2/show/NCT04023552 (28 de abril de 2022).
- Koren MJ, Moriarty PM, Baum SJ, et al: Desarrollo preclínico y ensayo de fase 1 de un nuevo ARNsi dirigido a la lipoproteína(a). Nat Med 2022; 28(1): 96-103, doi: 10.1038/s41591-021-01634-w, indexado en Pubmed: 35027752.
- Nissen SE, Wolski K, Balog C, et al: Single ascending dose study of a short interfering RNA targeting lipoprotein (a) production in individuals with elevated plasma lipoprotein(a) levels. JAMA 2022 [Epub ahead of print], doi: 10.1001/jama.2022.5050, indexado en Pubmed: 35368052.
CARDIOVASC 2022; 21(4): 6-15











