Debido a la especial fisiopatología y a las opciones terapéuticas que pueden derivarse de ella, el médico general desempeña un papel decisivo en el diagnóstico y la terapia del dolor neuropático. Todo médico debería estar familiarizado con los conocimientos esenciales de diagnóstico clínico y de equipamiento, así como con las opciones terapéuticas. No es infrecuente que sea necesario remitir al paciente a expertos en neurología o neurocirugía o a una consulta o clínica del dolor interdisciplinar y multimodal.
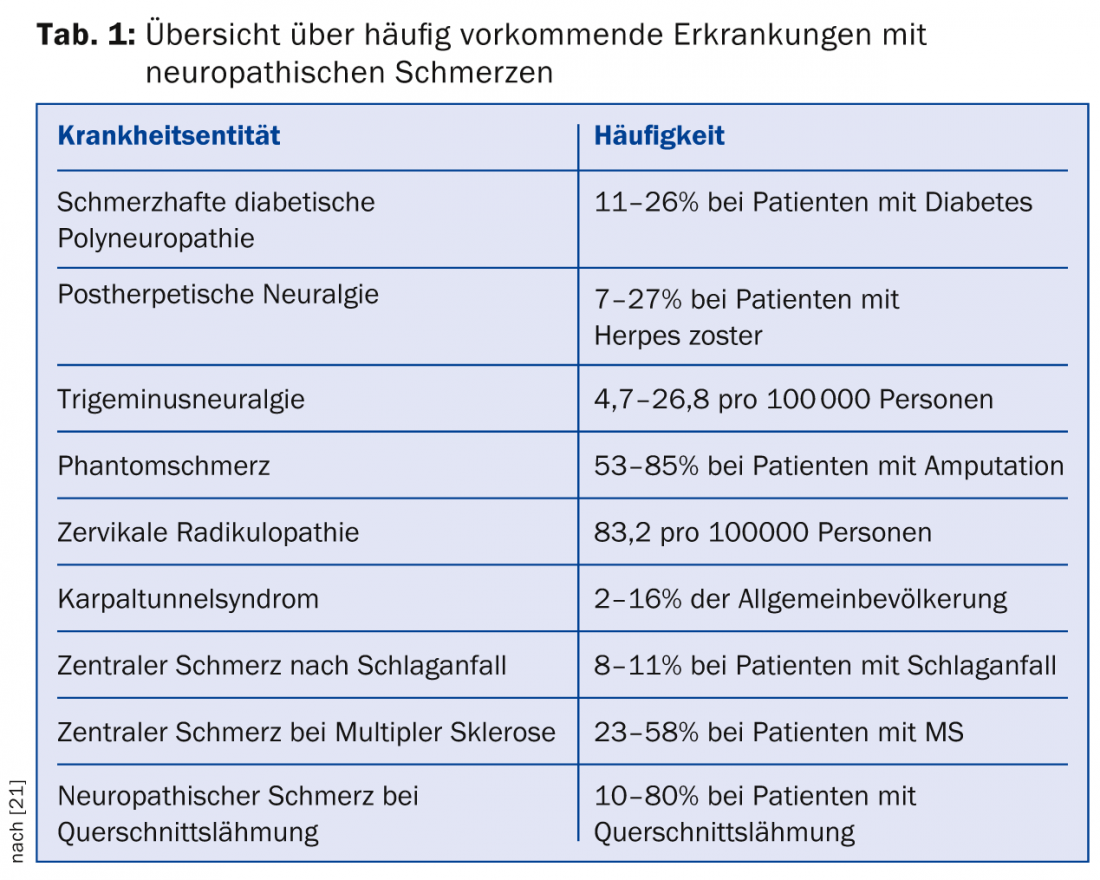
La prevalencia del dolor neuropático en la medicina general se sitúa en torno al 8%; esta elevada prevalencia subraya la importancia del médico general en el diagnóstico y tratamiento de estos síntomas [1]. La tabla 1 ofrece una visión general de la prevalencia de las enfermedades comunes asociadas al dolor neuropático.
¿Cómo se define el dolor neuropático?
La Asociación Internacional para el Estudio del Dolor (IASP) define el dolor neuropático como “el dolor causado por una lesión o enfermedad del sistema somatosensorial” [2]. El sistema somatosensorial es la parte del sistema nervioso que procesa la información procedente de los receptores cutáneos, articulares y musculares y media en la percepción de cualidades sensoriales como la presión, el tacto, el dolor y la temperatura. Implica a los nervios aferentes periféricos, sus vías centrales de conducción y los centros de procesamiento como el tálamo y el córtex somatosensorial.
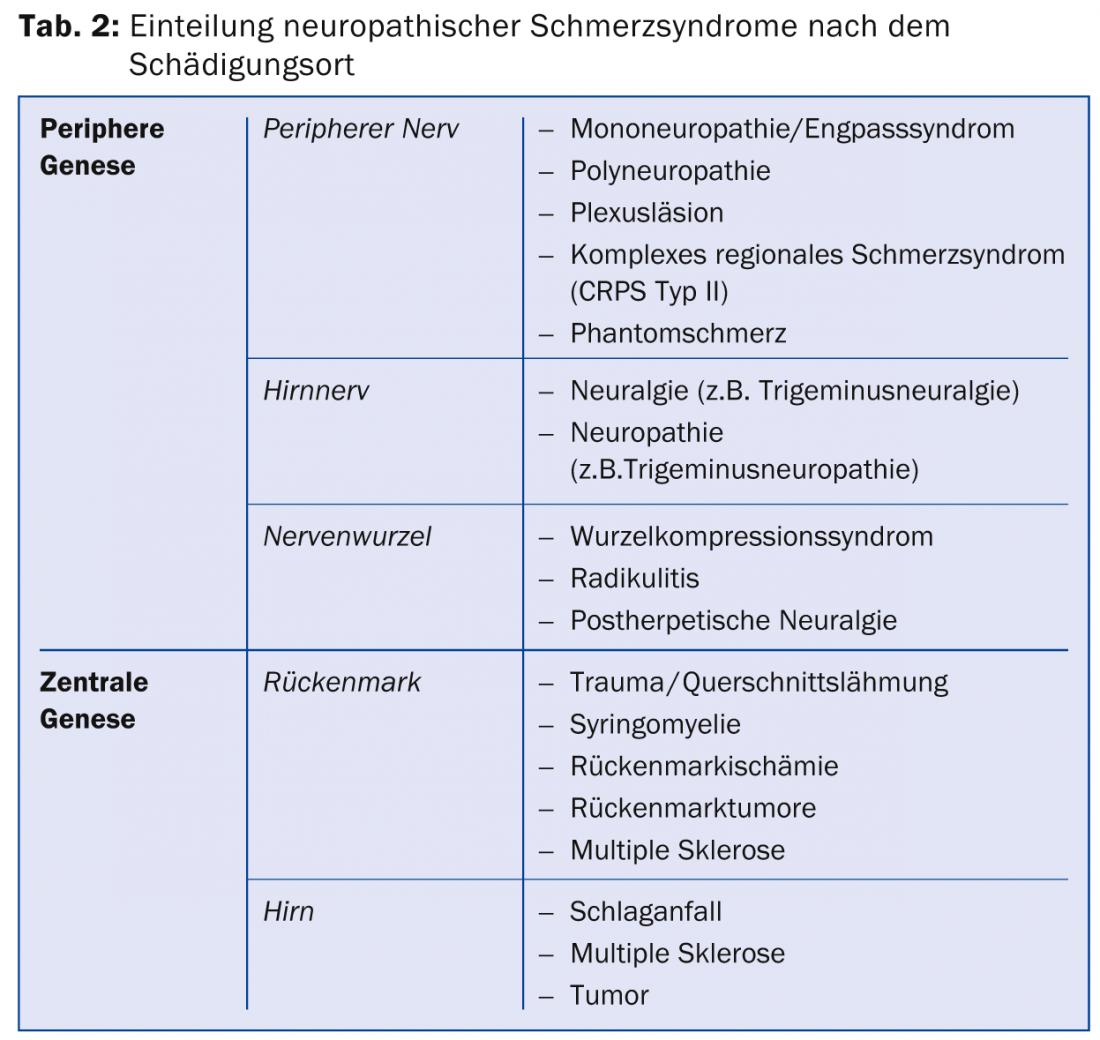
Dependiendo de la localización de la lesión nerviosa, esto da lugar a determinados síndromes de dolor neuropático (Tab. 2) . La causa puede variar en función de la enfermedad.
Una forma especial es el síndrome de dolor regional complejo (SDRC) de tipo I, es decir, sin daño nervioso detectable. Según los nuevos criterios diagnósticos mencionados, ya no puede clasificarse claramente como un síndrome de dolor neuropático porque la localización de la lesión nerviosa no está clara, aunque se dan varios indicios de fenómenos neuropáticos. Por lo tanto, se aplican criterios diagnósticos especiales teniendo en cuenta la información anamnésica y los hallazgos clínicos relativos a la alodinia, la hiperalgesia, las anomalías de la temperatura cutánea, el color de la piel, la sudoración, la formación de edemas, la función motora, así como el crecimiento de las uñas y el vello en la zona del dolor en una comparación lateral sin cierta distribución dermatomal [3]. En el SDRC tipo II, los síntomas son idénticos, pero puede detectarse una lesión nerviosa inicial.
Del patomecanismo al dolor neuropático
Una lesión (por ejemplo, una lesión por presión de la raíz nerviosa debida a una hernia discal) o una enfermedad (por ejemplo, un daño en las fibras nerviosas debido a la hiperglucemia en la diabetes) que afecte al sistema somatosensorial se asocia con la liberación de citocinas proinflamatorias como el TNF-α y de factores neurotróficos como el NGF. Esta liberación conduce a la formación de canales iónicos como los canales de Na+ o también de receptores como el TRPV1 o los receptores NA (noradrenalina), tanto en las células nerviosas dañadas como en las vecinas sanas. Como resultado, se producen fenómenos correspondientes al dolor neuropático. Por ejemplo, la acumulación de canales de Na+ conduce al desarrollo de la llamada excitación nerviosa ectópica espontánea, que se manifiesta clínicamente en dolor electrizante y punzante cuando se ven afectadas las fibras C y A-δ conductoras del dolor. En caso de afectación de las fibras A-β, que median los estímulos mecánicos, la excitación nerviosa ectópica puede manifestarse únicamente en sensaciones de hormigueo.
El receptor TRPV1 está implicado en el mecanismo de sensibilización periférica. Clínicamente, esta sensibilización puede manifestarse en dolor ardiente constante o hiperalgesia al calor. Como resultado de la constante señalización ectópica de las fibras C dañadas, también se produce la denominada sensibilización central en el punto en el que la fibra del dolor periférico del asta posterior de la médula espinal pasa a la vía central del dolor (médula anterior). Los mecanismos de adaptación, como una mayor acumulación de canales de Ca++ así como de receptores NMDA, conducen a una amplificación de la señal, por ejemplo a una sensación dolorosa de aumento de los picos, la hiperalgesia de Prinprick, o a una sensación dolorosa al tacto, la llamada alodinia [4,5].
Diagnóstico del dolor neuropático
En todos los pacientes con dolor en la práctica clínica, debe examinarse el patrón de dolor en busca de indicios de mecanismos de dolor neuropático. Según las directrices europeas para el diagnóstico del dolor neuropático, debe prestarse atención a los siguientes puntos (Tab. 3) [6].

Anamnesis: En la anamnesis, debe comprobarse el carácter del dolor en busca de indicios de signos neuropáticos (ardor, electrizante, hormigueo, constricción). Además, se examina si la localización corresponde a una distribución neurológicamente plausible (por ejemplo, distribución dermatómica, hemiparesia, distribución distal-simétrica). También debe buscarse una lesión (por ejemplo, indicios de hernia discal) o una enfermedad (por ejemplo, diabetes mellitus) que pueda causar un síndrome de dolor neuropático.
Examen clínico: El examen clínico consiste en buscar signos sensoriales positivos o negativos para las diferentes cualidades somatosensoriales. Se examina la zona sospechosa de dolor para comprobar si aumenta o disminuye la sensación táctil (por ejemplo, con un bastoncillo de algodón, un cepillo), si aumenta o disminuye la sensación de dolor (por ejemplo, con un estímulo de pinchazo) o si aumenta o disminuye la sensación de temperatura (por ejemplo, con un estímulo frío). Si existen antecedentes de polineuropatía, la exploración se realiza comparando la proximal (muslo) con la distal (dorso del pie) [7].
Diagnóstico aparente: Pueden realizarse más pruebas diagnósticas para verificar la disfunción neurológica subyacente, por ejemplo, pruebas de imagen para sospechar dolor tras un derrame cerebral o sospecha de hernia discal o exámenes neurofisiológicos para confirmar una lesión nerviosa (por ejemplo, sospecha de radiculopatía, síndrome del túnel carpiano o polineuropatía).
Cuantos más indicios haya, más seguro podrá evaluarse el diagnóstico de sospecha de dolor neuropático. Si el diagnóstico es incierto o poco claro, el paciente debe ser presentado a un neurólogo o a un centro del dolor. En los centros del dolor se dispone de herramientas de diagnóstico especiales, como las pruebas sensoriales cuantitativas (QST), los potenciales evocados por calor de contacto (CHEPS), los potenciales evocados por láser (LEP) o la biopsia cutánea, que pueden utilizarse, por ejemplo, para examinar la función de las pequeñas fibras nerviosas conductoras del dolor, como las fibras A-δ y las fibras C, y para confirmar o invalidar el diagnóstico de dolor neuropático [7,8]. La ecografía es cada vez más importante en la búsqueda de una lesión nerviosa focal de los nervios periféricos [9].
Diagnóstico diferencial importante nociceptivo frente a neuropático
Inicialmente, un paciente puede presentarse con un problema circunscrito como dolor de espalda y piernas. El examen clínico sugiere radiculopatía con evidencia de hernia discal en la resonancia magnética. Aunque el diagnóstico y la terapia parecen sencillos en este caso, la visión siempre debe ir más allá. No es infrecuente encontrar que el cuadro clínico, que a primera vista parece monosintomático, es sólo la punta de una enfermedad multilocular, de dolor crónico, posiblemente ya se han realizado varias operaciones de espalda, por ejemplo. En el paciente con dolor crónico, el diagnóstico de dolor neuropático con radiculopatía, que estaba claro al principio, puede por tanto desempeñar un papel subordinado, ya que se añaden otros aspectos biopsicosociales de la cronificación del dolor, lo que se demuestra por el hecho de que las opciones terapéuticas que conocemos tienen poco efecto.
Los factores biológicos pueden ser el acontecimiento neurológico inicial que, con el paso del tiempo, adquiere un componente miofascial o nociceptivo con factores musculares como resultado de una mala postura. Los factores psicológicos son, por ejemplo, un desarrollo depresivo resultante y conceptos inadecuados de la enfermedad, los factores sociales reflejan la interacción del dolor en la vida profesional y privada. En este contexto, el diagnóstico diferencial con respecto al dolor nociceptivo y miofascial es importante. Siempre debe intentarse eliminar el componente de dolor nociceptivo.
Los indicios de dolor nociceptivo son el dolor que se intensifica o atenúa en función del movimiento o los cambios debidos a un cambio de posición. Suele haber sensibilidad de las estructuras musculoesqueléticas, pero no siempre evidencia de patología esquelética en las imágenes. Normalmente, los pacientes describen el dolor como sordo, opresivo o tirante. La descripción del dolor ardiente debe cuestionarse críticamente, ya que esta descripción no es patognomónica del dolor neuropático: el dolor miofascial también suele describirse como ardiente.
También debe diferenciarse el dolor de aparición súbita: La aparición del dolor sólo durante el movimiento tiende a correlacionarse con el dolor nociceptivo, mientras que la aparición del dolor neuropático suele producirse en reposo, especialmente al atardecer o por la noche. Esta importante distinción se refleja en la literatura reciente, donde existen varias propuestas de clasificación del dolor en diferentes afecciones neurológicas, por ejemplo la clasificación del dolor en el ictus [10], en la paraplejia [11] y en la esclerosis múltiple [12]. Estas clasificaciones subrayan que, incluso con una enfermedad neurológica subyacente, el dolor no tiene por qué ser necesariamente neuropático.
El síndrome de dolor postquirúrgico persistente (PPSP), cada vez más discutido en la literatura, tiene un estatus especial [13]. El PPSP, con una incidencia del 14,8% tras la cirugía, es fisiopatológicamente poco conocido y tiene aspectos tanto nociceptivos como neuropáticos [14,15]. Aquí se incluyen los síndromes que conocemos, como el dolor postmastectomía, el dolor postoracotomía, el dolor postherniotomía y otros.
Aspectos terapéuticos multimodales
Si el dolor es complejo, los componentes individuales del dolor también deben tratarse de forma especializada o el paciente debe ser derivado a una consulta interdisciplinar y multimodal del dolor o a una clínica especializada en el dolor. -clínica. En las prioridades terapéuticas, la terapia farmacológica antineuropática, la fisioterapia y el tratamiento psicológico del dolor deben estar en pie de igualdad. Además, la terapia intervencionista del dolor puede aportar una importante contribución diagnóstica y terapéutica. Sin embargo, los datos actuales muestran que la eficacia de las intervenciones de medicina intervencionista para el dolor se basa en pruebas débiles [16], por lo que estas intervenciones terapéuticas deberían llevarse a cabo en consultas o clínicas del dolor con experiencia en este campo. Por ejemplo, sólo hay recomendaciones débiles para las inyecciones epidurales en caso de herpes zóster, las inyecciones de esteroides en caso de radiculopatía y la aplicación de un estimulador de la médula espinal en caso del llamado “síndrome de la cirugía de espalda fallida” (dolor de espalda y piernas sin cambios tras una operación de espalda), o para la aplicación de un estimulador de la médula espinal en caso de “dolor de espalda”. en el CRPS tipo I. La situación de los datos no es concluyente para una serie de procedimientos terapéuticos intervencionistas para diversos cuadros clínicos [16].
Fundamentos de la farmacoterapia
Los mecanismos fisiopatológicos pueden utilizarse farmacoterapéuticamente mediante antagonistas del Na+ (por ejemplo, carbamazepina, oxcarbazepina, lamotrigina), moduladores de los canales de Ca++ (gabapentina, pregabalina) o también antagonistas del TRPV1 (capsaicina) específicamente contra el dolor neuropático. Además, las vías espinales descendentes, inhibitorias, que se originan en el tronco encefálico e inhiben la transmisión de los estímulos dolorosos en la médula espinal, pueden utilizarse terapéuticamente. Los tricíclicos (amitriptilina) y los inhibidores de la recaptación de serotonina y noradrenalina (duloxetina, venlafaxina) alivian el dolor al aumentar esta inhibición. Los opiáceos inhiben la transmisión de las señales de dolor uniéndose a los receptores µ o kappa, por lo que también pueden utilizarse para tratar el dolor neuropático. Los opiáceos más nuevos, como el tapentadol y la buprenorfina, pueden ser superiores a los opiáceos convencionales porque el tapentadol tiene un efecto inhibidor descendente adicional (se une a los receptores de noradrenalina) y la buprenorfina tiene una propiedad adicional de bloqueo del canal K+. El tramadol también inhibe adicionalmente las vías inhibitorias descendentes. El gel de lidocaína al 5%, que actúa como bloqueante de los canales de Na+, puede aplicarse tópicamente para las mononeuropatías dolorosas circunscritas como la neuralgia posherpética.
Dependiendo del mecanismo subyacente del dolor, también deben considerarse terapias causales, por ejemplo un control óptimo del azúcar en sangre en los diabéticos o intervenciones quirúrgicas (cirugía Janetta para la neuralgia del trigémino, descompresión para la hernia discal).
Los objetivos del tratamiento farmacológico son reducir el dolor en más de un 50%, mejorar la calidad del sueño, mantener la actividad social y las relaciones sociales y conservar la capacidad de trabajar. Esto requiere una titulación de los fármacos antineuropáticos, teniendo en cuenta el efecto y el efecto secundario, con una duración de la terapia suficiente y una dosis suficientemente alta. También suelen ser necesarias las terapias combinadas de diferentes grupos de fármacos.
Tratamiento farmacológico del dolor neuropático generado periférica y centralmente
Las actuales directrices suizas para el tratamiento del dolor neuropático [7] están en consonancia con las directrices internacionales [17,18]. Para la terapia general del dolor neuropático generado periféricamente, se dispone de tricíclicos, moduladores de los canales de calcio e inhibidores selectivos de la recaptación de serotonina y norepinefrina (IRSN) como agentes terapéuticos de primera línea (tab. 4) [17]. Los opiáceos pueden utilizarse como fármacos de segunda línea. En términos de eficacia, los opiáceos no difieren de los fármacos de primera línea, pero presentan una mayor tasa de efectos secundarios en comparación con los tricíclicos y la gabapentina, y existe el riesgo de una posible hiperalgesia inducida por opiáceos o el desarrollo de una dependencia a los mismos.
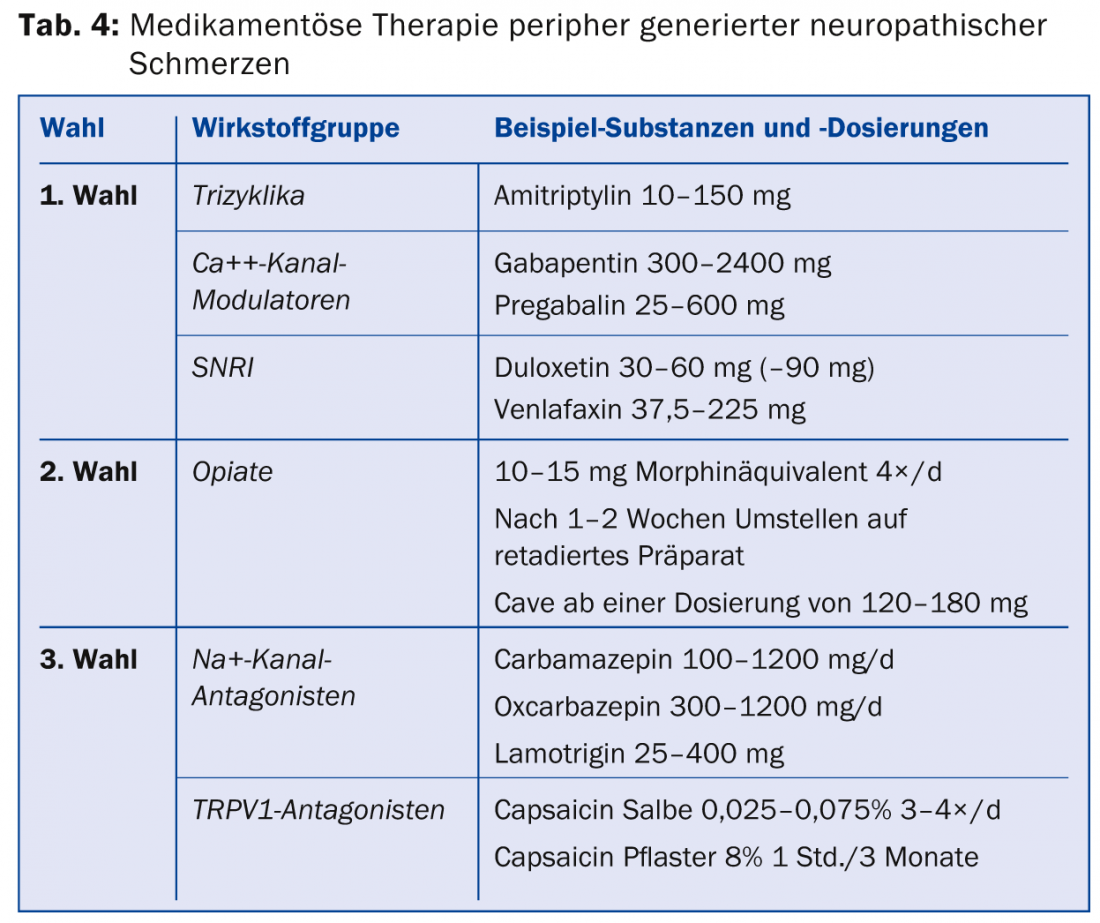
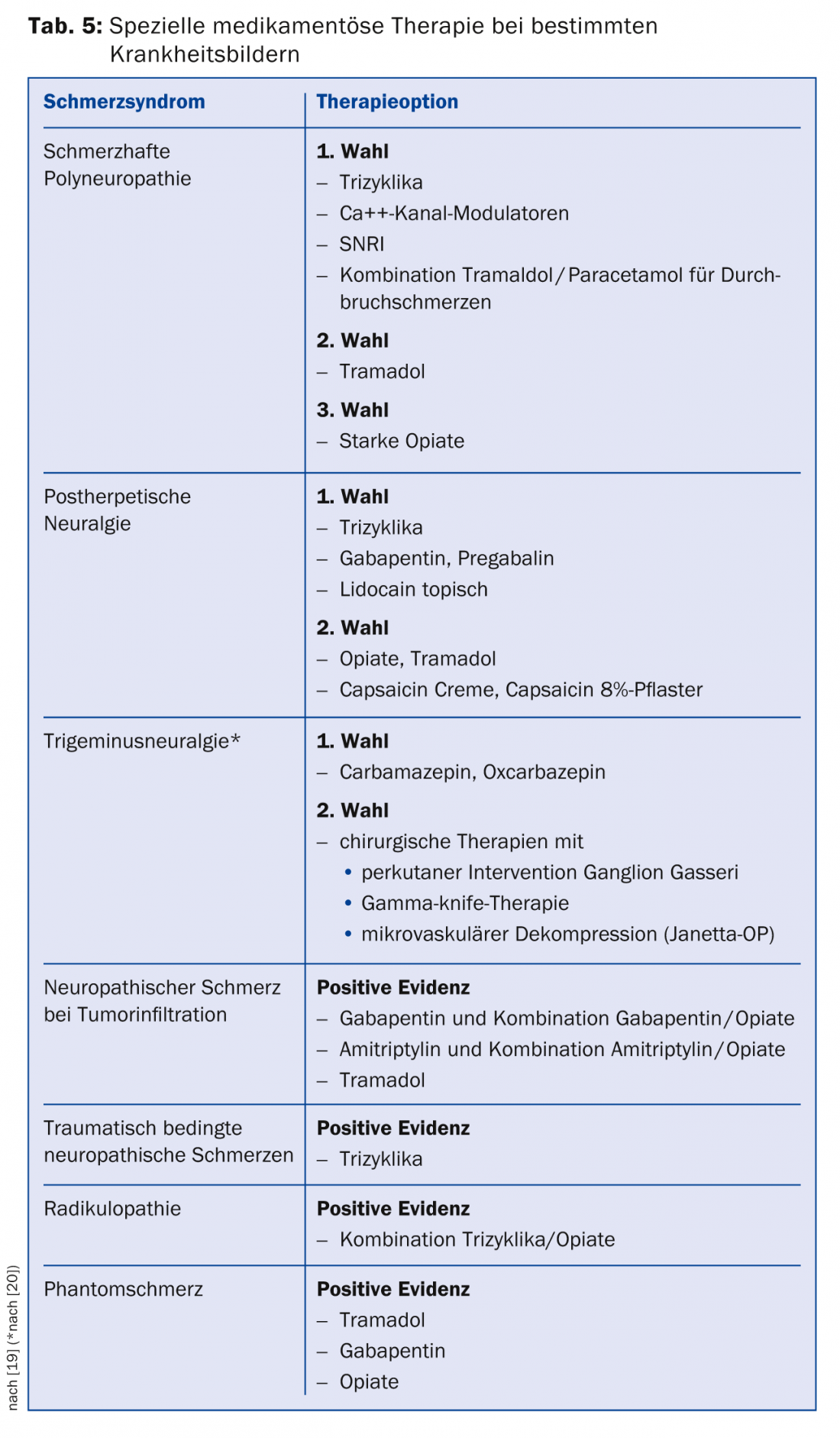
Si el dolor no puede aliviarse suficientemente con estos medicamentos, existen terapias de tercera elección para las que sólo se dispone de un estudio positivo o la situación de los datos es incoherente. Los representantes de esta clase son los antagonistas de los canales de Na+, los inhibidores selectivos de la recaptación de serotonina (ISRS), los análogos de la lidocaína y también la capsaicina. En Suiza, la capsaicina (parche al 8%) está aprobada para el tratamiento del dolor neuropático periférico en adultos que no padecen diabetes. Para ser reembolsado por la caja del seguro de enfermedad, normalmente hay que presentar una solicitud de aprobación de gastos. La capsaicina debe aplicarse en las consultas del dolor. Existen recomendaciones especiales para cuadros clínicos individuales (Tab. 5) [19].
Para el tratamiento del dolor neuropático generado centralmente, las opciones son más limitadas [8]. Los agentes terapéuticos de primera línea son los tricíclicos para el dolor post-ictus y los moduladores de los canales de Ca++ para el dolor post-lesión medular. Los fármacos de segunda línea son el tramadol y los opiáceos fuertes, así como la lamotrigina para el ictus y la paraplejia incompleta con alodinia, y los cannabinoides para la esclerosis múltiple, pero sólo después de que hayan fracasado otras terapias (tab. 6) .

Si estos medicamentos no son eficaces o existen contraindicaciones, se puede recurrir a medicamentos de primera y segunda elección para el dolor neuropático generado periféricamente.
Conclusión para la práctica
- Para el diagnóstico clínico del dolor neuropático, es importante conocer los signos sensoriales positivos y negativos.
- La sospecha diagnóstica de dolor neuropático debe hacerse ya en la consulta del médico general.
- Para confirmar el diagnóstico, suele estar indicada una aclaración neurológica y, en los casos poco claros o resistentes a la terapia, la derivación a una consulta o clínica interdisciplinar del dolor.
- El diagnóstico diferencial entre el dolor nociceptivo y el neuropático también desempeña un papel en las enfermedades neurológicas primarias.
- El tratamiento del dolor neuropático requiere a menudo un equipo interdisciplinar y multimodal.
- Se dispone de tricíclicos, IRSN y moduladores de los canales de Ca++ para la terapia de primera línea del dolor neuropático generado periféricamente.
- Para el tratamiento del dolor neuropático generado centralmente, las opciones de primera línea son los tricíclicos y los moduladores de los canales de Ca++.
- Aunque las pruebas del tratamiento intervencionista del dolor son limitadas, pueden apoyar el diagnóstico y el tratamiento terapéutico de los pacientes con dolor.
Literatura:
- Torrance N, et al: La epidemiología del dolor crónico de origen predominantemente neuropático. Resultados de una encuesta a la población general. La revista del dolor: revista oficial de la Sociedad Americana del Dolor 2006; 7(4): 281-289.
- Treede RD, et al: Dolor neuropático: redefinición y un sistema de clasificación para fines clínicos y de investigación. Neurología 2008; 70(18): 1630-1635.
- Harden RN: Propuesta de nuevos criterios diagnósticos para el síndrome de dolor reghilan complejo. Medicina del dolor 2007; 8(4): 326-331.
- Baron R: Dolor neuropático. Anesthesiologist 2000; 49: 373-386.
- Baron R, Freynhagen R: Compendio del dolor neuropático. 2ª edición, Editorial Aesopus, 2006.
- Cruccu G, et al: Directrices de la EFNS sobre la evaluación del dolor neuropático: revisadas en 2009. Eur J Neurol 2010; 17(8): 1010-1018.
- Renaud R, et al: Dolor neuropático crónico Recomendaciones del Grupo de Interés Especial (GIE) de la Sociedad Suiza para el Estudio del Dolor (SGSS). Foro Médico Suizo 2011; 11(Suppl. 57): 3-19.
- Gosrau G, et al: Métodos de medición electrofisiológica en la terapia del dolor. Dolor 2008; 22: 471-481.
- Böhm J, Schelle T: Importancia de la ecografía de alta resolución en el diagnóstico de las enfermedades de los nervios periféricos. Neurol Akt 2013; 40(05): 258-268.
- Klit H, et al: Dolor central post-ictus: características clínicas, fisiopatología y manejo. Lancet Neurol 2009; 8(9): 857-868.
- Bryce TN, et al: Clasificación internacional del dolor en lesiones medulares: parte I. Antecedentes y descripción. Médula espinal 2012; 50(6): 413-417.
- Truini A, et al: Mecanismos del dolor en la esclerosis múltiple: un estudio clínico y neurofisiológico combinado. Dolor 2012; 153(10): 2048-2054.
- Werner MU, Kongsgaard UE. Definición del dolor posquirúrgico persistente: ¿es necesaria una actualización? Br J Anaesth 2014; 113(1): 1-4.
- Simanski CJ, et al: Incidencia del dolor posquirúrgico crónico (CPSP) tras la cirugía general. Medicina del dolor (Malden, Mass) 2014; 15(7): 1222-1229.
- Haroutiunian S, et al: El componente neuropático en el dolor posquirúrgico persistente: una revisión bibliográfica sistemática. Dolor 2013; 154(1): 95-102.
- Dworkin RH, et al: Tratamiento intervencionista del dolor neuropático: recomendaciones del NeuPSIG. Dolor 2013; 154(11): 2249-2261.
- Dworkin RH, et al: Tratamiento farmacológico del dolor neuropático: recomendaciones basadas en la evidencia. Dolor 2007; 132(3): 237-251.
- O’Connor AB, Dworkin RH: Tratamiento del dolor neuropático: una visión general de las directrices recientes. Am J Med 2009; 122(10 Suppl): S22-32.
- Attal N, et al: Directrices de la EFNS sobre el tratamiento farmacológico del dolor neuropático: revisión de 2010. Eur J Neurol 2010; 17(9): 1113-1188.
- Cruccu G, et al: Directrices de la AAN-EFNS sobre el tratamiento de la neuralgia del trigémino. Eur J Neurol 2008; 15(10): 1013-1028.
- Sadosky A, et al: Una revisión de la epidemiología de la neuropatía diabética periférica dolorosa, la neuralgia postherpética y las afecciones de dolor neuropático menos comúnmente estudiadas. Práctica del dolor: la revista oficial del Instituto Mundial del Dolor 2008; 8(1): 45-56.
PRÁCTICA GP 2015; 10(1): 14-21











