El tratamiento médico de los tumores cerebrales malignos, especialmente los gliomas malignos, se orienta hacia la paliación debido a los cortos tiempos de supervivencia y a la morbilidad que los acompaña. El edema cerebral vasogénico se trata con corticosteroides; la dexametasona es la sustancia terapéutica estándar. La dexametasona suele prescribirse con demasiada frecuencia, durante demasiado tiempo y en dosis demasiado altas. La dosis eficaz más baja debe titularse en consulta con el paciente y sus familiares. La terapia anticonvulsiva profiláctica en ausencia de crisis epilépticas no está indicada. Los aspectos importantes de la fase terminal deben seguir discutiéndose con todas las partes implicadas en la fase de comunicación preservada y registrarse con un testamento vital.
Los tumores cerebrales del SNC se dividen en gliomas de bajo grado (grado I-II de la OMS) y de grado superior (grado III-IV de la OMS). Entre ellos se incluyen los astrocitomas, los oligodendrogliomas y sus formas mixtas, así como, con mucha menor frecuencia, los ependimomas y otras variantes [1].
Los gliomas malignos se caracterizan por el rápido crecimiento del tumor y la aparición de necrosis. Se producen cuando ya no puede garantizarse el suministro vascular al tumor. En respuesta a la deficiencia, tanto las células neoplásicas como las del huésped producen citocinas vasculares y factores de crecimiento (incluido el factor de crecimiento endotelial vascular, VEGF) para restaurar la homeostasis tisular [2]. Los vasos que abastecen a los tumores de crecimiento rápido son inmaduros y permeables. Como consecuencia, se producen hemorragias en el tumor y es frecuente el edema cerebral vasogénico peritumoral. Además de la destrucción de las células nerviosas y del tejido de soporte por la infiltración maligna, el edema cerebral es un factor importante en la morbilidad y mortalidad de los gliomas.
Característicamente, las células malignas obtienen su energía a través de la glucólisis anaeróbica [3]. El lactato producido acidifica el medio circundante para que los agentes quimioterapéuticos, los anticonvulsivos y otros fármacos puedan penetrar mal en las regiones tumorales. La formación adicional de neurotransmisores excitatorios como el glutamato interfiere en la función de las células nerviosas de la región peritumoral y provoca síntomas neurológicos y crisis epilépticas [4].
Iniciar los cuidados paliativos lo antes posible
En los últimos años se ha avanzado en la terapia inicial multimodal, consistente en la máxima resección posible, radioquimioterapia postoperatoria y terapia sistémica de mantenimiento y recidiva. Sin embargo, el tratamiento médico, especialmente en el caso de los gliomas malignos, se orienta hacia la paliación debido a los cortos tiempos de supervivencia y la morbilidad que los acompaña. Por lo tanto, los principios medicinales y no medicinales de los cuidados paliativos deben integrarse en el concepto terapéutico en una fase temprana [5]. El objetivo de los esfuerzos terapéuticos debe ser preservar al máximo la calidad de vida y la autonomía del paciente. Esto incluye la profilaxis y el tratamiento de la llamada toxicidad terapéutica y asociada al glioma.
A continuación, se presenta desde un punto de vista pragmático el tratamiento farmacológico del edema cerebral y las crisis epilépticas, así como la gestión de los trastornos de la coagulación en los tumores cerebrales.
Edema cerebral perifocal
El edema cerebral vasogénico no es específico como reacción del SNC a un proceso intracerebral en crecimiento y se produce tanto en procesos malignos (gliomas, metástasis cerebrales) como en inflamaciones (abscesos, enfermedades autoinmunes). Especialmente en los gliomas malignos, la ruptura de la barrera hematoencefálica se debe al rápido crecimiento de vasos tumorales inmaduros [2]. Este es el requisito anatómico previo para la filtración del medio de contraste aplicado por vía intravenosa al tumor cerebral. El crecimiento tumoral y el edema vasogénico aumentan inicialmente la presión intracraneal localizada, desplazando la materia cerebral circundante y provocando síntomas neurológicos focales. Si la presión intracraneal aumenta, se produce un desplazamiento de la línea media y/o un desplazamiento potencialmente mortal de los lóbulos temporales a través del tentorio hacia caudal (hernia transtemporal). (Fig.1). El aumento de la presión sólo puede compensarse reduciendo el volumen sanguíneo intravascular, inicialmente venoso, pero más tarde también arterial, y el líquido cefalorraquídeo hasta agotar las reservas fisiológicas. La congestión y las hemorragias venosas, la infraperfusión arterial y los trastornos de la circulación del líquido cefalorraquídeo agravan a su vez el proceso de la enfermedad.
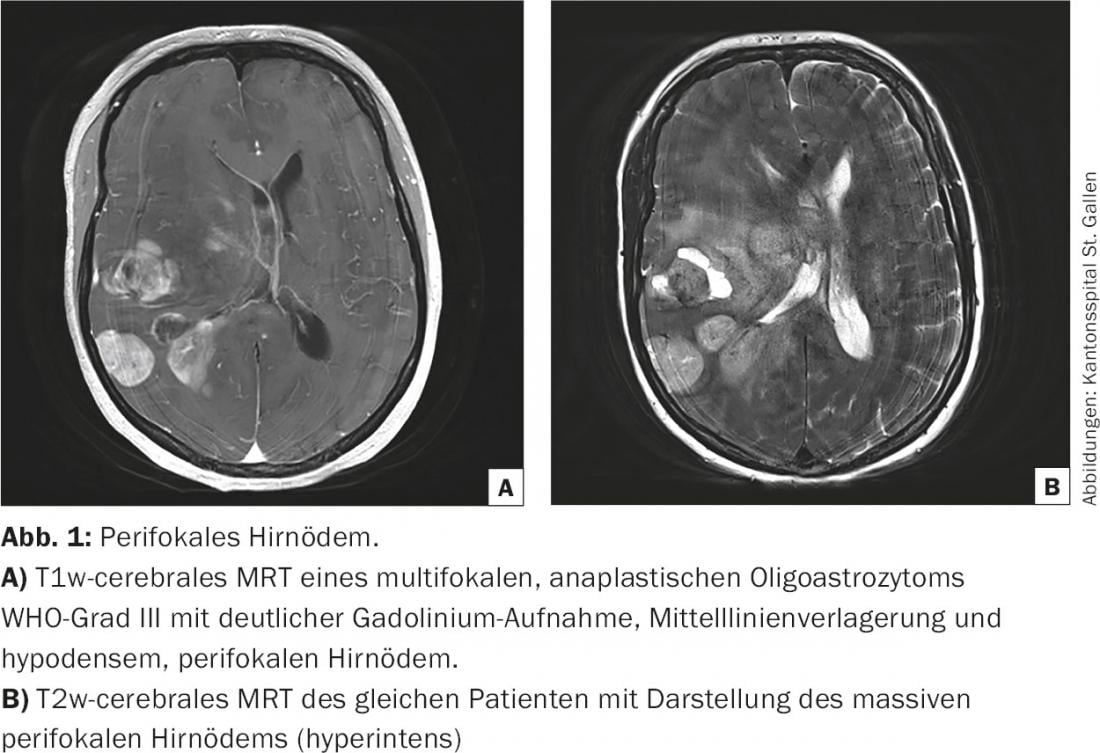
El edema cerebral peritumoral desempeña un papel importante tanto en el diagnóstico inicial como en la evolución de la enfermedad tumoral cerebral. A menudo, las alteraciones neurológicas iniciales sólo se desencadenan por el edema cerebral vasogénico y son rápidamente reversibles (en 24 horas) por la administración de corticosteroides [6]. Los esteroides se utilizan como agente terapéutico de diagnóstico para distinguir un trastorno funcional (relacionado con la presión) de un daño estructural (infiltración, destrucción). Esto ayuda en la evaluación riesgo-beneficio de una intervención neuroquirúrgica, especialmente en la situación de recidiva. En la fase terminal de la enfermedad tumoral cerebral, el aumento de la presión intracraneal conduce a un aumento de la opacidad y, finalmente, a la muerte del paciente. Este proceso de muerte es predominantemente pacífico [7].
Tratamiento del edema cerebral vasogénico
A diferencia del edema cerebral citotóxico, que suele estar causado por la hipoxia, el edema cerebral vasogénico se trata con corticosteroides. La dexametasona se utiliza ampliamente como sustancia terapéutica estándar en la práctica clínica diaria. Tiene una semivida biológica larga, puede administrarse por vía oral e intravenosa y proporciona un alivio rápido de los síntomas. El efecto se despliega a través de la modulación de la expresión del VEGF, los efectos antiinflamatorios y la inhibición de la cascada del ácido araquidónico [8]. Sin embargo, con una terapia a largo plazo, cabe esperar efectos secundarios considerables, por ejemplo, miopatía esteroidea proximal invalidante, hiperglucemia, hipalbuminemia, trastornos electrolíticos, inmunosupresión, trastornos psiquiátricos, osteoporosis y hemorragias cutáneas [8]. Por lo tanto, el manejo cuidadoso de este fármaco en el tratamiento de tumores cerebrales es crucial para no poner en peligro sustancialmente el estado de salud del paciente mediante intervenciones iatrogénicas(tab. 1).

Nuestra experiencia demuestra que la dexametasona se prescribe con demasiada frecuencia, durante demasiado tiempo y en dosis demasiado elevadas. Recomendamos que se titule la dosis eficaz más baja en consulta con el paciente y sus familiares, aun a riesgo de empeorar temporalmente las dolencias neurológicas (tab. 2 y 3) . Debido a su larga semivida biológica, no existe ningún argumento racional para administrar dexametasona varias veces al día. Una sola dosis por la mañana es suficiente. La administración matinal se tolera mejor (alteraciones del sueño, delirio nocturno), refleja la liberación fisiológica de corticosteroides endógenos y aumenta la adherencia al fármaco. Los esteroides lipofílicos tienen un potencial de interacción crítico con los quimioterápicos, los anticonvulsivantes y los anticoagulantes que rara vez se tiene en cuenta.

Crisis epilépticas
En el 20-40% de los pacientes con tumores cerebrales, los ataques epilépticos conducen al diagnóstico de una masa intracraneal. Un tercio de todos los pacientes con tumores cerebrales sufren epilepsia estructural, por lo que los gliomas de bajo grado y los tumores neurogénicos (por ejemplo, los gangliogliomas) son más epileptógenos que los gliomas malignos o las metástasis [9]. No obstante, la terapia anticonvulsiva profiláctica no está indicada [10].
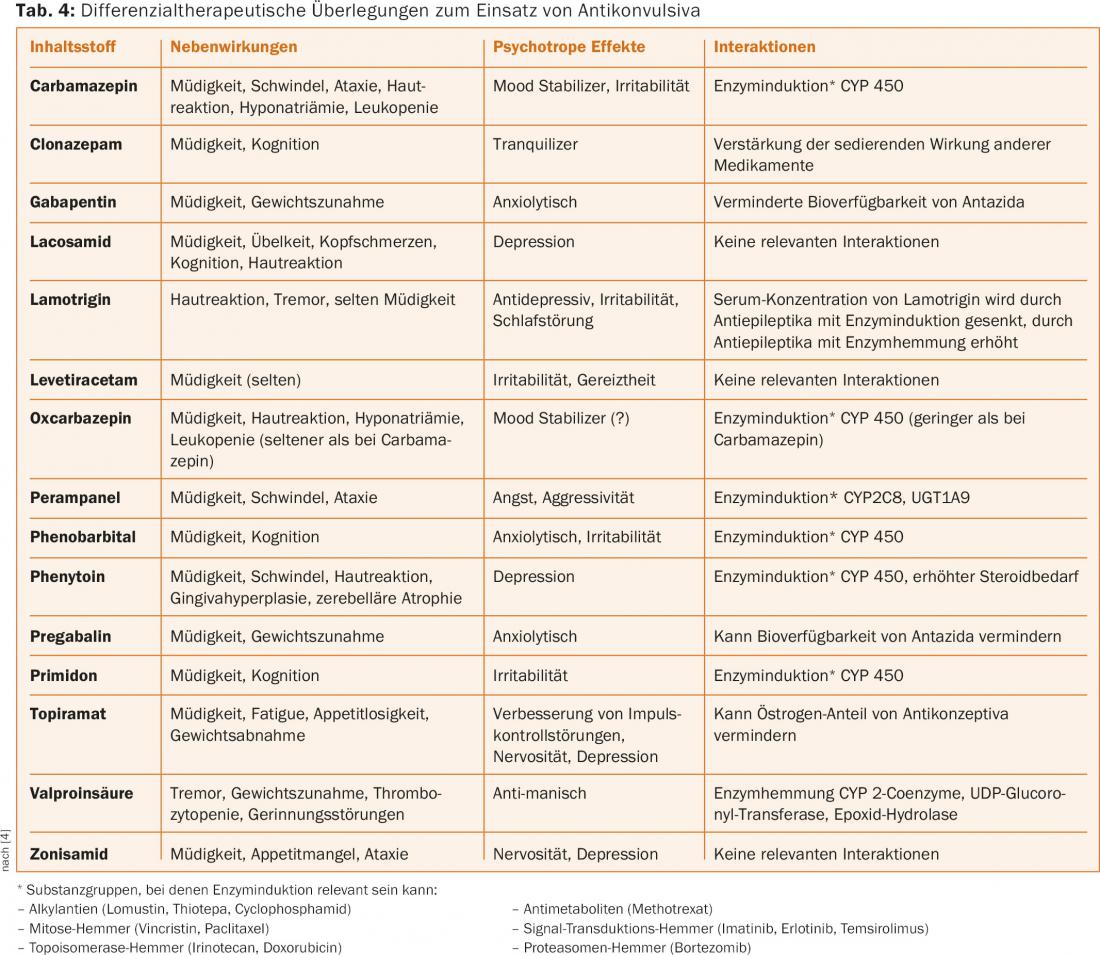
Las crisis epilépticas afectan a la calidad de vida debido a la mayor probabilidad de que se produzcan crisis de forma inesperada a pesar de una terapia anticonvulsiva adecuada. Esto tiene consecuencias para la autonomía del paciente (miedo a las convulsiones), restringe la movilidad (prohibición de conducir) y puede provocar lesiones por caídas. Educar a los afectados es importante en esta situación para contrarrestar el miedo, normalmente exagerado, a los ataques epilépticos. La ingesta regular de anticonvulsivos en dosis terapéuticas, la selección del preparado óptimo para la terapia diferencial y la observancia de las contraindicaciones e interacciones (www.cancerdrugs.ch) son determinantes importantes de la terapia [10]. En la tabla 4 encontrará un tratamiento diferencial para el uso de anticonvulsivos. Evitar los factores que provocan las convulsiones, como la falta de sueño o el consumo excesivo de alcohol, así como una buena adherencia a la medicación, forman parte de esto por parte del paciente. Deben evitarse los fármacos que reducen el umbral convulsivo (por ejemplo, el bupropión, la clozapina y los antibióticos betalactámicos) y la hiperglucemia excesiva.
La educación sobre las convulsiones, en su mayoría autolimitadas, y la prescripción de anticonvulsivos de emergencia de acción rápida (Rivotril, Lorazepam, Dormicum) contribuyen a la autonomía del paciente y a la reducción de la ansiedad. Igualmente importantes son las instrucciones sobre qué hacer en caso de ataque epiléptico (plan de tratamiento, lista de teléfonos) y qué actividades deben evitarse (subirse a los árboles, subir escaleras, bañarse solo, cambiar a los bebés en un cambiador en lugar de en el suelo). No todos los ataques epilépticos requieren una visita al servicio de urgencias, donde el paciente tiene que esperar mucho tiempo y se solicitan pruebas de imagen innecesarias. A menudo, una consulta telefónica con el médico de cabecera o con un médico del servicio neurológico es suficiente para gestionar la situación aguda. Sin embargo, las crisis inusuales, la larga duración de las crisis, la inconsciencia prolongada o la agitación postictal deben ser motivo de consulta médica para no pasar por alto una hemorragia tumoral, la progresión del tumor o trastornos metabólicos (hipoglucemia, desequilibrios electrolíticos).
Trastornos de la coagulación
El riesgo de tromboembolismo venoso postoperatorio en pacientes con tumores cerebrales durante el primer año es del 30% acumulativo [11]. Los factores de riesgo son los tumores cerebrales malignos, la edad avanzada, la hemiparesia, un gran volumen tumoral y la resección parcial del tumor. Como efecto paraneoplásico a distancia, los gliomas malignos segregan sustancias vasoactivas (VEGF, factor tisular) que desencadenan trastornos de la coagulación como trombosis y embolia pulmonar [12]. En la evaluación del riesgo, la profilaxis y el tratamiento de los episodios tromboembólicos no tienen restricciones debido al bajo riesgo de hemorragia intracerebral (aprox. 2%) [13]. Desde el punto de vista terapéutico, se utilizan medias de compresión y heparinas de bajo peso molecular en la fase postoperatoria inmediata. Si se detecta tromboembolismo venoso, la anticoagulación parenteral u oral también está indicada en pacientes con tumores cerebrales [11]. Esto también se aplica a los pacientes en tratamiento antiangiogénico con bevacizumab [14].
Problemas especiales al final de la vida
Los pacientes con tumores cerebrales se diferencian de otros pacientes tumorales en la fase final de la vida por la aparición de síntomas neurológicos específicos [15]. Entre ellos se incluyen problemas para tragar, alteraciones de la consciencia, déficits neurológicos progresivos, incontinencia y dolores de cabeza.
En particular, el deterioro de la comunicación y los trastornos neurocognitivos interfieren en la autonomía al final de la vida y llevan al límite los conceptos generales de los cuidados paliativos, que a menudo se basan en la expresión activa de la voluntad. Por lo tanto, los aspectos importantes de la fase terminal deben seguir discutiéndose con todas las partes implicadas en la fase de comunicación recibida y registrarse con un documento de voluntades anticipadas. Estos aspectos incluyen decisiones médicas como la alimentación artificial frente al ayuno para la muerte, las medidas de reanimación, la terapia del dolor y la sedación, así como las necesidades espirituales, el lugar del fallecimiento, los preparativos del funeral y la organización de los cuidados paliativos [5,16,17].
En caso de pérdida de conciencia, hay que considerar críticamente el sentido de continuar la terapia farmacológica mediante la aplicación de fluidos, corticosteroides, anticonvulsivos y profilaxis de la trombosis bajo el aspecto de prolongar el sufrimiento [7].
Literatura:
- Louis DN, et al: Clasificación de los tumores del sistema nervioso central de la OMS 2007. Acta Neuropathol 2007; 114: 97-109.
- Wick W, et al: Estado actual y direcciones futuras de la terapia antiangiogénica para los gliomas. Neuro Oncol 2016; 18: 315-328.
- Woolf EC, Scheck AC: La dieta cetogénica para el tratamiento del glioma maligno. J Lipid Res 2015; 56: 5-10.
- Hundsberger T, et al: Complicaciones neurológicas en pacientes con cáncer. Praxis 2014; 103: 1009-1016.
- Pace A, et al: Cuidados de apoyo en neurooncología. Curr Opin Oncol 2010; 22: 621-626.
- Wolfson AH, et al: El papel de los esteroides en el tratamiento del carcinoma metastásico cerebral. Un ensayo prospectivo piloto. Am J Clin Oncol 1994; 17: 234-238.
- Bausewein C, et al.: ¿Cómo mueren los pacientes con tumores cerebrales primarios? Palliat Med 2003; 17: 558-559.
- Roth P, et al: Edema asociado al tumor en pacientes con cáncer cerebral: patogenia y tratamiento. Expert Rev Anticancer Ther 2013; 13: 1319-1325.
- van Breemen MS, et al: Epilepsia en pacientes con tumores cerebrales: epidemiología, mecanismos y tratamiento. Lancet Neurol 2007; 6: 421-430.
- Rossetti AO, Stupp R: Correlación del uso de anticonvulsivos inductores de enzimas con el resultado de los pacientes con glioblastoma. Neurología 2010; 74: 1329-1330.
- Perry JR, et al: Ensayo de fase II de temozolomida de dosis intensa continua en glioma maligno recurrente: estudio RESCUE. J Clin Oncol 2010; 28: 2051-2057.
- Jenkins EO, et al: Tromboembolismo venoso en gliomas malignos. J de Trombosis y Hemostasia 2010; 8: 221-227.
- Pan E, et al: Estudio retrospectivo de eventos tromboembólicos venosos y hemorrágicos intracerebrales en pacientes con glioblastoma. Investigación contra el cáncer 2009; 29: 4309-4313.
- Nghiemphu PL, et al: Bevacizumab y quimioterapia para el glioblastoma recurrente: experiencia de una sola institución. Neurología 2009; 72: 1217-1222.
- Sizoo EM, et al: Síntomas y problemas en la fase final de la vida de los pacientes con glioma de alto grado. Neuro Oncol 2010; 12: 1162-1166.
- Koekkoek JA, et al: Síntomas y gestión de la medicación en la fase final de la vida de pacientes con glioma de alto grado. J Neurooncol 2014; 120: 589-595.
- Pace A, et al: Cuestiones relacionadas con el final de la vida en pacientes con tumores cerebrales. J Neurooncol 2009; 91: 39-43.
- Kaal EC, Vecht CJ: El tratamiento del edema cerebral en los tumores cerebrales. Curr Opin Oncol 2004; 16(6): 593-600.
InFo NEUROLOGÍA Y PSIQUIATRÍA 2016; 14(4): 22-28