Los carcinomas tiroideos pueden diagnosticarse bien hoy en día gracias a las modernas técnicas de diagnóstico por imagen y suelen tener un buen pronóstico. Sin embargo, la estratificación del riesgo postoperatorio debería realizarse en un centro con una junta especializada en tiroides.
Con las modernas técnicas de diagnóstico por imagen, los nódulos tiroideos se diagnostican cada vez con más frecuencia. La mayoría de estos bultos son benignos. Por lo tanto, es indispensable realizar un estudio y un análisis precisos para evitar intervenciones quirúrgicas innecesarias. En el caso de nódulos tiroideos sospechosos, la biopsia con aguja fina y el estudio citológico son el patrón oro para el diagnóstico. Si se confirma citológica o histológicamente un carcinoma de la glándula tiroides, se recomienda discutir los hallazgos en una junta interdisciplinar de tiroides, ya que las opciones de tratamiento se vuelven más complejas. La terapia y los cuidados postoperatorios óptimos para el paciente pueden determinarse entonces por consenso. Este artículo ofrece una visión general del diagnóstico y el tratamiento del carcinoma tiroideo. Aquí la atención se centra en la terapia. Las directrices internacionales actuales sirven de base.
Epidemiología
El carcinoma de tiroides es un tumor poco frecuente con un bajo potencial maligno. Es el tumor endocrino más frecuente. En Suiza se registran unos 770 nuevos casos al año, lo que corresponde al 1,9% de todos los carcinomas. Las mujeres se ven afectadas con más frecuencia que los hombres en una proporción de 2,5:1 [3].
La mortalidad del carcinoma de tiroides es de aproximadamente el 0,4% de todos los tumores malignos. Los carcinomas papilar y folicular de tiroides tienen unas tasas de supervivencia global a 5 años de casi el 100% y el 97%, respectivamente, con una terapia óptima. Sin embargo, algunos subtipos histológicos muestran un pronóstico significativamente peor, con una mortalidad del 10-40% a los 10 años. En el caso de los carcinomas medulares de tiroides, la tasa de supervivencia global a 5 años es del 90%. En caso de metástasis, el pronóstico es peor. A diferencia de los carcinomas diferenciados de tiroides, el pronóstico del carcinoma anaplásico o indiferenciado de tiroides es extremadamente malo, con una tasa de supervivencia global a 5 años del 7% [1].
El carcinoma papilar de tiroides es el carcinoma más común de la glándula tiroides con una incidencia del 60-80%, seguido del carcinoma folicular, medular y anaplásico/indiferenciado de tiroides. Este último es una rareza, ya que representa menos del 2% de todos los carcinomas tiroideos.
La incidencia del carcinoma papilar de tiroides está aumentando en los carcinomas papilares pequeños <2 cm, pero en los de mayor tamaño la incidencia y la mortalidad son constantes. Esto puede explicarse por un diagnóstico más frecuente de nódulos tiroideos clínicamente no manifiestos. La prevalencia de nódulos tiroideos clínicamente no manifiestos aumenta con la edad en la población. En los estudios de cribado, la prevalencia de nódulos tiroideos supera el 50% en pacientes mayores de 60 años [6].
Diagnóstico
Examen clínico: Si se sospecha la presencia de un nódulo tiroideo, se recomienda realizar un breve examen clínico de los tejidos blandos del cuello. Los nódulos tiroideos mayores de 1,5 cm suelen palparse bien. El diagnóstico clínico también incluye el estado de los ganglios linfáticos. Los ganglios linfáticos ipsilaterales localizados en las regiones inferiores del cuello son sospechosos. La ronquera de nueva aparición también puede ser un signo de malignidad.
Diagnóstico químico de laboratorio: En el esclarecimiento de los nódulos tiroideos con respecto a la malignidad, el estado de la hormona tiroidea desempeña un papel subordinado, ya que sus valores no dicen nada sobre la benignidad o malignidad de un nódulo. La tiroglobulina es un excelente parámetro de progresión tumoral en el postoperatorio del carcinoma de tiroides. Sin embargo, la tiroglobulina inespecífica es inadecuada para el diagnóstico. La situación es bastante diferente con la calcitonina sérica como parámetro tumoral para el carcinoma medular de tiroides. Por ello, en algunos centros se determina de forma rutinaria la calcitonina sérica en el diagnóstico de los nódulos tiroideos.

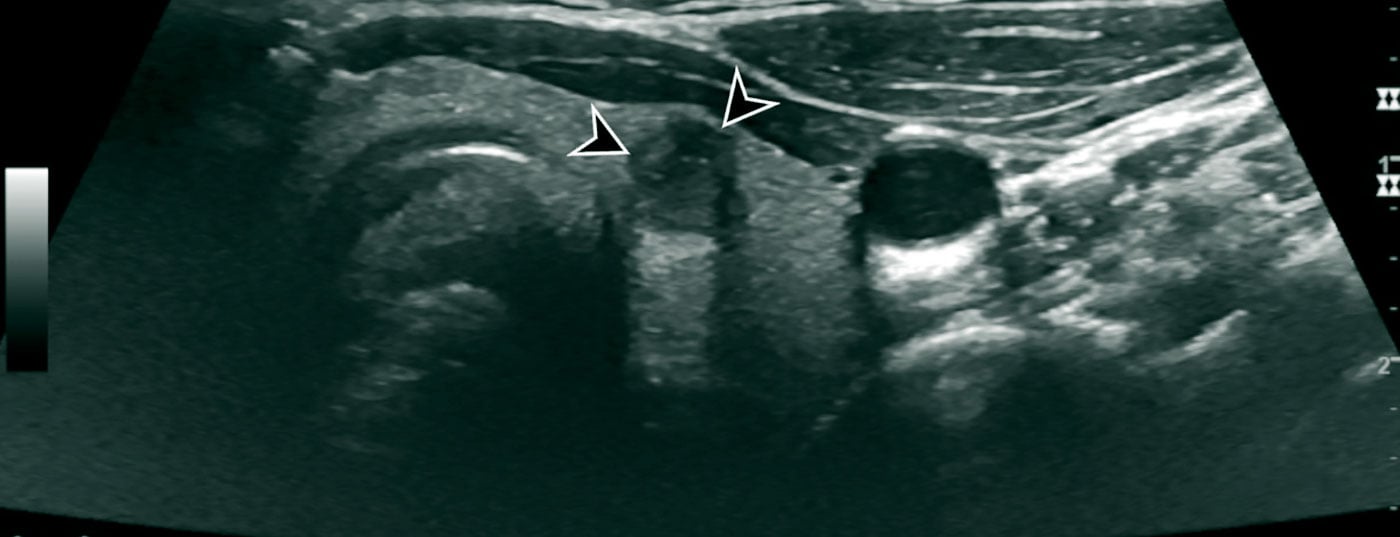
Procedimientos de diagnóstico por imagen: El principal método de examen en el esclarecimiento de una masa en el cuello es la ecografía. Esto permite una evaluación de alta resolución de los nódulos tiroideos y un diagnóstico de localización muy preciso. Es aconsejable utilizar un sistema de clasificación para evaluar los nódulos tiroideos examinados ecográficamente. El objetivo de un sistema de clasificación de este tipo es una clasificación cuantitativa de los nódulos tiroideos con las consiguientes recomendaciones, una nomenclatura normalizada y un informe estandarizado. En nuestras latitudes se suele utilizar el TI-RADS (Thyroid Imaging-Reporting and Database System) estadounidense [7] o europeo [5] (Fig. 2, Tab. 1 [5]).
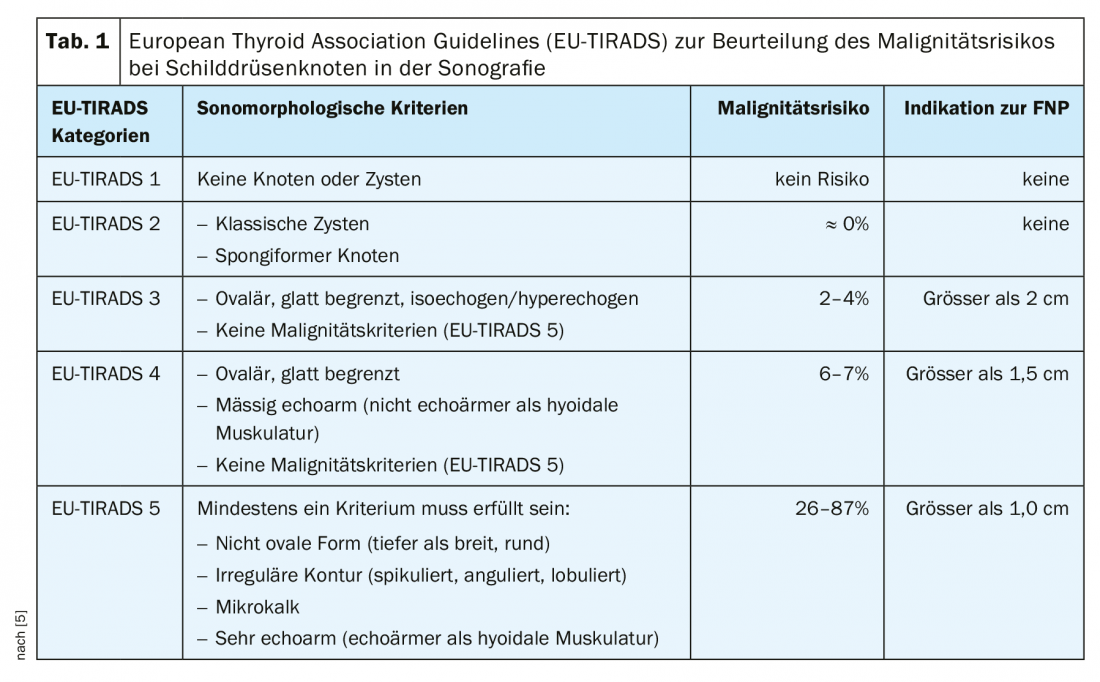
Además de la glándula tiroides, siempre deben evaluarse ecográficamente los ganglios linfáticos cervicales y los demás tejidos blandos del cuello. Hasta cierto punto, los tejidos blandos del cuello también pueden evaluarse en busca de infiltración en los carcinomas tiroideos infiltrantes.
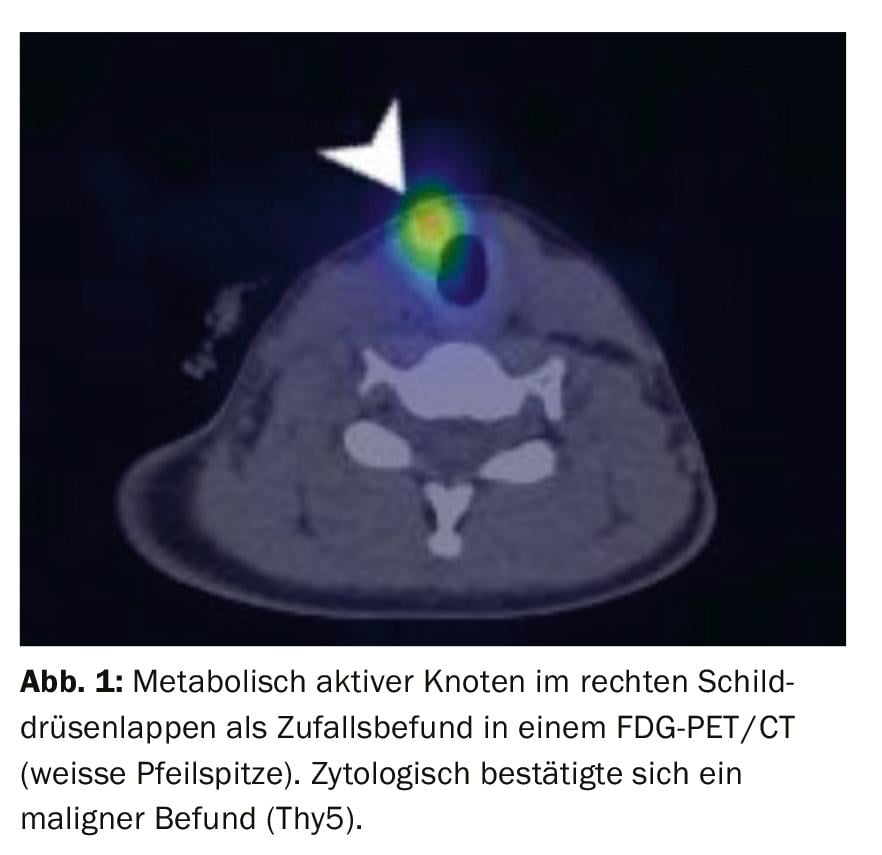
La TC y la RM tienen un valor limitado en el diagnóstico primario de los nódulos tiroideos. Cuando la ecografía alcanza su límite físico, la evaluación de la localización anatómica de las grandes glándulas tiroideas que se extienden mediastínicamente y retrotraquealmente puede valorarse mejor que con la ecografía. Los nódulos tiroideos ávidos de FDG detectados aleatoriamente en la PET-TC deben puncionarse. El potencial maligno de estos nódulos es de aproximadamente el 14-56% [6] (Fig. 1).
Aspiración con aguja fina (PAAF) y diagnóstico citológico: La aspiración con aguja fina es de gran importancia para el diagnóstico y la determinación del procedimiento posterior. Las células procesadas se evalúan según una clasificación estadounidense de 6 niveles (clasificación Bethesda) o una clasificación británica de 5 niveles (clasificación Thy). A partir de un resultado Thy3, ya no puede descartarse un carcinoma. El riesgo de carcinoma en este caso es del 15-40%, con un Thy4 del 60-70% y con un Thy5 del 97-100%.
Diversas mutaciones y translocaciones se utilizan hoy en día en el diagnóstico de los carcinomas tiroideos y serán cada vez más importantes en el futuro. Las mutaciones más importantes en la actualidad son RAS, B-RAF y hTERT. En función del tamaño de la lesión focal y del diagnóstico citológico, se realiza una estratificación del riesgo con respecto a la terapia y los cuidados de seguimiento.
Terapia del carcinoma tiroideo
Cirugía: La terapia primaria para el carcinoma de tiroides es la cirugía. Si el tumor se extirpa por completo tras el estudio histológico, se considera que el paciente está curado. Este es el caso si el tumor mide menos de 2,0 cm en la muestra patológica tras una hemi- o tiroidectomía total, se ha extirpado completamente y muestra una diferenciación clásica.
En todos los demás casos, está indicada la tiroidectomía total bajo vigilancia recurrente, complementada con una disección ipsilateral del cuello, generalmente de los niveles III-IV y VI, según el estado de los ganglios linfáticos. Los riesgos intra y postoperatorios son bajos en cirujanos experimentados; se considera que el principal riesgo es el hipoparatiroidismo no reversible y la lesión del nervio laríngeo. En función de la histología, el estado TNM y, cada vez más, los análisis genéticos, se determina el tratamiento postoperatorio y el régimen de seguimiento adecuados.
Ablación con yodo radiactivo: Tanto la ATA [2] (Asociación Americana de Tiroides) como la ETA [4] (Asociación Europea de Tiroides) han elaborado directrices para la indicación de la terapia postoperatoria con yodo radiactivo. En función de la histología, el tamaño del tumor primario, la multifocalidad, el número/tamaño de los ganglios linfáticos y la genética, los pacientes se clasifican como de “bajo riesgo”, “riesgo intermedio” o “alto riesgo” para la ATA y de “muy bajo”, “bajo” y “alto riesgo” para la ETA. Existe acuerdo en pacientes de “muy bajo” y “bajo riesgo”, en los que el riesgo global de recurrencia en un plazo de 10 años es inferior al 3%, con o sin ablación con radioyodo. También hay acuerdo sobre los pacientes de “alto riesgo” para los que la terapia con yodo radiactivo reduce significativamente el riesgo de recidiva en el curso de 10 años. El gran desacuerdo es con los pacientes de “riesgo intermedio”. La ATA sugiere la ablación con radioyodo sólo en pacientes seleccionados, mientras que las directrices europeas no incluyen a los pacientes de “riesgo intermedio” y recomiendan un procedimiento más agresivo en general. Con ayuda de esta estratificación del riesgo, se realiza la indicación de una posible ablación suplementaria con yodo radiactivo, se determinan los intervalos de examen en el seguimiento y se fija el objetivo post-terapéutico de TSH.
El objetivo de la terapia complementaria con yodo radiactivo es encontrar y eliminar las células tiroideas o tumorales que han quedado tras la cirugía, por lo que se simplifica el seguimiento mediante ecografía del cuello y mediciones de tiroglobulina. El isótopo natural 131yodoutilizado para la terapia se administra por vía peroral en forma de cápsula y se acumula en 24 horas casi exclusivamente en las células tiroideas y en las células de carcinoma tiroideo bien diferenciado y se metaboliza en estas células. El requisito previo para ello es la estimulación de las células mediante un aumento de la TSH, ya sea de forma endógena mediante la abstinencia de hormona tiroidea o de forma exógena mediante rhTSH (Thyrogen). El método que se elija dependerá de la estratificación inicial del riesgo. Las células que absorben 131yodoson destruidas y descompuestas por el organismo. De este modo, pueden tratarse con éxito los hallazgos residuales en la logia tiroidea, los ganglios linfáticos, así como las metástasis a distancia. Se considera que el paciente está libre de tumor si no hay hallazgos yodávicos seis meses después de la cirugía o de la ablación con radioyodo y el marcador tumoral no es medible bajo estimulación (normalmente mediante rhTSH).
Todos los pacientes reciben hormonas tiroideas (levotiroxina) en el postoperatorio. En pacientes de “muy bajo” (sólo ETA), “bajo”, “riesgo intermedio” (sólo ATA), se apunta a una TSH de 0,5-2,0 mU/l, en pacientes de “alto riesgo” entre 0,1-0,5 mU/l.
Tratamiento de hallazgos residuales (enfermedad persistente), metástasis y recidivas: Si aparecen metástasis a distancia yodávidas en el centellograma de cuerpo entero bajo ablación con yodo radiactivo (con mayor frecuencia metástasis pulmonares u óseas), se suele llevar a cabo una segunda terapia con yodo radiactivo 4-6 meses después de la ablación con yodo radiactivo, una vez excluidas las metástasis no yodávidas mediante FDG-PET/CT o FDG-PET/MRI. El efecto de la terapia puede medirse en la posterior gammagrafía de cuerpo entero y en la sangre mediante la determinación de tiroglobulina. Con una buena respuesta, las metástasis yodávicas retroceden por completo y la tiroglobulina disminuye hasta que deja de ser medible al cabo de 3-6 meses (Fig. 3-5).
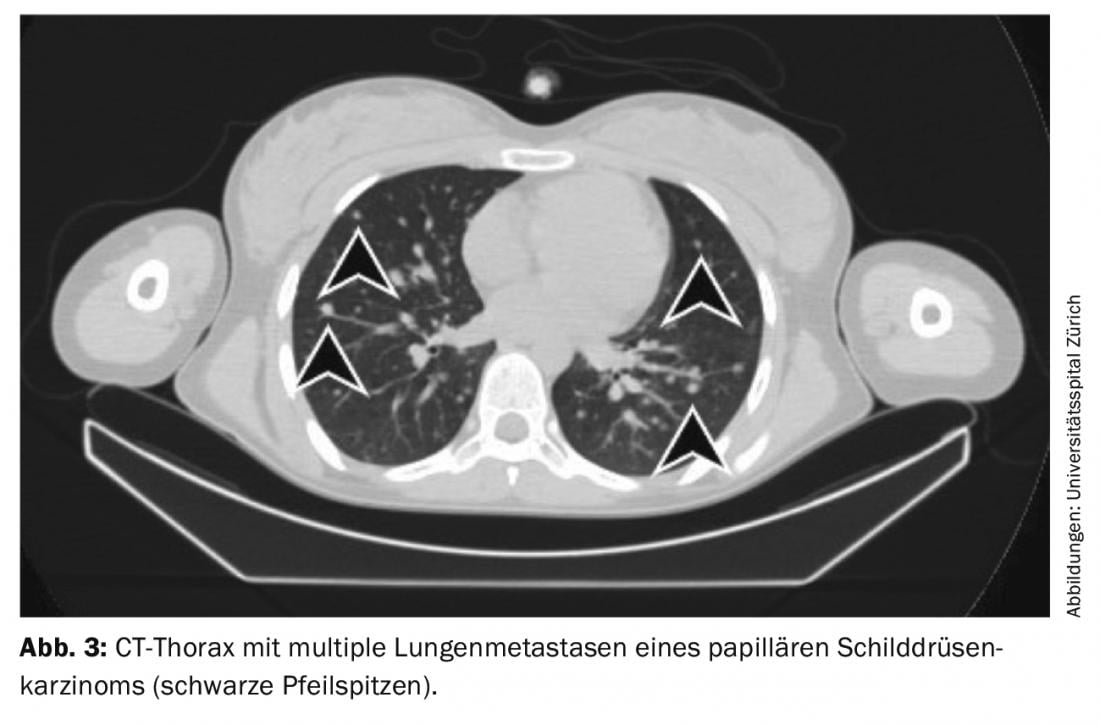
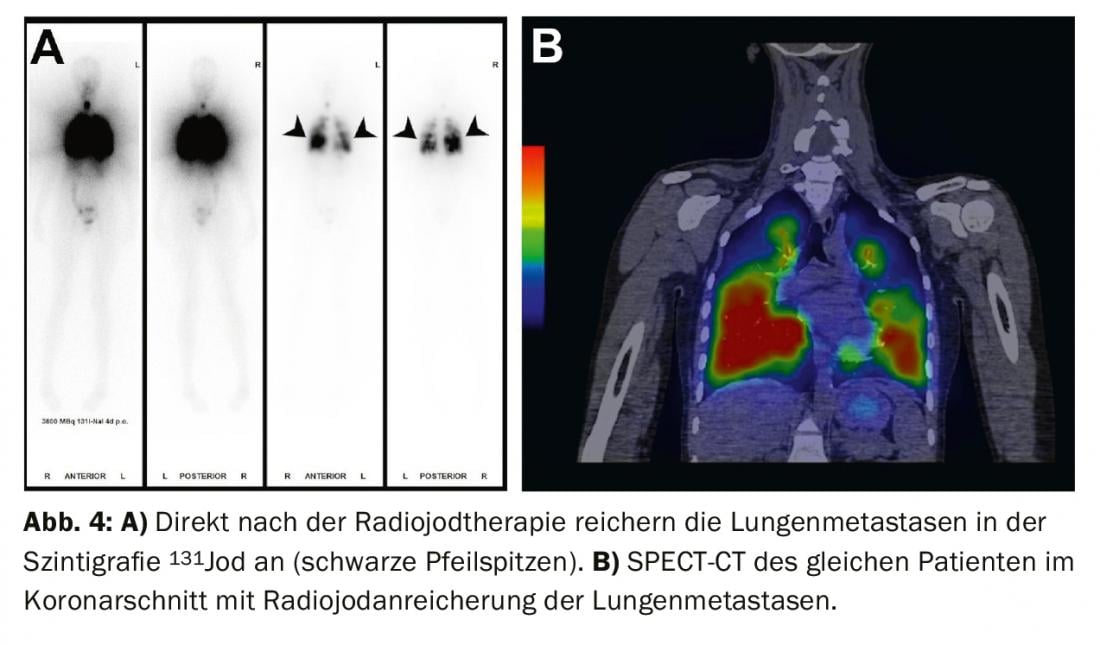
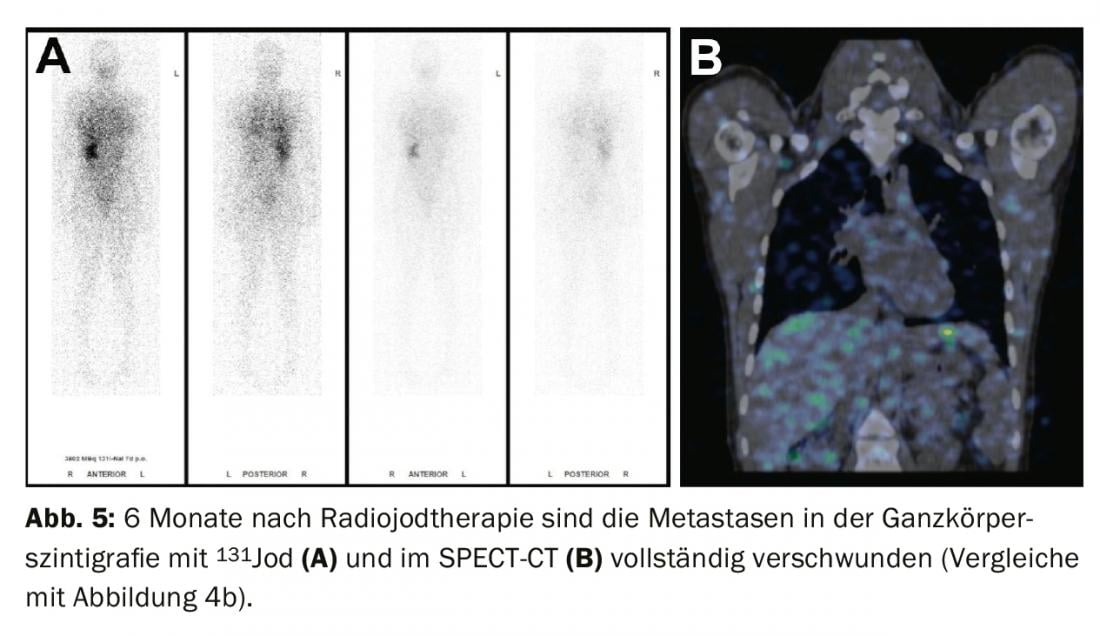
Si la tiroglobulina aumenta en el curso del seguimiento del tumor o aparecen ganglios linfáticos sospechosos en la ecografía del cuello, el diagnóstico debe confirmarse primero citológicamente. Se recomienda entonces la terapia con yodo radiactivo con el objetivo de tratar las metástasis y completar o ajustar la estadificación.
Puede repetirse la terapia con yodo radiactivo mientras las metástasis almacenen yodo y pueda documentarse un descenso de la tiroglobulina. Sin embargo, con cada terapia con yodo radiactivo aumenta el riesgo de que se formen células tumorales refractarias al yodo radiactivo. Además, a partir de unos 22 GBq de dosis focal acumulada (correspondiente a unas 4-5 terapias), aumenta el riesgo de desarrollar un segundo tumor. Las leucemias son las más frecuentes. El periodo de latencia es de unos 10 años. La terapia con yodo radiactivo está contraindicada si las metástasis se desdiferencian, es decir, si ya no almacenan yodo o si la tiroglobulina ya no desciende.
Carcinomas tiroideos radio refractarios: Los carcinomas tiroideos radio refractarios al yodo son raros. La incidencia se estima en unos 4 a 5 casos por cada millón de habitantes. Afecta principalmente a pacientes de edad avanzada con metástasis extensas, carcinomas poco diferenciados y manifestaciones tumorales altamente ávidas de FDG. La tasa de supervivencia a 10 años de los carcinomas tiroideos refractarios al radioyodo es sólo del 10% [6].
Opciones terapéuticas y tratamiento de los carcinomas refractarios al yodo: En los carcinomas tiroideos refractarios al radioyodo, la supresión de la TSH sérica es de gran importancia. En estas situaciones se recomienda la sustitución con levotiroxina con un objetivo de TSH de <0,1 mU/l. Las opciones terapéuticas son la terapia sistémica con inhibidores de la tirosina quinasa o la radioterapia percutánea.
Radioterapia: La radioterapia percutánea puede utilizarse para metástasis óseas singulares, localmente cervicales si hay metástasis diseminadas sin un correlato morfológico en las imágenes, o si el paciente ya no es operable.
Quimioterapia clásica: La quimioterapia clásica está menos establecida en el tratamiento del carcinoma tiroideo. Por ejemplo, los tratamientos con doxorrubicina muestran una respuesta del 0 al 20% con una toxicidad elevada. Las terapias combinadas con doxorrubicina y cisplatino tampoco son prometedoras.
Terapia de diana molecular: inhibidores de la tirosina cinasa [6]: La terapia sistémica con inhibidores de la tirosina quinasa está más establecida en los carcinomas tiroideos refractarios al yodo. La indicación de una terapia sistémica depende de varios factores. La tasa de progresión de un tumor puede evaluarse con el tiempo de duplicación de la tiroglobulina. No obstante, siempre debe recurrirse a la imagen para confirmar la progresión anatómica del tumor mediante RECIST (Criterios de Evaluación de la Respuesta en Tumores Sólidos). La progresión se define como un aumento del tamaño de las lesiones diana en más de un 20% o en más de 5 mm, una progresión significativa del tamaño de las lesiones no diana o la aparición de nuevas lesiones.
En pacientes con metástasis múltiples >1-2 cm y progresión RECIST en un plazo de 12 meses, se recomienda la terapia sistémica. En cambio, para las metástasis escasas y pequeñas <1 cm sin progresión RECIST en un plazo de 12 meses, no se recomienda ninguna terapia sistémica. En su lugar, puede adoptarse un enfoque de “esperar y ver” con controles regulares de imagen y laboratorio (“vigilancia activa”).
Los inhibidores de la tirosina quinasa son principalmente inhibidores antiangiogénicos y conducen a la inhibición del crecimiento de las células tumorales. La supervivencia libre de progresión frente al placebo es de 18,3 frente a 3,6 meses para el lenvatinib, 10,8 frente a 5,8 meses para el sorafenib y 11,1 frente a 5,9 meses para el vandetanib [6].
La respuesta tumoral se observa principalmente en las metástasis de los ganglios linfáticos, el hígado y los pulmones. Las metástasis óseas muestran una peor respuesta tumoral. Las metástasis óseas suelen progresar durante la terapia con inhibidores de la tirosina cinasa, a pesar de la respuesta de las metástasis en otros órganos o ganglios linfáticos. En estos casos, puede discutirse la administración adicional de bifosfonatos o denosumab. En dos tercios de los casos, las complicaciones de las metástasis óseas se desarrollan en el plazo de un año.
Se desconoce la duración óptima de la terapia. A menudo, la terapia se mantiene hasta que los efectos secundarios (diarrea, fatiga, toxicidad cutánea, hipertensión, aumento de la necesidad de tiroxina, toxicidad hepática, hemorragias, trombosis, formación de fístulas gastrointestinales, insuficiencia cardiaca) se hacen prevalentes o se observa una progresión tumoral. No está claro si el tratamiento debe continuarse en caso de progresión tumoral leve únicamente o en caso de respuesta tumoral y progresión simultáneas. Los pacientes con interrupciones más largas entre ciclos de terapia muestran un mayor riesgo de progresión tumoral acelerada.
Mensajes para llevarse a casa
- Los pacientes con carcinomas tiroideos bien diferenciados suelen tener muy buen pronóstico.
- Una buena evaluación preoperatoria sirve para optimizar la planificación quirúrgica.
- La estratificación del riesgo postoperatorio debe realizarse en un centro con una junta especializada en tiroides.
- La terapia postoperatoria y el seguimiento deben realizarse en un centro tiroideo para pacientes con una situación de “riesgo intermedio” o superior.
Literatura:
- ACS. Sociedad Americana del Cáncer [Internet]. 2019 [cited 2019 Sep 23];Disponible en: www.cancer.org/cancer/thyroid-cancer/about/key-statistics.html
- Haugen BR, Alexander EK, Bible KC, et al: 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Tiroides. 2016; doi:10.1089/thy.2015.0020
- NICER. Instituto Nacional de Epidemiología y Registro del Cáncer [Internet]. 2019 [cited 2019 Sep 23]; Disponible en: www.nicer.org
- Pacini F, Schlumberger M, Dralle H, et al: Consenso europeo para el tratamiento de pacientes con carcinoma diferenciado de tiroides del epitelio folicular. Eur. J. Endocrinol. 2006; doi:10.1530/eje.1.02158
- Russ G, Bonnema SJ, Erdogan MF, et al: European Thyroid Association Guidelines for Ultrasound Malignancy Risk Stratification of Thyroid Nodules in Adults: The EU-TIRADS. Eur. Thyroid J. 2017; doi:10.1159/000478927
- Schlumberger M, Pacini F, Tuttel RM: Tumores tiroideos. 4ª ed. tcgraphite; 2015.
- Tessler FN, Middleton WD, Grant EG, et al: ACR Thyroid Imaging, Reporting and Data System (TI-RADS): White Paper of the ACR TI-RADS Committee. J. Am. Coll. Radiol. 2017; doi:10.1016/j.jacr.2017.01.046
InFo ONCOLoGÍA Y HEMATOLOGÍA 2019; 7(5): 6-10.