Las terapias sistémicas dirigidas son cada vez más importantes tanto en el carcinoma anaplásico como en el carcinoma diferenciado de tiroides avanzado refractario al radioyodo. En los últimos años, han demostrado ser opciones eficaces en presencia de alteraciones RET, TRK y BRAF. Sólo recientemente se han aprobado en Suiza los inhibidores de TRK larotrectinib y entrectinib, así como los inhibidores de RET selpercatinib y pralsetinib.
A última hora, con la aprobación de inhibidores específicos de RET (reordenamiento durante la transfección) y TRK (quinasa receptora de tropomiosina), la terapia personalizada del cáncer también ha llegado al tratamiento del carcinoma tiroideo. Por ejemplo, los tumores avanzados refractarios al radioyodo se tratan cada vez con más éxito con sustancias dirigidas. Por un lado, han demostrado ser una opción terapéutica eficaz en presencia de alteraciones RET, TRK y BRAF. Por otro lado, pueden servir para inducir una rediferenciación del tumor y, por tanto, una renovada vulnerabilidad al yodo radiactivo. Además de las sustancias dirigidas, también se utilizan cada vez más las inmunoterapias, especialmente para el carcinoma anaplásico de tiroides. Con estos nuevos avances, la importancia de los análisis genéticos moleculares en el carcinoma de tiroides ha aumentado significativamente en los dos últimos años. La investigación actual se centra no sólo en el desarrollo ulterior del tratamiento de primera línea, sino también en la evaluación de las opciones terapéuticas para las líneas de tratamiento posteriores, que han sido poco estudiadas hasta la fecha.
Carcinoma diferenciado de tiroides refractario al radioyodo: ¿quién es quién?
Los tumores diferenciados, especialmente papilares, representan alrededor del 85% de los 890 nuevos carcinomas de tiroides diagnosticados cada año en Suiza [1]. En el 15% de los casos, la enfermedad resulta ser recurrente o metastásica [2]. A menudo, el tumor deja entonces de responder a la terapia sistémica con yodo radiactivo y se convierte así en refractario al yodo radiactivo. Esto conlleva un marcado deterioro del pronóstico, con una tasa de supervivencia a 10 años de aproximadamente el 10%, en comparación con más del 50% para la sensibilidad al radioyodo [3]. Gracias a los nuevos enfoques terapéuticos para los tumores avanzados refractarios al yodo radiactivo, ahora también podrían mejorar las perspectivas para los afectados cuya enfermedad ya no puede tratarse con yodo radiactivo. Hasta hace poco, las únicas opciones farmacológicas en estos casos eran los inhibidores multicinasa sorafenib y lenvatinib. Se utilizan en pacientes sintomáticos o en tumores que son progresivos según RECIST (Criterios de Evaluación de la Respuesta en Tumores Sólidos ) y para los que no es posible ningún tratamiento quirúrgico o radioterapéutico (Directrices de la ESMO). La tasa de respuesta (ORR) se sitúa entre el 12% y el 65%, la mediana de supervivencia libre de progresión (SLP) entre 10 y 30 meses – con una toxicidad no desdeñable [4,5]. En particular, los efectos secundarios cutáneos, la hipertensión y la diarrea requieren a menudo reducciones de dosis que limitan el potencial terapéutico. Esto se debe en gran medida a la falta de especificidad de las sustancias. Como inhibidores multicinasa que bloquean múltiples tirosina quinasas, el sorafenib y el lenvatinib presentan cierta actividad fuera del objetivo con las correspondientes consecuencias para la compatibilidad.
Fusiones y mutaciones genéticas como nuevas dianas terapéuticas
En el transcurso de los dos últimos años, se han aprobado en Suiza los inhibidores más específicos de la TRK larotrectinib y entrectinib en presencia de una fusión genética NTRK (receptor tirosina quinasa neurotrófico) como primeras sustancias para el diagnóstico de tumores, es decir, independientemente de la entidad tumoral. Además, los inhibidores selectivos de RET selpercatinib y pralsetinib pueden utilizarse en carcinomas de tiroides diferenciados con fusión RET desde 2021 [6]. Estos avances han cambiado significativamente el tratamiento del cáncer de tiroides avanzado refractario al radioyodo. Por lo tanto, hoy en día deben buscarse específicamente las fusiones NTRK y RET, como subrayó la Dra. Christine Spitzweg, directora del Centro Interdisciplinario de Tiroides de la LMU Klinikum München, en la última reunión anual de la DGHO, la OeGHO, la SSMO y la SGH/SSH [7]. Si existe una fusión correspondiente, existen opciones de tratamiento eficaces con los inhibidores correspondientes con un perfil de toxicidad significativamente mejorado en comparación con los inhibidores multicinasa. Según el experto de renombre mundial, esto también plantea la cuestión de si los inhibidores de RET y TRK deberían utilizarse ya en la primera línea de tratamiento, es decir, antes del lenvatinib o el sorafenib. Según la aprobaciónde la EMA (Agencia Europea del Medicamento), actualmente no está permitido en la UE, pero sí en Suiza [6,8]. Numerosos datos presentados en congresos recientes respaldan el beneficio de los inhibidores de TRK y RET en el carcinoma diferenciado de tiroides avanzado refractario al radioyodo, aunque aún faltan ensayos de fase III [7, 9-12]. Además de su uso para el control de la enfermedad en casos avanzados, también existen informes de casos aislados en los que se han utilizado con éxito inhibidores selectivos de RET para restablecer la capacidad de almacenamiento de yodo radiactivo [7,13,14]. Esta reinducción de la captación de yodo radiactivo también puede lograrse utilizando inhibidores de BRAF y MEK. La base del almacenamiento de yodo y, por tanto, de la eficacia de la terapia con yodo radiactivo es la expresión suficiente del transportador de yoduro de sodio. La vía de señalización BRAF-MEK desempeña aquí un papel importante. Si éste es hiperactivo, como en presencia de una mutación BRAFV600E, se produce una expresión reducida del transportador y, por tanto, una reducción de la captación de yodo radiactivo. El resultado final es una pérdida de sensibilidad al radioyodo [7,15,16]. La administración de inhibidores de BRAF y/o MEK puede restablecer esta situación en algunos casos. Por ejemplo, el inhibidor de BRAF dabrafenib demostró en un estudio piloto ser eficaz en la reinducción de la expresión del transportador de yoduro de sodio para la terapia con yodo radiactivo [7,17]. Sobre esta base, el dabrafenib ya se está utilizando fuera de etiqueta en algunos centros para la rediferenciación; aún no se ha concedido la aprobación oficial [7]. Actualmente se están investigando otros estudios sobre la administración combinada de dabrafenib y el inhibidor de MEK trametinib [7,18,19]. El objetivo de la terapia combinada es, además de una mayor eficacia, la prevención de los mecanismos de escape.
También en estadios más avanzados de la enfermedad, cuando ya no puede lograrse la rediferenciación, los inhibidores de BRAF y MEK representan una nueva opción terapéutica en los tumores mutados por BRAFV600E [7]. La tasa de respuesta con la monoterapia con dabrafenib, así como con la terapia combinada con dabrafenib más trametinib tras 1-3 tratamientos previos con TKI es de aproximadamente el 50% [20]. La mediana de la SLP en el correspondiente ensayo de fase II fue de 11,4 meses con dabrafenib y de 15,1 meses con el tratamiento combinado. Aunque el tratamiento combinado no fue claramente superior a la monoterapia, aquellos pacientes cuya enfermedad progresó en monoterapia con dabrafenib se beneficiaron de la adición de trametinib [7]. Por desgracia, ni los inhibidores de BRAF ni los de MEK han sido aprobados aún para el cáncer de tiroides [6]. Por lo tanto, si existe una mutación BRAFV600E, deberá solicitarse un ensayo curativo individual. Si el objetivo es la rediferenciación y la posterior terapia con yodo radiactivo, el momento de la terapia es un factor importante que debe tenerse en cuenta, según el Prof. Spitzweg. En este caso, el tratamiento debe comenzar antes para crear las mejores condiciones posibles para la terapia con yodo radiactivo. No existe un consenso claro sobre el momento óptimo de tratamiento, pero debería considerarse un ensayo de rediferenciación en todos los pacientes con mutación BRAFV600E [7].
Sustancia activa alternativa Cabozantinib
Además de los inhibidores dirigidos de TRK, RET, BRAF y MEK, actualmente se está probando el uso del inhibidor multicinasa cabozantinib en el carcinoma diferenciado de tiroides refractario al radioyodo [7]. Además de MET y RET, bloquea en particular el VEGFR2 (receptor 2 del factor de crecimiento endotelial vascular) [6]. El uso en segunda y tercera línea tras lenvatinib y/o sorafenib se ha mostrado prometedor hasta ahora, con una mediana de SLP de 12,7 meses y una mediana de supervivencia global (SG) de 34,7 meses en todos los subgrupos [7,21]. Actualmente se está llevando a cabo el ensayo de fase III COSMIC-311, que en los análisis iniciales también muestra un beneficio significativo de cabozantinib en la SLP en la segunda y tercera línea de tratamiento en comparación con el placebo (HR 0,22, IC del 96% 0,13 – 0,36, p<0,0001) [7,22–24]. Como ocurre con otros inhibidores de la multicinasa, la tolerabilidad subóptima es un punto negativo de la terapia. No obstante, el cabozantinib podría ser una opción eficaz para la terapia de segunda y tercera línea de la que se ha carecido hasta ahora. La sustancia está aprobada para esta indicación en EE.UU. desde septiembre de 2021; las aprobaciones de la EMA y Swissmedic están pendientes [6,7,8].
En resumen, la terapia de primera línea con inhibidores selectivos de TRK y RET en el carcinoma diferenciado de tiroides avanzado refractario al radioyodo -en presencia de una alteración genética correspondiente- se ha establecido en los últimos dos años. En el caso de la mutación BRAFV600E, debe considerarse un intento curativo individual y, en los casos menos avanzados, especialmente un intento de rediferenciación utilizando inhibidor de BRAF y, si es necesario, de MEK [7]. El análisis genético molecular ha cobrado mucha más importancia con la aparición de objetivos cada vez más específicos. Para los pacientes en los que no se puede identificar ningún factor impulsor, el tratamiento con lenvatinib o sorafenib sigue siendo la primera opción. En la segunda línea de terapia, el cabozantinib podría recibir pronto la aprobación. Los inhibidores de los puntos de control, como el pembrolizumab, también se están investigando en esta indicación [7].
Avances también en el carcinoma anaplásico de tiroides
Debido a su desdiferenciación, los carcinomas anaplásicos de tiroides tampoco absorben yodo y, por tanto, tampoco radioyodo terapéutico . Representan sólo el 1-3% de todos los carcinomas tiroideos, pero son responsables de la mitad de las muertes específicas de la enfermedad [25]. Clásicamente, la terapia consiste en la resección quirúrgica y la radioquimioterapia adyuvante. El pronóstico es sombrío, con una mediana de supervivencia de unos cuatro o cinco meses, por lo que existe una gran necesidad clínica de desarrollar nuevas opciones terapéuticas [25]. Sin embargo, este empeño plantea algunos retos, sobre todo debido a la desdiferenciación y a los cambios que la acompañan en el espectro de mutaciones. A menudo, en el análisis genético molecular se encuentran más de 100 mutaciones somáticas diferentes. Son especialmente frecuentes las alteraciones de p53, BRAF, RAS y β-catenina, que contribuyen al crecimiento agresivo de los tumores [25].
Las únicas terapias sistémicas aprobadas disponibles en la actualidad son la quimioterapia con doxorrubicina y el tratamiento con inhibidores de RET y TRK en presencia de una fusión adecuada. Además, se utiliza quimioterapia con carboplatino/taxol [25]. Sin embargo, con unas tasas de respuesta de alrededor del 25% y unos tiempos medios de SLP de 3,4 meses con doxorrubicina y de 4,5 meses con carboplatino/taxol, la eficacia de ambos regímenes de quimioterapia deja mucho que desear [25]. Aunque es más probable que la monoterapia con doxorrubicina o taxol se utilice en pacientes de más edad y en peor forma física, el tratamiento con carboplatino/taxol se prefiere en los enfermos más aptos debido a su eficacia ligeramente superior [25]. Entre los enfoques de tratamiento más novedosos se incluye el inhibidor multicinasa lenvatinib en combinación con inhibidores de puntos de control e inhibidores de BRAF – hasta ahora sin aprobación [25].
Aproximadamente una cuarta parte de los pacientes con carcinoma anaplásico de tiroides presentan una mutación BRAFV600E, que podría servir como nueva diana terapéutica en el futuro. Por ejemplo, un ensayo de fase II de terapia combinada con dabrafenib más trametinib mostró una remisión parcial en dos tercios de los 16 pacientes incluidos [25,26]. La ORR fue del 69% y la tasa de SLP a 1 año fue del 79%. Esto representa una mejora significativa con respecto a las opciones quimioterapéuticas anteriores. Los inhibidores de BRAF también pueden tener cabida en el contexto neoadyuvante y representar así una opción de tratamiento para los tumores principalmente irresecables [25,27].
Sin embargo, por desgracia, en la mayoría de los casos no se puede encontrar ningún controlador vulnerable. Como en el caso del carcinoma de tiroides diferenciado resistente al radioyodo, entonces es posible utilizar inhibidores de la multicinasa. Dado que estos tumores suelen presentar una elevadacarga mutacionaltumoral (CMT) y una alta expresión de PD-L1, la terapia combinada del inhibidor de la multicinasa lenvatinib y el inhibidor del punto de control pembrolizumab ha cobrado cada vez más protagonismo en los últimos años [25]. En un primer estudio, seis de ocho pacientes mostraron una respuesta parcial, sólo un paciente experimentó progresión durante la terapia [25,28]. Al cabo de 16 meses, pudo observarse incluso una remisión completa en la mitad de los pacientes. Basándose en estos datos, se pusieron en marcha los ensayos ATLEP centrados en Alemania, que fueron presentados por la Prof. Dra. med. Christine Dierks, asesora principal del Hospital Universitario de Halle, en la reunión anual de la DGHO 2021 [25]. Los ensayos ATLEP investigan el tratamiento combinado de lenvatinib y pembrolizumab en el cáncer de tiroides anaplásico y poco diferenciado. Los resultados iniciales de la fase II en 26 pacientes mostraron una ORR del 38,5% al cabo de tres meses y, en los dos primeros años, dos tercios de los pacientes respondieron al tratamiento. La mediana de la SLP fue de 10 meses y la de la SG de 11 meses [25].
Los inhibidores de RET en el punto de mira
Los inhibidores de RET han surgido como una nueva opción de terapia dirigida en los últimos años. Hasta ahora, los dos principios activos selpercatinib (LOXO-292) y pralsetinib (BLU-667) han sido aprobados en Suiza en 2021. Los dos compuestos se desarrollaron en paralelo y han completado los ensayos iniciales de fase I/II (ARROW, LIBRETTO-001) [10,11,34]. Por un lado, pueden utilizarse en el carcinoma medular de tiroides con mutación RET en la segunda línea de tratamiento tras el vandetanib, y por otro en el carcinoma diferenciado de tiroides avanzado RET-fusión-positivo [6].
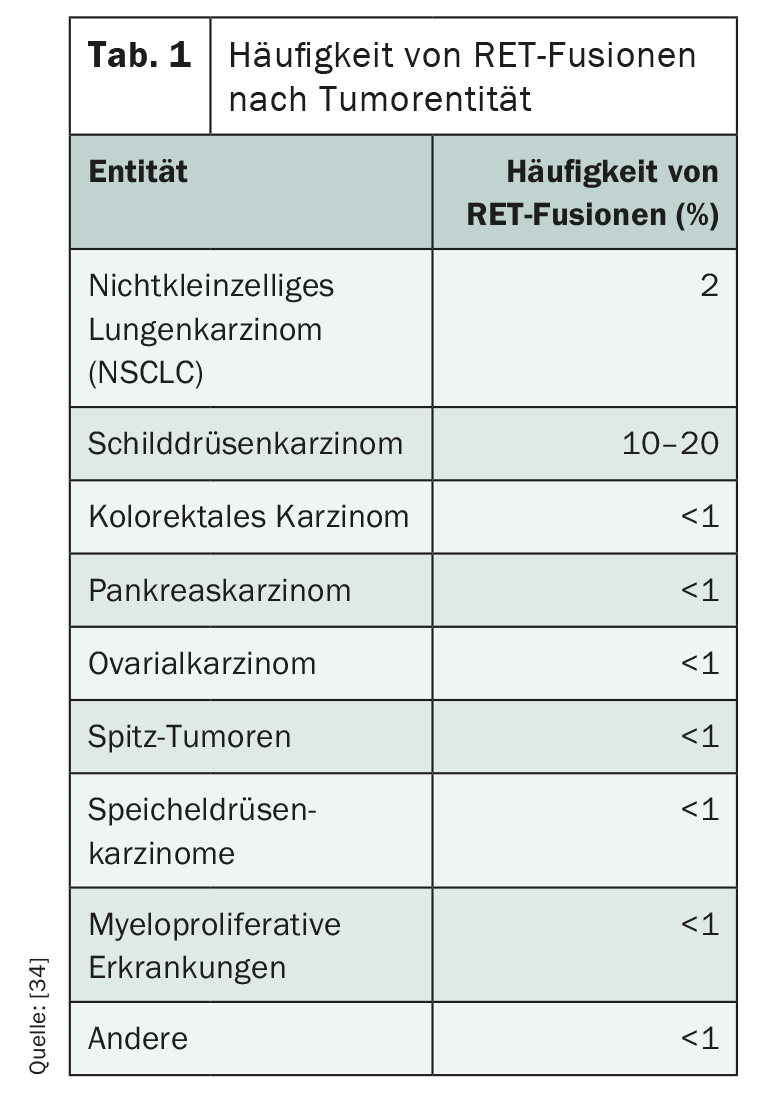
Las alteraciones RET desempeñan un papel importante como impulsoras, especialmente en los carcinomas metastásicos de tiroides y bronquios, pero también se dan en otras entidades (Tab. 1 ). Mientras que el 1-2% de los carcinomas pulmonares de células no pequeñas (CPCNP) presentan dicha alteración genética, la fusión RET puede detectarse en el 5-10% de los carcinomas papilares de tiroides [29]. Los niños y los adultos jóvenes se ven afectados con especial frecuencia, y la radiación ionizante es un factor de riesgo [30,31]. A diferencia del carcinoma papilar de tiroides, una mutación puntual suele ser decisiva para la activación independiente del ligando de la quinasa del receptor RET en el subtipo medular [32]. Mientras que las neoplasias endocrinas múltiples hereditarias (NEM) y el carcinoma medular de tiroides familiar siempre presentan mutaciones en la línea germinal de RET, las mutaciones somáticas de RET se producen en aproximadamente el 60% de los carcinomas medulares de tiroides esporádicos [34]. En la mayoría de los casos, las alteraciones activadoras de RET excluyen otras mutaciones impulsoras [34].
En el carcinoma medular de tiroides, así como en el papilar y folicular, existe ahora una nueva opción terapéutica con los dos agentes activos selpercatinib y pralsetinib, que, según los datos actuales, no sólo es eficaz sino también mejor tolerado que los inhibidores de la multicinasa utilizados hasta la fecha debido a su mayor selectividad.
Además, los dos nuevos fármacos pueden sortear un importante mecanismo de resistencia que a menudo interfiere en la terapia con inhibidores multicinasa [34]. Así, el selpercatinib y el pralsetinib se unen a la quinasa RET de una forma nueva. Los resultados de los ensayos de fase III y de primera línea se esperan para finales de este año y podrían conducir a que el pralsetinib y el selpercatinib se autoricen también en la UE como terapia de primera línea tras el fracaso del tratamiento con yodo radiactivo [34]. Este ya es el caso de Suiza [6]. Si se desarrolla resistencia al selpercatinib o al pralsetinib, el cambio a la otra sustancia no se considera actualmente muy prometedor, ya que la resistencia a ambos agentes parece caracterizarse por mutaciones similares [33].
Las pruebas para detectar alteraciones RET atacables son obligatorias hoy en día, al menos para los carcinomas metastásicos de tiroides y bronquios. El patrón oro es la NGS (secuenciación de próxima generación) [34]. En caso de falta de disponibilidad, las fusiones RET pueden investigarse mediante FISH (hibridación fluorescente in situ) y las mutaciones puntuales RET mediante PCR (reacción en cadena de la polimerasa) . Sin embargo, un resultado positivo de FISH o PCR debe ser validado por NGS [34]. En la actualidad, la biopsia líquida no es un sustituto completo de un examen de tejido fino [34]. No todas las mutaciones puntuales RET encontradas en la NGS son necesariamente predictivas de una respuesta a la terapia dirigida. Especialmente si el tumor presenta muchas mutaciones en diferentes genes y no se trata de un carcinoma bronquial o de tiroides, es aconsejable consultar a expertos antes de considerar RET como diana terapéutica [34].
Literatura:
- Krebsliga Schweiz: El cáncer en Suiza: cifras importantes. Estado Diciembre de 2020. www.krebsliga.ch/fileadmin/downloads/sheets/zahlen-krebs-in-der-schweiz.pdf.
- Gild ML, et al: Guía clínica para el cáncer diferenciado de tiroides refractario al radioyodo. Clin Endocrinol (Oxf). 2018; 88(4): 529-537.
- Durante C, et al.: Resultados a largo plazo de 444 pacientes con metástasis a distancia de carcinoma papilar y folicular de tiroides: beneficios y límites de la terapia con yodo radiactivo. J Clin Endocrinol Metab. 2006; 91(8): 2892-2899.
- Schlumberger M, et al: Lenvatinib frente a placebo en el cáncer de tiroides refractario al radioyodo. N Engl J Med. 2015; 372(7): 621-630.
- Brose MS, et al: Sorafenib en el cáncer de tiroides diferenciado refractario al yodo radiactivo, localmente avanzado o metastásico: un ensayo aleatorizado, doble ciego, de fase 3. Lancet. 2014; 384(9940): 319-328.
- Información sobre medicamentos de Swissmedic. www.swissmedicinfo.ch (última consulta: 22.10.2021).
- Spitzweg C: Terapia molecular dirigida y nuevos enfoques terapéuticos en el carcinoma diferenciado de tiroides refractario al radioyodo. Reunión anual de las sociedades alemana, austriaca y suiza de hematología y oncología médica; Berlín, 04.10.2021.
- Información sobre medicamentos de la EMA. www.ema.europa.eu/en/medicines/human (última consulta: 22.10.2021).
- Cabanillas ME, et al: Tratamiento con larotrectinib del cáncer de tiroides de fusión TRK avanzado. Congreso ESMO 2020, E-Poster Display, Abstract #1916P.
- Subbiah V, et al: Pralsetinib para pacientes con cáncer de tiroides avanzado o metastásico con alteración de RET (ARROW): un estudio de múltiples cohortes, abierto, de registro, de fase 1/2. Lancet Diabetes Endocrinol. 2021; 9(8): 491-501.
- Wirth LJ, et al: Eficacia del selpercatinib en los cánceres de tiroides con alteración de RET. N Engl J Med. 2020; 383(9): 825-835.
- Sherman EJ, et al: Eficacia y seguridad del selpercatinib en pacientes con cáncer de tiroides con alteración de RET: actualización de un ensayo clínico. Reunión anual de la ASCO 2021, Sesión de pósteres Cáncer de cabeza y cuello, Resumen nº 6073.
- Groussin L, et al.: Captación de radioyodo potenciada por selpercatinib en el cáncer de tiroides con RET. Tiroides. 2021.
- Lee YA, et al: La terapia dirigida a la fusión de NTRK y RET en el cáncer pediátrico de tiroides produce una respuesta tumoral y una captación de radioyodo. J Clin Invest. 2021; 131(18).
- Cabanillas ME, Ryder M, Jiménez C: Terapia dirigida para el cáncer de tiroides avanzado: los inhibidores de la cinasa y más allá. Endocr Rev. 2019; 40(6): 1573-1604.
- Spitzweg C, et al: Cáncer diferenciado de tiroides avanzado refractario al radioyodo: el simportador de yoduro sódico y otras dianas terapéuticas emergentes. Lancet Diabetes Endocrinol. 2014; 2(10): 830-842.
- Rothenberg SM, et al: Rediferenciación del cáncer papilar de tiroides metastásico con mutación BRAF V600E refractario al yodo con dabrafenib. Clin Cancer Res. 2015; 21(5): 1028-1035.
- Leboulleux S, et al: MERAIODE: A Redifferentiation Phase II Trial With Trametinib and Dabrafenib Followed by Radioactive Iodine Administration for Metastatic Radioactive Iodine Refractory Differentiated Thyroid Cancer Patients with a BRAFV600E Mutation (NCT 03244956). Congreso ENDO 2021.
- Leboulleux S, et al: Resultados de la terapia combinada para la rediferenciación en DTC con mutación de BRAF y RAS. Reunión anual de ITOG 2021.
- Shah MH, et al: Resultados del ensayo aleatorizado de fase II de dabrafenib frente a dabrafenib más trametinib en el carcinoma papilar de tiroides con mutación BRAF. Reunión anual de la ASCO 2017, Sesión de debate de pósteres Cáncer de cabeza y cuello, Resumen nº 6022.
- Cabanillas ME, et al: Cabozantinib como terapia de rescate para pacientes con cáncer diferenciado de tiroides refractario a los inhibidores de la tirosina cinasa: resultados de un ensayo multicéntrico de fase II del Grupo Internacional de Oncología Tiroidea. J Clin Oncol. 2017; 35(29): 3315-3321.
- Brose MS, et al: Cabozantinib frente a placebo en pacientes con cáncer de tiroides diferenciado (CTD) refractario al radioyodo (RAI) que han progresado tras una terapia previa dirigida al VEGFR: Resultados del ensayo de fase 3 COSMIC-311. Reunión anual de la ETA 2021, sesión oral 3, resumen nº 18.
- Brose MS, et al: Cabozantinib frente a placebo en pacientes con cáncer de tiroides diferenciado refractario al radioyodo que han progresado tras una terapia previa dirigida al VEGFR: Resultados del ensayo de fase 3 COSMIC-311. Reunión anual de la ASCO 2021, Sesión de resúmenes orales Cáncer de cabeza y cuello, resumen nº 6001.
- Capdevila J, et al: Cabozantinib frente a placebo en pacientes con cáncer de tiroides diferenciado refractario al radioyodo que han progresado tras una terapia previa dirigida al VEGFR: Resultados actualizados del ensayo de fase III COSMIC-311 y análisis de subgrupos preespecificados por terapia previa. Congreso ESMO 2021, Mini sesión oral – NETs y tumores endocrinos, Resumen #LBA67.
- Dierks C: Terapia sistémica del carcinoma anaplásico de tiroides. Reunión anual de las sociedades alemana, austriaca y suiza de hematología y oncología médica; Berlín, 04.10.2021.
- Subbiah V, et al: Tratamiento con dabrafenib y trametinib en pacientes con cáncer anaplásico de tiroides con mutación BRAF V600 localmente avanzado o metastásico. J Clin Oncol. 2018; 36(1): 7-13.
- Wang JR, et al: Resección quirúrgica completa tras el tratamiento neoadyuvante con dabrafenib más trametinib en el carcinoma anaplásico de tiroides con mutación BRAF(V600E). Tiroides. 2019; 29(8): 1036-1043.
- Dierks C, et al.: La combinación de lenvatinib y pembrolizumab es una opción de tratamiento eficaz para el carcinoma anaplásico y poco diferenciado de tiroides. Tiroides. 2021; 31(7): 1076-1085.
- Caracterización genómica integrada del carcinoma papilar de tiroides. Celda. 2014; 159(3): 676-690.
- Vanden Borre P, et al: El carcinoma de tiroides pediátrico, en adolescentes y adultos jóvenes alberga frecuentes y diversas alteraciones genómicas seleccionables, incluidas las fusiones de quinasas. Oncólogo. 2017; 22(3): 255-263.
- Ricarte-Filho JC, et al: Identificación de oncogenes de fusión de quinasas en cánceres de tiroides inducidos por la radiación post-Chernobyl. J Clin Invest. 2013; 123(11): 4935-4944.
- Mulligan LM: RET revisitado: ampliando la cartera oncogénica. Nat Rev Cancer. 2014; 14(3): 173-186.
- Solomon BJ, et al: RET Solvent Front Mutations Mediate Acquired Resistance to Selective RET Inhibition in RET-Driven Malignancies. J Thorac Oncol. 2020; 15(4): 541-549.
- Weiler D, Gautschi O: Carcinomas con RET: nuevos inhibidores de RET para el tratamiento de tumores sólidos. info@oncology. 2021; 01: 8-11.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2022; 10(1): 32-35