La esclerosis múltiple es la enfermedad neurológica más común en adultos jóvenes. Incluso a una edad temprana, puede provocar una discapacidad permanente, aunque la actividad de la enfermedad al principio de la misma parece ser relevante para el curso posterior de la enfermedad. Por lo tanto, es importante iniciar pronto una terapia eficaz. Gracias a los ensayos clínicos finalizados recientemente y a los prometedores resultados de la investigación actual, cabe esperar un aumento de las opciones terapéuticas en los próximos meses y años.
La esclerosis múltiple (EM) es la enfermedad autoinmune más común del sistema nervioso central (SNC), cuya base fisiopatológica aún no se ha aclarado en detalle. Basándose en los nuevos criterios según McDonald 2010, el diagnóstico de EM suele realizarse tras el primer episodio clínico [1]. En la mayoría de los casos existe un curso recidivante (“esclerosis múltiple remitente recidivante”, EMRR).
En el curso de la enfermedad, muchos pacientes experimentan una progresión secundaria-crónica de los síntomas independiente de las recaídas (“EM secundaria progresiva”, EMPS); al cabo de diez años, éste es el caso de aproximadamente el 30-40% de los pacientes [2]. La EM primaria progresiva (EMPP) está presente en el 10-20% de los pacientes, y este curso también puede incluir recaídas superpuestas [3].
La fase inicial de la EMRR suele corresponder formalmente a un síndrome clínicamente aislado (SCA). En los pacientes con SCA, no se cumplen los criterios McDonald de 2010 para el diagnóstico de la EMRR, pero a menudo debe asumirse como probable la presencia de EM [4].
Los procesos en la fase temprana de las enfermedades parecen tener una influencia significativa en el curso posterior de la enfermedad, por lo que es importante un inicio temprano de la terapia. La transición formal del SCA a una EM clínicamente confirmada puede retrasarse y el curso posterior puede verse influido positivamente por el uso temprano de una terapia básica [5, 6].
Más recientemente, se ha avanzado en el tratamiento de la SCA y la EMRR. Además de las sustancias orales (como el ácido fumárico, el laquinimod, la teriflunomida), las terapias con anticuerpos (como el alemtuzumab, el daclizumab, el ocrelizumab) también se encuentran en estudios de fase II o III o ya se han completado algunos estudios correspondientes.
El ácido fumárico, la teriflunomida y el alemtuzumab ya están aprobados en algunos países, por lo que cabe esperar una ampliación de las opciones terapéuticas también en Suiza en un futuro próximo. (Tab. 1 y Fig. 1).
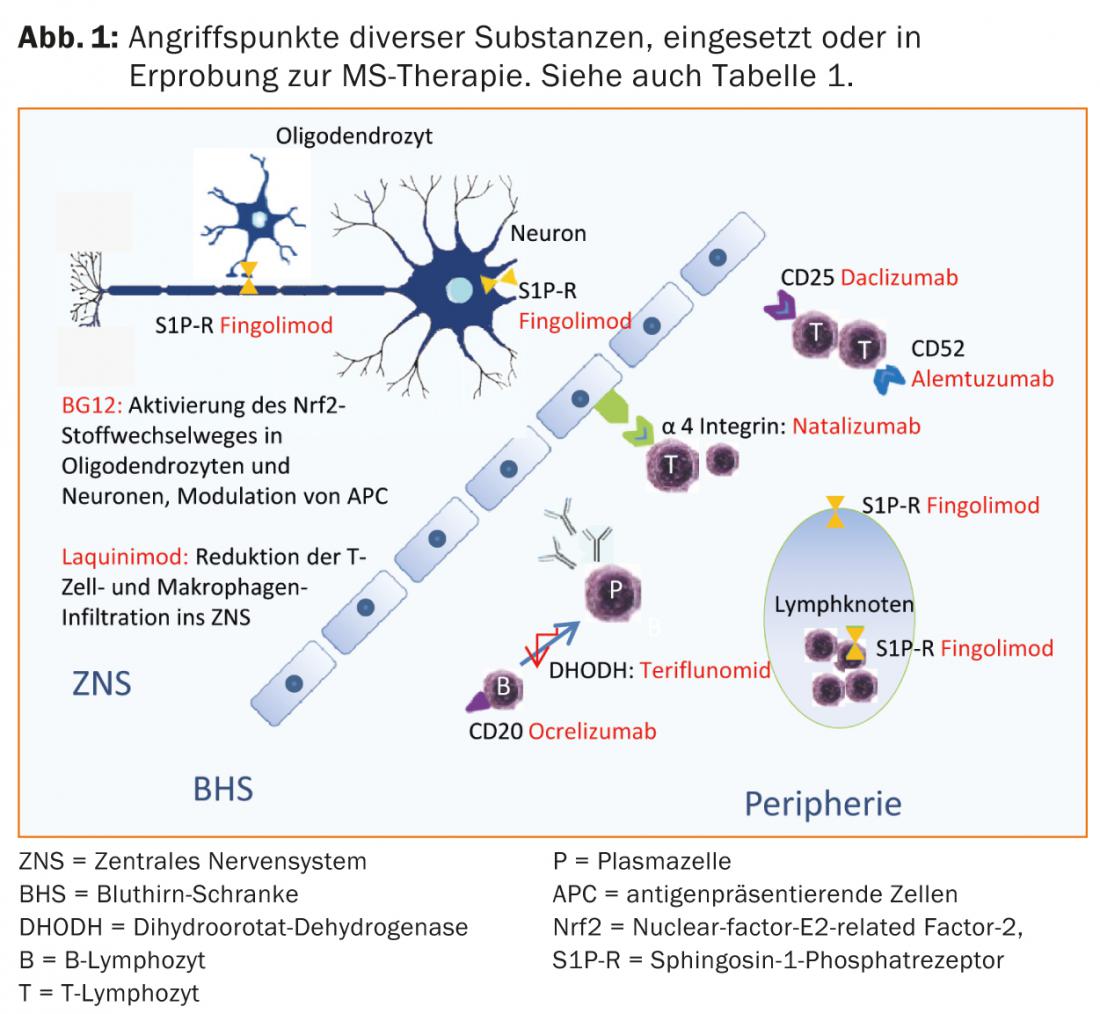
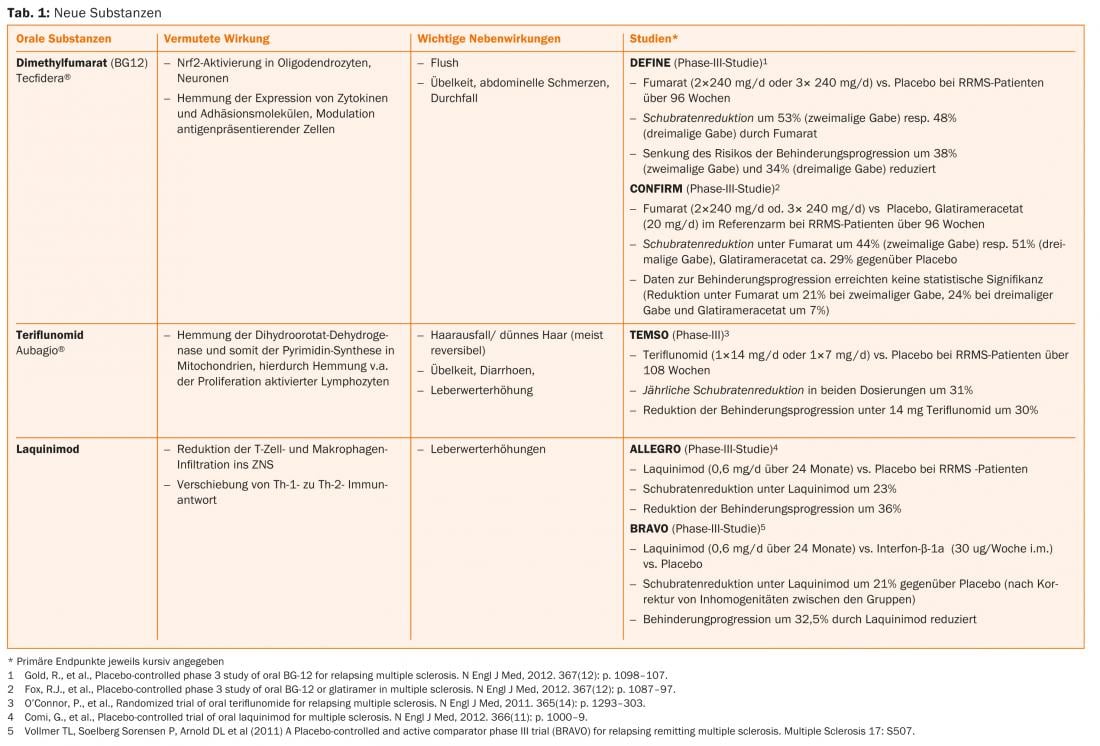
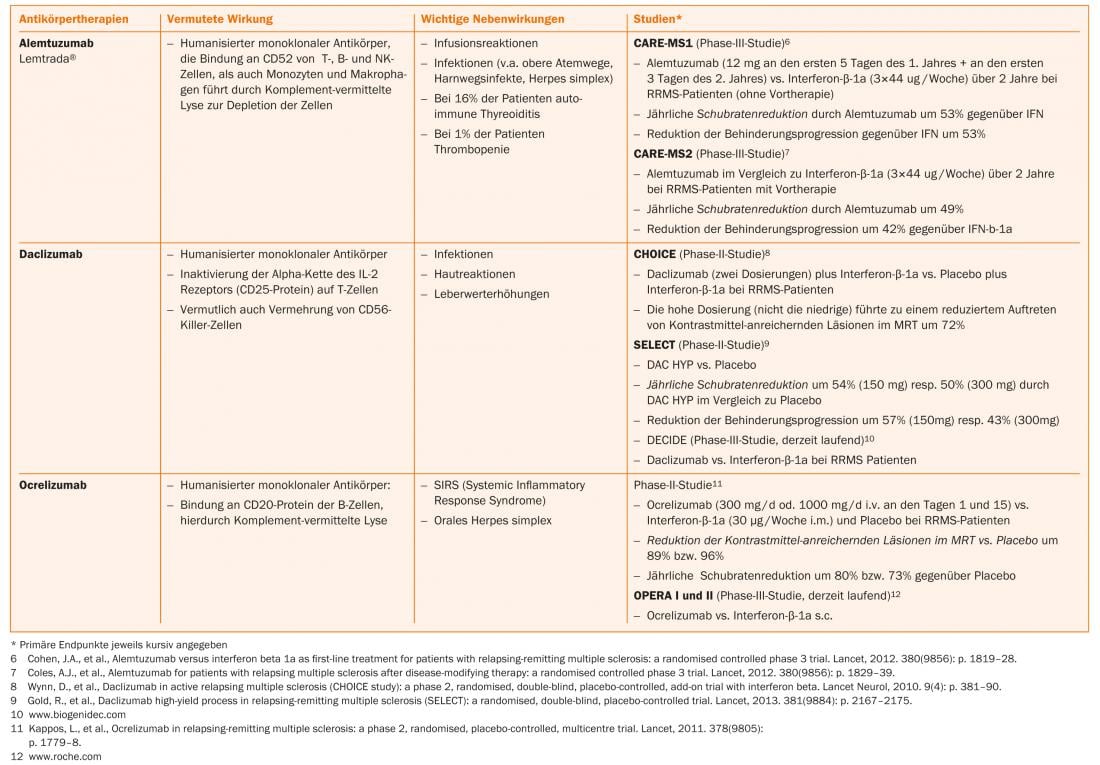
Opciones terapéuticas actuales
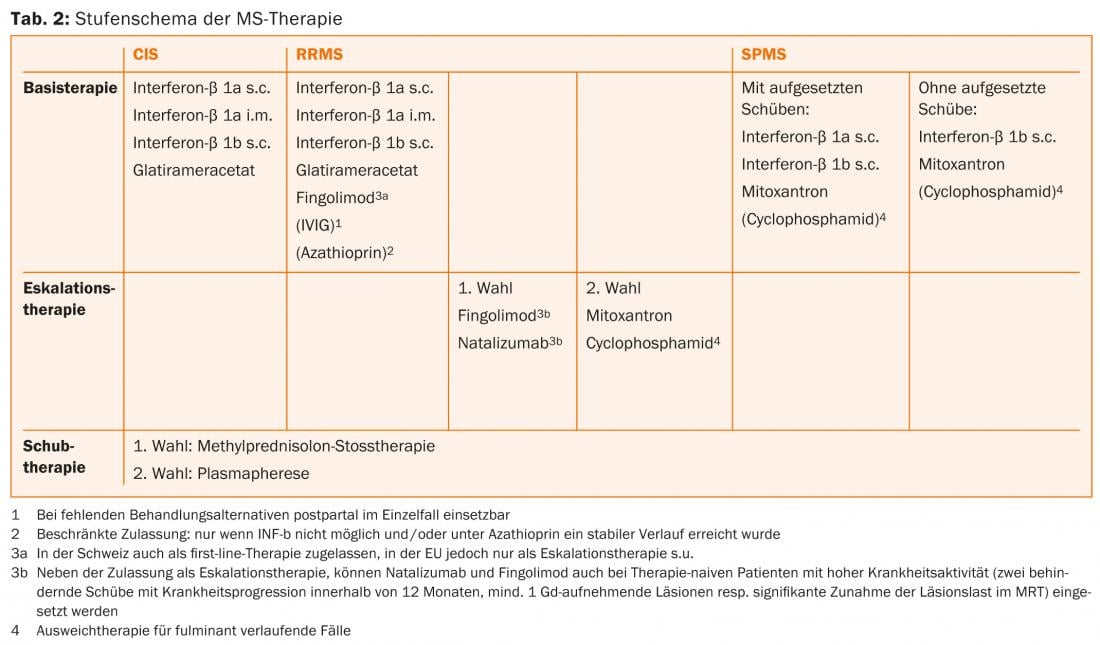
Para el tratamiento de los pacientes con SCA y EMRR, los interferones beta (interferón-beta 1b s.c. [Betaferon®]) están disponibles en la UE y Suiza. [Betaferon®], interferón-beta 1a s.c. e i.m. [Rebif® y Avonex®] y Glatira. [Rebif® y Avonex®] y acetato de glatiramero s.c. [Copaxone®] han sido aprobados [7, 8]. Para estas sustancias, que suele inyectar el propio paciente, existen muchos años de amplia experiencia y se caracterizan en particular por un perfil de seguridad favorable [9]. En 2011, el fingolimod también fue aprobado en Suiza como terapia de primera línea para el tratamiento de la EMRR [10]. Deben realizarse exámenes de imagen por resonancia magnética (IRM) inicialmente y con regularidad durante el curso de la terapia para determinar la situación inicial y para el seguimiento posterior de la terapia.
Los interferones (IFN) utilizados se producen de forma recombinante. Los IFN endógenos son una parte integral del sistema inmunitario y son importantes para la respuesta inmunitaria a las infecciones víricas. El mecanismo exacto de acción de los preparados de IFN-β en el tratamiento de la CIS/RRMS aún no se conoce por completo. A menudo se producen efectos secundarios parecidos a los de la gripe, sobre todo en los primeros meses de tratamiento, que pueden reducirse tomando un antiinflamatorio no esteroideo o paracetamol [11]. En los puntos de inyección pueden producirse efectos secundarios locales como dolor, enrojecimiento de la piel, lipoatrofia e induración [12, 13]. Como alternativa a los interferones beta, puede utilizarse el copolímero acetato de glatiramero, una mezcla heterogénea de polipéptidos sintéticos compuestos por cuatro aminoácidos cuyo mecanismo de acción tampoco se conoce por completo. [14]. Los efectos secundarios similares a los de la gripe no son relevantes con este fármaco, pero pueden producirse reacciones posteriores a la inyección con síntomas de rubor e induración local o lipoatrofia en los puntos de inyección [15].
En Suiza, el fingolimod (comprimido) también está aprobado para la terapia básica de primera línea de la EMRR. El fingolimod es la primera terapia de la EM modificadora de la enfermedad, disponible por vía oral y generalmente bien tolerada, que fue superior al comparador interferón-beta 1a i.m. en uno de los estudios pivotales [17]. El fingolimod se une como antagonista no selectivo de alta afinidad a los receptores de esfingosina-1-fosfato (S1P-R) de los linfocitos, impidiendo así su emigración de los órganos linfoides secundarios. La redistribución de los linfocitos provoca linfopenia, y la metabolización en el hígado puede dar lugar a un aumento de los valores hepáticos. Debido a la expresión de los receptores de S1P en la zona del sistema de conducción cardiaco, pueden producirse efectos secundarios como bradicardia o una alteración de la conducción auriculoventricular, especialmente durante la primera toma. Por esta razón, es necesario realizar controles de la tensión arterial, el pulso y el ECG en la primera administración, así como después de las pausas en la terapia. El edema macular puede producirse como complicación poco frecuente [16]. Debido a los efectos sobre el sistema inmunológico, los pacientes cuyo tipo de piel predispone a las neoplasias malignas deben someterse a exámenes dermatológicos periódicos [17, 18]. Además, las infecciones víricas en particular se ven favorecidas. En los pacientes que no hayan tenido varicela, deben determinarse los títulos de anticuerpos contra el virus de la varicela zoster antes de iniciar la terapia. Los pacientes seronegativos deben ser vacunados.
Nuevas sustancias como el alemtuzumab (infusión, sólo para pacientes con actividad actual de la enfermedad), el dimetilfumarato (comprimido) y la teriflunomida (comprimido) ya han sido aprobadas para la terapia de la EMRR en algunos países y se han presentado para su aprobación en Suiza.
Terapia de escalada
Se puede considerar el escalado de la terapia de primera línea a fingolimod (en sí mismo de primera línea en Suiza, no en la UE) [16, 19] o natalizumab [20] si se ha producido ≥1 recaída con la terapia de base en el año anterior y hay ≥9 lesiones hiperintensas en T2 o ≥1 lesión aguda, es decir, que absorbe el contraste, en la RM. Los IFN se mencionan como la terapia básica correspondiente en las indicaciones. Sin embargo, la práctica actual consiste en evaluar igualmente la escalada en pacientes tratados con acetato de glatiramero o, en caso de escalada a natalizumab, fingolimod. El tratamiento primario con natalizumab o (en la UE, no restringido en Suiza) fingolimod sólo está indicado para pacientes que ya hayan tenido ≥2 recaídas con progresión de la discapacidad en el último año y que presenten ≥1 lesión con realce de contraste o un aumento “significativo” de la carga de la lesión T2 detectable en la resonancia magnética cerebral.
El natalizumab es un anticuerpo monoclonal humanizado contra la molécula de adhesión celular α4-integrina, que los linfocitos necesitan para entrar en el SNC. En el estudio pivotal, el natalizumab redujo la tasa de recaídas en un 68% en comparación con el placebo y también tuvo un buen efecto sobre la progresión de la discapacidad y los signos de actividad de la enfermedad en las imágenes de resonancia magnética [20]. El natalizumab se administra mediante infusión cada 28 días y suele tolerarse bien. El uso de este fármaco tan eficaz está limitado por el riesgo de leucoencefalopatía multifocal progresiva (LMP). Esta infección oportunista causada por el virus JC suele provocar discapacidades graves, siendo posible un desenlace letal. No existe un tratamiento específico para la LMP. En la LMP, el natalizumab se suspende por tanto y se lava con plasmaféresis para restablecer la inmunocompetencia lo antes posible. Algo más de la mitad de los pacientes con EM y la población sana correspondiente son portadores del virus JC. Mientras que los pacientes seronegativos para JC tienen un riesgo bajo de LMP (aprox. 1:10.000) [21], el riesgo en los pacientes seropositivos puede aumentar hasta aprox. 1:89 durante el tercer y cuarto año si se había administrado terapia inmunosupresora en el pasado. Por ello, en función del riesgo individual, es necesario asesorar cuidadosamente a los pacientes sobre los beneficios y los riesgos [22]. Al cambiar de fingolimod a natalizumab, debe observarse un periodo de lavado de unos dos meses, y debe esperarse al menos a la normalización de los recuentos de linfocitos para [23]. Tras una cuidadosa revisión, la mitoxantrona, la ciclofosfamida o la azatioprina [23] pueden utilizarse como fármacos de reserva y agentes de segunda línea en la terapia de intensificación (tab. 2). Pueden considerarse otras terapias no indicadas en la etiqueta.
Por último, cabe mencionar que las combinaciones de las terapias para la EM mencionadas no están aprobadas.
Deseo de tener hijos, embarazo, lactancia
La EM suele afectar a mujeres jóvenes. Por tanto, la cuestión del tratamiento durante la maternidad, el embarazo y la lactancia es relevante. Está contraindicado el uso de los agentes quimioterapéuticos teratogénicos o inmunosupresores azatioprina, ciclofosfamida y mitoxantrona. También con el fingolimod debe observarse un periodo de lavado antes de finalizar la anticoncepción, si es posible. El acetato de glatiramero ha recibido la mejor calificación por parte de la Agencia de Alimentos y Medicamentos de EE.UU. (FDA) en cuanto al riesgo por exposición durante el embarazo, ya que este fármaco no ha sido teratogénico en estudios con animales y los datos hasta la fecha en humanos también son favorables [24]. Tampoco en el caso de los interferones y el natalizumab se ha observado hasta ahora teratogenicidad en humanos.
Aunque estos datos no proceden de ensayos controlados, debe considerarse la posibilidad de interrumpir el tratamiento con uno de estos fármacos sólo cuando se produzca el embarazo, teniendo en cuenta la etiqueta respectiva. Durante el embarazo, cuando la actividad de recaída suele ser baja, el tratamiento sólo se administra en casos excepcionales. El tratamiento tampoco suele administrarse durante la lactancia, sobre todo porque muchas pacientes con EM no dan el pecho para poder reiniciar el tratamiento tras el parto, después del cual suele haber un alto nivel de actividad de la enfermedad.
Uso de la terapéutica básica en formas progresivas
En la actualidad no existen opciones de tratamiento eficaces con un efecto claro para la forma progresiva del curso, sino que, además de una terapia individual, multimodal y sintomática, también están en primer plano las medidas fisioterapéuticas y de rehabilitación. En el caso de la EMPS, la opción de utilizar IFN-β-1b y, si hay recaídas, también IFN-β-1a s.c. [25] es una opción.
Si el curso es particularmente agresivo, debe discutirse la administración de mitoxantrona [26]. Debe realizarse de antemano una evaluación cuidadosa de la relación riesgo-beneficio, especialmente debido al mayor riesgo de leucemia [27] y cardiomiopatía, así como al efecto tóxico sobre la función gonadal. La duración de la terapia está limitada por la dosis acumulativa total que puede aplicarse (en Suiza un máximo de 100 mg/m2 de superficie corporal). Esto puede superarse si es necesario bajo un control cuidadoso de la función cardiaca.
Conclusión
El tratamiento precoz del CIS/RRMS es importante para la evolución de la enfermedad. Cada vez hay más fármacos disponibles para este fin, que difieren en términos de eficacia, seguridad, perfil de efectos secundarios y comodidad terapéutica. La creciente oferta terapéutica para la EM ofrece la posibilidad de una terapia más individualizada, adaptada al perfil específico del paciente.
Helen Könnecke
PD Michael Linnebank, MD
Literatura:
- Polman CH, et al: Ann Neurol 2011; 69(2): 292-302.
- Weinshenker BG, et al: Brain 1989; 112(Pt1): 133-146.
- Weinshenker BG: Semin Neurol 1998; 18(3): 301-307.
- Miller DH, et al: Mult Scler 2008; 14(9): 1157-1174.
- Weinshenker BG, et al: Cerebro 1989; 112(Pt 6): 1419-1428.
- Hirst C, et al: J Neurol 2008; 255(2): 280-287.
- Buttmann M, Rieckmann P: Expert Rev Neurother 2007; 7(3): 227-239.
- Comi G, et al: Ann Neurol 2011; 69(1): 75-82.
- Reder AT, et al: Neurología 2010; 74(23): 1877-1885.
- www.swissmedic.ch.
- Hartung HP, et al: Nervenarzt 2013; 84(6): 679-704.
- Nikfar S, Rahimi R, Abdollahi M: Clin Ther 2010; 32(11): 1871-1888.
- Plosker GL: Fármacos para el SNC 2011; 25(1): 67-88.
- O’Connor P, et al: Lancet Neurol 2009; 8(10): 889-897.
- Ford C, et al: Mult Scler 2010; 16(3): 342-350.
- Cohen JA, et al: NEJM 2010; 362(5): 402-415.
- Comi G, et al: Mult Scler 2010; 16(2): 197-207.
- Kappos L, et al: NEJM 2006; 355(11): 1124-1140.
- Kappos L, et al: NEJM 2010; 362(5): 387-401.
- Polman CH, et al: NEJM 2006; 354(9): 899-910.
- Bloomgren G, et al: NEJM 2012; 366(20): 1870-1880.
- www.biogenidec.ch.
- Directriz de la DGN sobre el diagnóstico y la terapia de la EM. Diener HC, Weimar C (eds.): Directrices de la Sociedad Alemana de Neurología Thieme Verlag: Stuttgart 2012, 430-475.
- Salminen HJ, Leggett H, Boggild M: J Neurol 2010; 257(12): 2020-2023.
- Kappos L, et al: Neurología 2004; 63(10): 1779-1787.
- Hartung HP, et al: Lancet 2002; 360(9350): 2018-2025.
- Martinelli V, et al: Neurología 2011; 77(21): 1887-1895.
InFo Neurología y Psiquiatría 2013; 11(6): 13-20











